Перинатальная гипоксически-ишемическая (ГИ) энцефалопатия является одной из основных причин острых повреждений мозга, приводящих к различным тяжелым неврологическим нарушениям, в том числе церебральному параличу. Несмотря на значительный прогресс в медицине новорожденных в целом, методы лечения гипоксических повреждений мозга весьма ограничены. В широком смысле потенциальные терапевтические стратегии могут быть разделены на нейропротекторные и усиливающие пластичность мозга. Нейропротекторное вмешательство направлено на предотвращение быстрых патологических каскадов реакций, приводящих к гибели нейронов и других клеток мозга. Эта группа включает в себя такие методы воздействия, как уже вошедшая в клиническую практику и доказавшая свою эффективность гипотермия [1], а также фармакотерапия, например, при помощи антиоксидантов или антагонистов глутамата [2]. Однако на сегодняшний день практически отсутствуют эффективные фармакологические нейропротекторы, разрешенные к клиническому использованию. Кроме того, надо отметить, что нейропротекция эффективна лишь в случае быстрого реагирования на поражение (в течение первых 6 часов) [3], но такое временное окно не всегда клинически реализуемо, поскольку гипоксические повреждения не всегда быстро диагностируются. Поэтому существует острая потребность в поиске эффективных представителей второй группы методов – средств, усиливающих пластичность мозга, которые обладают более широким временным терапевтическим окном [4]. Ярким примером подобной терапевтической стратегии, которая способна приводить к восстановлению нервной ткани в отложенном периоде, является трансплантация стволовых или прогениторных клеток. Они способны восстанавливать поврежденные структуры головного мозга за счет интеграции и/или трофического воздействия, в результате которых образуются новые нейроны, синапсы и кровеносные сосуды.
Основные типы стволовых клеток, используемых для терапии новорожденных
Стволовые клетки (СК) являются недифференцированными клетками, способными к делению и дифференцировке в специализированные типы клеток. СК можно разделить на три основные группы в зависимости от источника их получения: эмбриональные (ЭСК), фетальные (ФСК) и постнатальные (ПСК). Данные группы клеток в первую очередь различаются между собой дифференцировочным потенциалом, или потентностью. Так, оплодотворенная яйцеклетка и зигота обладают тотипотентными свойствами и дифференцируются в любые клетки эмбриональных и экстраэмбриональных тканей. В свою очередь эмбриональные клетки являются плюрипотентными и дают начало всем трем зародышевым листкам: эктодерме, мезодерме и энтодерме, то есть ЭСК могут дифференцироваться во все типы клеток организма. Культуру ЭСК человека получают из внутренней клеточной массы бластоцисты, что соответствует 5–6-м суткам после оплодотворения яйцеклетки. ФСК получают из абортивного материала плодов на сроке гестации 9–12 недель. Они являются мультипотентными и могут дифференцироваться только в определенные виды специализированных клеток внутри одной ткани. Так, например, фетальная нейральная стволовая клетка (НСК) может дифференцироваться преимущественно в нейроны, астроглиальные клетки и олигодендроциты. Мультипотентными свойствами обладают также и постнатальные СК, к которым относятся гемопоэтические СК (ГСК), мультипотентные мезенхимальные стромальные клетки (ММСК) и тканеспецифичные прогениторные клетки. В отличие от ФСК, СК взрослого организма чаще всего имеют сниженный пролиферативный потенциал и обладают меньшей потентностью по сравнению с фетальными. По мнению ряда исследователей постнатальные СК обладают достаточно ограниченным терапевтическим потенциалом, связанным с тем, что в процессе онтогенеза они претерпевают ряд эпигенетических модификаций [5], негативно влияющих на их свойства.
Также очень часто используется термин «прогениторные» клетки или «клетки предшественники». Обычно под этими терминами понимают пролиферирующие клетки, имеющие тенденцию к дифференцировке в конкретный тип клеток и обладающих унипотентностью или олигопотентностью. Например, к прогениторным клеткам можно отнести сателлитные клетки мышечной ткани, делящиеся клетки эпителия и некоторые другие. Наиболее важное различие между СК и прогениторными клетками заключается в том, что СК могут делиться бесконечно, тогда как клетки-предшественники способны делиться только ограниченное число раз. Стоит отметить, что на сегодняшний день еще ведутся дискуссии о классификации СК и универсальной устоявшейся терминологии пока не существует.
Поскольку каждый тип СК обладает уникальными характеристиками, вполне вероятно, что они будут по-разному взаимодействовать с ишемизированной тканью и реализовывать различные защитные механизмы. С другой стороны, некоторые механизмы являются общими для всех типов СК, особенно относящиеся к индукции регенерации в головном мозге. В следующих разделах мы рассмотрим характеристики конкретных типов клеток, которые могут быть использованы для терапии различных ишемических патологий неонатального головного мозга.
Доклинические исследования терапевтической эффективности СК
Доклинические исследования клеточной терапии охватывают все аспекты оценки эффективности, включая показатели безопасности и объяснение механизмов действия [6]. Поскольку многие неонатальные патологии мозга вызваны гипоксией/ишемией, то основной экспериментальной моделью для изучения нейропротекторных стратегий является моделирование ГИ энцефалопатии у новорожденных крыс или мышей путем унилатеральной перерезки общей сонной артерии с последующей продолжительной гипоксией [7]. Такая процедура приводит к повреждению коры головного мозга, подкорковых структур, таких как стриатум и гиппокамп, а также перивентрикулярной лейкомаляции со стороны перерезанной артерии [8]. Такой характер повреждений аналогичен тому, который наблюдается у новорожденных детей с неонатальной энцефалопатией. Большинство доклинических исследований, рассматриваемых в данном обзоре, были выполнены на данной модели с использованием следующих типов клеток: НСК, ММСК и клетки пуповинной крови (КПК).
Нейральные СК
НСК могут быть получены из фетального мозга [9–11], а также постмортально выделены из субвентрикулярной зоны и зубчатой извилины гиппокампа мозга взрослого человека [12]. Также эти клетки можно получить из индуцированных плюрипотентных клеток [13]. Существуют протоколы, позволяющие культивировать эти клетки in vitro в виде нейросфер, в состав которых входят собственно НСК, клетки-предшественники и частично дифференцированные клетки [14]. Главным достоинством терапии НСК можно считать тот факт, что независимо от источника получения, эти клетки могут дифференцироваться в олигодендроциты, астроциты и нейроны. НСК продемонстрировали высокую способность мигрировать в ответ на эндогенные хемокины [15] со скоростью 100–125 мкм/день в сторону области повреждения в неонатальном мозге, где они могут выжить как минимум в течение 52 недель после трансплантация [16]. НСК в условиях умеренной гипоксии активно пролиферируют и дифференцируются в нейроны и олигодендроциты, что может обеспечивать положительные эффекты в случае неонатальной ГИ энцефалопатии [17].
Первые эксперименты, проведенные с использованием трансплантатов фетальной коры, были признаны успешными: у животных после ГИ энцефалопатии происходило восстановление сенсомоторных функций [18]. При использовании в этой модели выделенных НСК человека была отмечена активация прорастания аксонов в контралатеральной области, что сопровождалось восстановлением сенсомоторных функций [19]. Подобный механизм, когда восстановление утраченных функций в результате повреждения определенной области мозга может происходить за счет активации аналогичной области в противоположном полушарии, был описан ранее [20]. Выявлено также, что НСК повышали в клетках головного мозга экспрессию генов, отвечающих за нейрогенез, глиогенез и синтез нейротрофинов [19].
Все больше появляется данных о поло-специфической восприимчивости к заболеваниям [21]. Мозг новорожденных особей женского пола менее чувствителен к гипоксическим повреждениям и лучше восстанавливается при терапии таких повреждений [22].
Однако при терапии фетальными НСК пол реципиента не влиял на репарацию мозга после гипоксического повреждения [23]. Таким образом, совпадение пола донора НСК и пола реципиента не является обязательным. Стоит отметить, что трансплантация НСК являлась эффективной для умеренных повреждений, но была неэффективной при тяжелом поражении [23].
Принято считать, что не нейральные СК (например, производные костного мозга или КПК) продуцируют нейротрофические факторы в зоне гипоксического повреждения, но не могут, в отличие от НСК, замещать поврежденные клетки [19]. Необходимо отметить, что время, прошедшее от повреждения до трансплантации НСК, является очень важным параметром. Так, на модели ГИ повреждения мозга мыши было показано, что НСК мыши, полученные из ЭСК, будучи введенными в стриатум через 2 суток после гипоксии, уменьшали повреждение мозга в большей степени, чем при введении через 7 суток после гипоксии [24]. Авторы объясняют данный эффект действием цитокинов, которые вырабатываются в первые несколько дней в ответ на гипоксическое повреждение; введенные НСК продуцируют факторы роста, которые, в свою очередь, ограничивают дальнейшее распространение ядра ишемии или стимулируют усиленный регенеративный ответ.
Мультипотентные мезенхимальные стромальные клетки
ММСК могут дифференцироваться во все виды мезодермальных тканей. Их можно выделить из фетальных тканей (крови плода первого триместра, печени и костного мозга, пуповинной крови и стромы пуповины, вартонового студня и амниотической жидкости), а также из тканей взрослого человека (костный мозг, жир, пульпа молочного зуба и др.), при этом фетальные ММСК обладают большим терапевтическим эффектом [25]. В последнее время все больше внимания уделяется применению ММСК в терапии патологических состояний головного мозга. Подобный интерес обусловлен, в частности тем, что трансплантация ММСК практически не вызывает иммунного ответа, поскольку ММСК не экспрессируют антигены главного комплекса гистосовместимости (ГКГС) 2-го класса или костимулирующие белки (такие как CD40, CD80, CD86) [26, 27]. ММСК могут быть использованы не только для аутологичной трансплантации, но благодаря своим иммуносупрессорным свойствам, и для аллогенной трансплантации, если по каким-либо причинам аутологичная трансплантация невозможна. Так, на сегодняшний день уже имеется целый ряд клинических наблюдений о безопасности терапевтического использования аллогенных ММСК [28–31].
Было показано, что интраназальное введение костномозговых ММСК мышам линии C57BL/6 с экспериментальной гипоксией не приводит к появлению новообразований в мозге в течение 14 месяцев после терапии [32]. При этом, трансплантация ММСК приводила к значительному улучшению сенсомоторных и когнитивных функций и снижению объема повреждения головного мозга, вызванного гипоксией.
Пуповинная кровь и вартонов студень являются одним из самых доступных источников получения аутологичных ММСК для терапии неонатальной ГИ энцефалопатии. При моделировании гипоксии крысят использование подобных ММСК приводило к восстановлению утраченных сенсомоторных функций. При этом внутривенная (в/в) инъекция через 24 ч после гипоксии являлась более эффективной по сравнению с инъекцией через 72 ч, но в обоих случаях существенно уменьшался глиоз в областях гипоксического повреждения [33]. Авторы предполагают, что ранняя трансплантация ММСК более эффективна в связи с уменьшением вероятности контакта введенных клеток с провоспалительными факторами, максимальная генерация которых выявлялась через 72 ч. Кроме того, предполагается, что высокая проницаемость гематоэнцефалического барьера на ранних сроках после повреждения обеспечивает проникновение большего количества клеток в очаг повреждения [33].
Ранее предполагалось, что системное введение ММСК приводит к замещению поврежденных нейронов при ишемии мозга. Однако, это не соответствует данным, демонстрирующим, что в паренхиме мозга обнаруживается лишь небольшое количество введенных клеток [34–36]. Сейчас же парадигма меняется в сторону того, что положительное действие ММСК опосредуется в основном продукцией растворимых факторов, регулирующих нейрогенез [37–39]. Введенные клетки могут достаточно долго существовать в кровотоке и достигать очагов повреждений мозга за счет своих хемокиновых рецепторов. Также ММСК могут секретировать молекулы адгезии [40], которые облегчают им доступ к активированному воспалением эндотелию кровеносных сосудов мозга [41] и соответственно проникновение в паренхиму головного мозга.
СК пуповинной крови
Еще одним источником СК, широко используемых для изучения возможности лечения гипоксии новорожденных, являются стволовые КПК. В состав пуповинной крови входит смесь мононуклеаров и других компонентов крови, в том числе эритроциты и тромбоциты. Фракция мононуклеарных клеток состоит из белых клеток крови, а также различных типов СК в количестве, сравнимом или большем, чем в костном мозге, среди которых выделяют: гематопоэтические СК, которые являются предшественниками клеток крови [42], ММСК [43], эндотелиальные клетки-предшественники [44], а также недавно описанные малые эмбрионально-подобные СК [45]. Последние, как было показано in vitro, дифференцируются практически во все типы зрелых клеток, включая нейроны [46]. Основным преимуществом КПК является доступность пуповинной крови и соответственно возможность проведения трансплантации аутологичных клеток новорожденному. Несмотря на наличие данных о том, что КПК обладают более низкой иммуногенностью по сравнению с фракцией костного мозга [47], в случае аллогенной трансплантации, существует вероятность развития реакции трансплантат против хозяина (РТПХ).
Выше мы уже рассмотрели перспективы использования ММСК, полученных из пуповинной крови, для терапии ишемических повреждений мозга новорожденных. Ввиду того, что пуповинная кровь гетерогенна по составу, здесь мы рассмотрим варианты использования цельной пуповинной крови, а также мононуклеарной фракции, в состав в которой входят все вышеописанные типы СК.
Греггио с коллегами изучали нейропротекторное действие мононуклеарной фракции пуповинной крови человека, вводя клетки в дозе 1*107 новорожденным крысятам через 24 часа после моделирования гипоксии [48]. Через 9 недель после трансплантации КПК у крыс значительно улучшилась обучаемость и долговременная пространственная память, при этом не было изменений объема повреждения мозга и сенсомоторных функций. Анализ содержания человеческой ДНК в головном мозге в качестве маркера присутствия трансплантированных клеток показал наличие клеток в обоих полушариях мозга через 30 суток.
В исследовании влияния количества трансплантируемых КПК на терапевтическую эффективность было показано, что КПК при дозе 1*107 мигрировали в очаг повреждения и уменьшали его размер, но это не приводило к функциональному восстановлению. В случае применения более высоких доз (1*108 клеток) наблюдалось уменьшение объема повреждения и значительное улучшение когнитивных функций. Применение низких дозировок СК (1*106 клеток) не оказывало терапевтического эффекта. Таким образом, только высокие дозы вводимых КПК обеспечивают достоверную нейропротекцию и когнитивные улучшения при однократном введении [49]. Терапевтическая эффективность высоких доз обусловлена тем, что пуповинная кровь содержит относительно небольшой процент СК различного происхождения – так, на долю ГСК приходится лишь 1,5% [42].
Можно утверждать, что каждый тип СК, входящих в состав пуповинной крови, обладает своим собственным механизмом терапевтического действия [50].
Так, например, КПК обеспечивают повышение выживаемости клеток области повреждения [51], активацию эндогенного нейрогенеза [52] и ангиогенеза [53], иммуномодулирующие эффекты посредством выработки нейтротрофических факторов и секреции цитокинов [54].
Иммунологические аспекты клеточной терапии
Трансплантация чужеродных клеток из аллогенных или ксеногенных источников может вызвать два типа негативных иммунных реакций: отторжение трансплантата или РТПХ. Оба происходят из-за наличия на внешней стороне клеточной мембраны белков ГКГС и их несоответствия между донорскими и эндогенными клетками. Отторжение трансплантата вызывается циркулирующими В- и Т-клетками, распознающими чужеродные молекулы ГКГС [55]. Риск иммунологического отторжения может быть снижен либо путем сопоставления типов ГКГС донора и реципиента, что клинически практикуется в аллогенной трансплантации гемопоэтических СК, либо с помощью иммуносупрессивной терапии, либо использованием СК с низкой экспрессией молекул ГКГС-I (то есть с низкой иммуногенностью), как это описано для ММСК или НСК [56, 57].
В отличие от отторжения трансплантата, РТПХ происходит только при пересадке ГКГС-несовпадающих СК, имеющих в своей популяции лейкоциты или клетки с лейкоцитарными функциями, а также гематопоэтических СК, которые могут дать начало лейкоцитам. При трансплантации клеток пуповиной крови возможно развитие иммунного ответа в виде РТПХ [58, 59], однако в случае неонатальной ГИ энцефалопатии преимущественно используют аутологичные клетки, которые исключают РТПХ. В то же время одни из наиболее часто используемых клеток в экспериментальной терапии неонатальной ГИ энцефалопатии и инсульта – ММСК, проявляют сильные иммуномодулирующие свойства, которые даже используются в терапии резистентной к фармакологическим препаратам РТПХ [60, 61]. Механизмы ММСК-индуцированной иммуносупрессии не до конца изучены, но предполагается, что в них вовлечена экспрессия противовоспалительных медиаторов, таких как, интерлейкин-10, трофобластический фактор роста-бета, и простагландин Е2, а также костимуляторных молекул, таких как лиганд программируемой гибели клеток-1 и Fas-лиганд [62]. Считается, что иммуномодуляторные свойства являются одним из важных механизмов терапевтической эффективности ММСК [63].
Способы трансплантации клеток
Анализируя преимущества тех или иных методов трансплантации клеток для трансляционной медицины, нужно, с одной стороны, оценивать их с точки зрения удобства клинического применения, заключающегося в минимизации инвазивного вмешательства, а с другой – с точки зрения эффективности их доставки в целевой орган, в рассматриваемом случае – головной мозг. В первом случае наиболее предпочтительным является в/в введение, которое может выполнить средний медицинский персонал. При этом в ряде работ, исследующих механизмы нейропротекторных свойств СК, несмотря на минимальное присутствие трансплантируемых клеток в головном мозге после в/в введения, наблюдался существенный терапевтический эффект [64]. Тем не менее, при доставке СК непосредственно в нервную ткань, терапевтический эффект был более выраженным [65]. Необходимость доставки в головной мозг особенно выражена для НСК, которые реализуют терапевтический эффект через дифференцировку в нейроны.
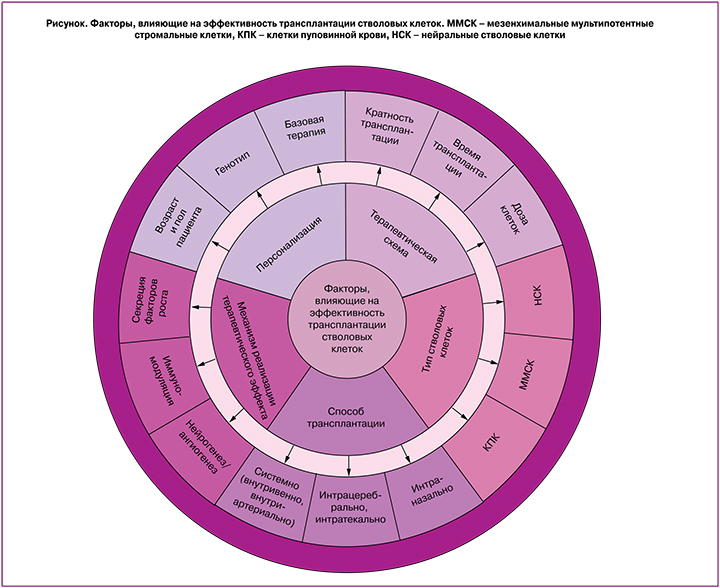
В экспериментальных и доклинических исследованиях используются два основных способа трансплантации СК. Первым является трансплантация клеток с помощью стереотаксической техники непосредственно в головной мозг. Принимая во внимание, что гипоксия-ишемия у новорожденных часто приводит к обширным ишемическим повреждениям, не очевидно, что такой способ доставки сможет обеспечить эффективное приживление трансплантата во всех поврежденных областях. Еще одной очевидной проблемой является высоко инвазивный характер внутримозговой трансплантации. Другим подходом является внутрисосудистая трансплантация клеток (в/в и внутриартериальные (в/а) инъекции). Недавно был предложен третий способ целенаправленной доставки СК в головной мозг – интраназальная (и/н) инстилляция. Можно выделить еще целый ряд факторов (см. рисунок), которые могут влиять на терапевтическую эффективность СК при патологиях мозга: тип СК (например, фетальное или постнатальное происхождение клеток); доза СК; время введения после повреждения (острое, подострое, хроническое введение); а также ряд других факторов (см. рисунок). Ниже мы рассмотрим различные способы трансплантации клеток с точки зрения их хоуминга в головной мозг и удобства клинического применения.
В ряде работ показано, что прямая инъекция СК в структуры головного мозга оказывает положительное терапевтическое действие на модели ГИ энцефалопатии новорожденных мышей и крыс [66–69]. Имеется не так много экспериментальных работ, где проводилось сравнение различных способов трансплантации клеток внутри одного эксперимента. Так, в работе Джин с соавт. были исследованы различные способы введения НСК клеток, такие как инъекция в стриатум или желудочки головного мозга, или в/в введение, и во всех случаях авторы обнаруживали трансплантированные СК в паренхиме мозга в области повреждения, при этом ишемия усиливала миграцию клеток [70]. В аналогичной работе Виллинг и соавт. проводилось сравнение терапевтической эффективности КПК человека на модели инсульта при инъекции клеток в стриатум или в/в введение. Результаты этого исследования показывают, что в/в введение клеток является не менее эффективным, поэтому авторами делается вывод о целесообразности его использования в клинических целях в качестве менее инвазивной и безопасной замены интракраниальному способу введения [71].
К недостаткам процедуры интрапаренхимальной трансплантации СК можно отнести то, что она вызывает повреждение ткани и, соответственно, может привести к задержке миграции клеток к основному месту повреждения из-за паразитной сигнализации из раневого канала. Кроме того, прямые инъекции в мозг требуют специализированного оборудования, наличия специалистов нейрохирургического профиля и сопровождаются увеличением сопутствующих хирургических рисков.
Малоинвазивное в/в введение имеет, пожалуй, наибольший потенциал для клинического внедрения и наиболее часто используется в экспериментальных исследованиях, хотя результаты этого способа трансплантации СК не всегда положительны [72]. Наибольшие вопросы вызывает оценка пропорций распределения вводимых в/в клеток в различных органах организма. Чен с соавт. подсчитали, что после в/в трансплантации КПК у крысы с ишемией мозга только 1% введенных клеток обнаруживается в головном мозге [72]. Изучение распределения радиоактивно меченных ММСК, веденных в/в крысам, показало, что клетки были локализованы преимущественно в легких и печени [73], аналогичные результаты были получены и в клинических исследованиях [74].
Несмотря на все преимущества по сравнению с интракраниальным введением, в/в способ трансплантации клеток также не лишен недостатков, основным из которых является низкая биодоступность клеток для головного мозга из-за захвата их паренхиматозными органами. Решением данной проблемы представляется использование в/а инъекции СК.
В/а доставка СК для лечения ишемического инсульта по мнению многих исследователей имеет достаточно высокий потенциал для клинического использования. Основным преимуществом в/а трансплантации является возможность направить большее количество клеток к травмированной области мозга с помощью менее инвазивной процедуры, чем интракраниальная инъекция. Этот подход в отличие от в/в введения позволяет избегать захвата трансплантированных клеток внутренними органами и, в отличие от внутримозгового введения не исключает многократные повторные трансплантации [75]. В ряде исследований на моделях ишемического инсульта [76–78] или травмы головного мозга [65, 79] было показано, что инъекция клеток в сонную артерию обеспечивает более широкую инвазию СК в головной мозг и большее число прижившихся клеток в поврежденной области по сравнению с в/в инъекцией. Предполагается, что при в/а введении клетки задерживаются в мелких капиллярах и артериолах и далее мигрируют трансэндотелиальным диапедезом в паренхиму мозга за счет хемотаксиса по градиенту хемоаттрактантов, в частности, стромального клеточного фактора-1 (SDF-1), образующегося в области повреждения [79–81].
Впервые этот метод введения СК на модели неонатальной ГИ энцефалопатии был описан в работе Греггио и коллег [48], где было показано, что в/а трансплантация 1×107 мононуклеаров КПК человека обеспечивала статистически значимое долговременное улучшение когнитивных функций у крыс. Кроме того, при в/а инъекции было необходимо ввести на порядок меньше клеток для достижения аналогичных терапевтических эффектов по сравнению с в/в способом введения: 1×107 клеток вместо 1×108, соответственно.
Однако в ряде работ было показано, что в/а введение может оказывать серьезное побочное действие в виде микроэмболии сосудов головного мозга, приводящих к локальным ишемическим повреждениям [82, 83].
В связи с этим был предложен ряд протоколов и методов подготовки клеток для трансплантации с целью предотвращения микроэмболизации сосудов [84, 85]. Таким образом, с точки зрения эффективности доставки клеток в головной мозг в/а способ трансплантации является многообещающим, но, к сожалению, его клиническое использование ограничено сложной хирургической техникой введения и отсутствием разработанных безопасных протоколов трансплантации.
В случае терапии патологий головного мозга альтернативой в/а и в/в введению и эффективным способом доставки лекарств напрямую в головной мозг может служить и/н инстилляция, благодаря существованию особой анатомической связи носовой полости с головным мозгом [86, 87]. Донеги с соавт. показали, что и/н введение ММСК мыши значительно улучшает когнитивные и сенсомоторные функции, а также уменьшает размеры области ишемического повреждения головного мозга у новорожденных мышей после ГИ. Введенные клетки достигали очага поражения уже через 2 ч после введения в обе ноздри [88]. Была также исследована безопасность данного метода трансплантации, и показано, что инстилляция ММСК не вызывает образование неоплазий в мозге и носовых раковинах, а также в других периферических органах в течение 14 месяцев [89].
Поскольку СК достигают области поражения всего через 2 часа после и/н введения, маловероятно, что клетки мигрируют к очагу через паренхиму мозга. Предшественники нейральных клеток, как было показано, мигрируют со скоростью 94±20 мкм в час по ростральному миграционному тракту [90]. Если считать, что донорские СК, введенные и/н, мигрируют с такой же скоростью, то они достигнут очага поражения лишь через несколько дней, а не через 2 ч, как показано [88]. Исходя из этого, предполагается, что СК мигрируют из носовых проходов к зоне поражения посредством менингеальной циркуляции или через цереброспинальную жидкость [88].
Стоит отметить, что введенные в обе ноздри ММСК мыши мигрируют специфично к поврежденному полушарию после неонатальной гипоксии, но не к контралатеральному. При этом меченые введенные клетки формируют кластеры вокруг сайта повреждения, группируясь исключительно на стороне, ипсилатеральной к повреждению. Кроме того, трансплантированные ММСК увеличивали нейрогенез в субвентрикулярной зоне, а также существенно снижали экспрессию провоспалительных цитокинов астроцитами и микроглией, причем последняя также изменяла свой фенотип на иммуномодулирующий (М2) [88].
Таким образом, и/н введение СК обладает большим терапевтическим потенциалом для восстановления неврологических функций после гипоксических повреждений мозга новорожденных за счет ряда преимуществ. Оно обеспечивает быструю миграцию СК в течение 1–2 ч в поврежденные области головного мозга, тем самым обеспечивая раннюю терапию патологии; клетки доставляются исключительно в головной мозг при минимальном системном эффекте; способ доставки является клинически простым и неинвазивным, делая возможным курсовое введение СК. Необходимо отметить одно осложнение, проявившееся при использовании для более эффективной доставки клеток в головной мозг предварительной обработки носовой полости гиалуронидазой [91], что вызывало пневмококковый менингит, предположительно за счет облегчения прохождения пневмококков из носовой полости в кровоток [92].
Резюмируя, можно выделить два клинически целесообразных способа трансплантации клеток – в/в и и/н. Для достижения терапевтического эффекта необходимо присутствие СК как в экстракраниальных органах, так и в самом головном мозге, поэтому целесообразно комбинировать оба способа трансплантации.
Клинические испытания
В настоящее время работ, посвященных описанию клинических исследований применения клеточных технологий для лечения неврологических последствий неонатальной ГИ энцефалопатии, не так уж много. Необходимо отметить, что на данный момент все исследования направлены в первую очередь на доказательство безопасности проведения клеточной терапии, то есть отсутствия негативных побочных эффектов, а для изучения эффективности данного метода требуются отдельные исследования в будущем.
Основная масса проводимых клинических исследований начата относительно недавно и пока отсутствуют сообщения об их результатах. Преимущественно исследования сосредоточены на безопасности и эффективности трансплантации собственных клеток костного мозга или пуповинной крови, используемых в виде ядросодержащей или мононуклеарной фракции, или выделенных и культивированных in vitro ММСК. В базе ClinicalTrials.gov зарегистрированы клинические исследования, и идет набор пациентов для лечения следующих патологий у детей: неонатальная гипоксическая энцефалопатия (NCT00593242; NCT02434965; NCT02612155; NCT01649648; NCT02551003; NCT02256618; NCT02455830); нейросенсорная тугоухость (NCT02616172); цирроз печени (NCT02327832)
Также имеется несколько уже опубликованных завершенных клинических испытаний на небольших группах пациентов. В работе Коттон и коллег изучалась целесообразность и безопасность в/в трансплантации аутологичных КПК новорожденным с ГИ энцефалопатией [93]. Трансплантацию клеток проводили на фоне терапевтической гипотермии при 33,5оС в течение 72 ч. Новорожденным предварительно была проведена премедикация гидрокортизоном в/в дозой 1 мг/кг за 30–60 мин до трансплантации. Пациенты получали до 4 трансплантаций клеток в дозе от 1*107 до 5*107 клеток/кг, при этом первую инъекцию проводили в максимально короткие сроки после рождения, а последующие через 24, 48 и 72 ч.
Однако впоследствии протокол терапии был усовершенствован, и в нем было оставлено двукратное введение клеток в первые 48 часов после рождения. Всего в группу получивших клеточный трансплантат было набрано 23 пациента. Контрольная группа, где была использована только гипотермия, состояла из 82 новорожденных. У новорожденных не было отмечено негативных реакций на инфузию клеток. В группе пациентов с проведенной клеточной терапией не было зарегистрировано случаев гибели во время пребывания в стационаре, тогда как в группе только с гипотермией смертность составила 13%, хотя данные статистически не значимы. Авторы приходят к выводу, что трансплантация клеток пуповинной крови не вызывает клинически значимых осложнений, и рекомендуют продолжить клинические исследования в рамках II фазы с увеличением объема выборки пациентов [93].
С аналогичными целями было проведено пилотное исследование по изучению в/в введения аутологичных КПК детям раннего возраста с приобретенными неврологическими расстройствами [94]. КПК хранили в закрытом частном банке с момента рождения ребенка. Исследование проводили с марта 2004 года по декабрь 2009 года. В работе подробно описан протокол приготовления клеток, процедуры их введения и мониторинга. Всего в данном исследовании приняло участие 30 детей возрастом до 6 месяцев (15%), 120 детей в возрасте от 7 месяцев до 3 лет (61%), 48 детей старше 4 лет (24%); из них 54% мальчиков и 46% девочек. В этой работе также показали целесообразность и безопасность введения клеток пуповинной крови детям [94].
В 2014 году были опубликованы результаты завершенной I фазы клинических исследований по изучению безопасности и переносимости детьми с церебральным параличом интратекального способа введения аутологичной фракции ядросодержащих клеток костного мозга (костный мозг, очищенный от эритроцитов) [95], данное исследование было зарегистрировано в базе клинических испытаний ClinicalTrials.gov под №NCT01019733. Исследование проводили с июля 2009 года по декабрь 2011 года. Всего в исследовании приняли участие 18 пациентов в возрасте от 1 месяца до 8 лет. Для увеличения выхода СК костный мозг стимулировали посредством подкожного введения гранулоцитарного колониестимулирующего фактора в дозе 10 мкг/кг/сутки в течение 4 дней, затем у пациента отбирали костный мозг в количестве 8 мл на килограмм веса, суммарно отбирая при этом до 150 мл вещества. Далее из этого объема выделяли фракцию ядросодержащих клеток (ее составляла гетерогенная популяция клеток, среди которых были нейтрофилы, моноциты, лимфоциты, минимальное количество эритроцитов, гематопоэтические СК и популяция неидентифицированных клеток CD34-/CD45-) и вводили ее интратекально, а фракцию, обогащенную эритроцитами, вводили в/в параллельно с введением ядерных клеток.
Побочные эффекты наблюдались у 5 пациентов (27,8%). Однако у 2 пациентов из 5 побочные эффекты были связаны с анестезией, общей процедурой, применяющейся и при других, альтернативных видах терапии при корковом параличе. У оставшихся 3 пациентов (16,7%) побочные эффекты были незначительны и лишь частично связаны с трансплантацией клеток костного мозга. Основными осложнениями были головная боль и рвота, после них по частоте встречаемости следовали ригидность затылочных мышц и повышение температуры. Подобные эффекты, в частности, повышение температуры тела, могут быть объяснены эндогенными пирогенными цитокинами, секретируемыми лейкоцитами, и последующей индукцией и транспортировкой циклооксигеназо-2-зависимого простагландина Е2 в преоптическую область гипоталамуса, являющуюся центром температурной регуляции. При этом не было выявлено корреляции между возникновением побочных эффектов и дозой вводимых клеток. К сожалению, небольшая выборка не позволяет более детально изучить процесс возникновения побочных эффектов и их связь с проводимой терапией, поэтому требуются дальнейшие исследования безопасности. Убедительных данных, подтверждающих инфекционную природу осложнений, было недостаточно, поскольку уже через несколько часов больным становилось лучше без применения антибиотиков, а все микробиологические посевы из стерильных локусов были отрицательны.
В вышеописанном исследовании также была проведена оценка терапевтической эффективности клеточной трансплантации. Были выявлены статистически значимые улучшения неврологических характеристик пациентов, несмотря на то, что на МРТ никаких видимых изменений не обнаруживалось. Авторы приходят к выводу, что поскольку не было выявлено значительного побочного действия, интратекальное введение ядросодержащей фракции костного мозга является безопасным и улучшает неврологические функции [95]. На данный момент данное клиническое исследование продолжено и зарегистрирована II фаза под № NCT02231242.
Чен с соавт. опубликовали результаты клинического исследования применения фетальных обкладочных нейроэпителиальных клеток для лечения ишемии головного мозга у детей и подростков [96]. Обкладочные нейроэпителиальные клетки являются уникальной частью обонятельной системы, которая обеспечивает нейрогенез. Было показано, что эти клетки могут быть вовлечены в нейропротекцию за счет усиления прорастания и ремиелинизации аксонов, активации ангиогенеза и высвобождения нейротрофических факторов [97]. Исследование проводили с октября 2006 года по май 2008 года, в него вошло 33 пациента в возрасте от 1 года до 12 лет. Пациенты были разделены на 2 группы: экспериментальную группу составили 18 человек, в контрольную группу вошло 15 человек. Обкладочные нейроэпителиальные клетки в дозе 2×106 на пациента трансплантировали интрацеребрально в лучистый венец лобных долей симметрично с помощью стереотаксического метода. По разным причинам не все пациенты могли наблюдаться в течение 6 месяцев и проходить необходимые тесты, поэтому из 33 пациентов только 14 полностью завершили 6-месячный курс исследований. Из этих 14 человек 6 пациентов составили экспериментальную группу, 8 – контрольную. Было показано, что клеточная терапия способствует появлению положительной динамики у детей и подростков с церебральным параличом. Явных побочных эффектов или каких-либо осложнений зарегистрировано не было. Стоит отметить, что ни до, ни после хирургической процедуры иммуносупрессивную терапию не проводили. При этом через 6 месяцев после проведенной терапии наблюдали улучшение неврологических характеристик экспериментальной группы по сравнению с контрольной [96].
Заключение
В данном обзоре мы рассмотрели только узкую часть возможного терапевтического использования клеточных технологий применительно к патологиям центральной нервной системы у детей различного возраста. Однако, как правило, патологии новорожденных имеют сочетанный характер и достаточно часто сопровождаются сепсисом, патологиями легких и почек, некротизирующим энтероколитом и др., особенно на фоне недоношенности. Высокая эффективность проведения терапии СК при различных сочетанных патологиях у новорожденных является доказанной [98–101]. Системная трансплантация СК может оказывать терапевтическое действие на ряд патологий одновременно, так как в их основе лежат сходные молекулярные механизмы повреждения и репарации.
Доклинические исследования показали, что клеточная терапия приводит к защите и/или репарации ткани головного мозга у новорожденных после гипоксии-ишемии головного мозга. Поскольку показана эффективность СК в предклинических испытаниях, мы можем ожидать инициации большего количества клинических испытаний с их использованием для лечения неонатальных патологий головного мозга, вызванных ишемией/гипоксией. Безопасность и эффективность клинического применения клеточных технологий еще должны быть подтверждены в хорошо спланированных контролируемых клинических испытаниях, прежде чем они будут распространены в качестве рутинной терапии в клинической практике. Тем не менее, данная область является перспективной и может обеспечить решение сложных клинических проблем.



