Проблема менопаузального периода состоит не только в его природе [1], противоречивыми до настоящего времени являются взгляды на терапию климактерических расстройств, что связано с неоднозначностью полученных данных. До 1996 г. существовала позиция о кардиопротективном эффекте ЗГТ [2–4], однако дальнейшие крупные многоцентровые исследования такие как Heart and Estrogen/Progestin replacement Study (HERS) и Women’s Health Initiative (WHI) выявили увеличение относительного риска венозных тромбозов и сердечно-сосудистых осложнений [5, 6]. В настоящее время Американская кардиологическая ассоциация не рекомендует ЗГТ женщинам в постменопаузе в качестве профилактики сердечно-сосудистых заболеваний. В условиях отсутствия консенсуса в отношении заместительной гормонотерапии практикующим врачам необходимо понимание механизмов развития возможных ее осложнений, условий для назначения менопаузальной гормональной терапии (МГТ), а также альтернативных вариантов лечения климактерических расстройств при наличии противопоказаний.
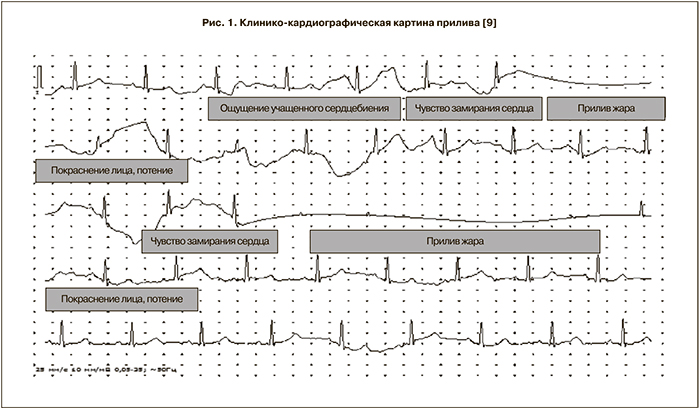
Наиболее ранним и частым проявлением снижения уровня эстрогенов являются вазомоторные симптомы в виде приливов, до 70% женщин в перименопаузе предъявляют такие жалобы [7]. До конца природа приливов не изучена, большое внимание уделяется дизрегуляции вегетативной нервной системы, когда повышение симпатической холинэргической активности вызывает расширение сосудов, учащение сердцебиения, усиления кровотока, что приводит к повышенному потоотделению [8]. Природа данных нарушений может быть намного сложнее, а последствия заключаться не только в снижении качества жизни женщины. Во время записи ЭКГ для оценки вариабельности сердечного ритма удалось зафиксировать эпизоды приливов (рис. 1). Клинико-кардиографическая картина прилива имеет определенные фазы – начинается данное явление с ощущение учащенного сердцебиения, которое больная ощущает физически, затем появляется чувство замирания сердца, переходящее в сам эпизод прилива жара, на ЭКГ этому достаточно продолжительному периоду (3-7 кардиоциклов) соответствует отсутствие регистрации сердечных комплексов, возможно, связанного с полной блокадой сердечной деятельности.
Не исключено, что удалось зафиксировать один из возможных вариантов приливов, однако, существование такого варианта настораживает, так как является опасным явлением как в качестве потенциального неотложного состояния сердечно-сосудистой системы, так и актуального фактора нагрузки на регуляторные системы организма [9]. Естественные эстрогены регулируют процессы вазодилатации, пролиферации и миграции гладкомышечных клеток и фибробластов, ангиогенеза, препятствуя развитию эндотелиальной дисфункции и ремоделированию сосудов, то есть процессы, лежащие в основе патогенеза атеросклероза и тромботических осложнений. Влияние эстрогенов на тонус сосудов может быть негеномным или реализовываться за счет изменения транскрипции генов, и это связано с активацией синтеза NO, простациклина, цГМФ, цАМФ, EDHF (эндотелиального гиперполяризующего фактора) и со снижением уровня вазоконстрикторных агентов (ангиотензин II, эндотелин-1). Эстрогены, взаимодействуя со специфическими эстрогеновыми рецепторами a (ЭРa), обеспечивают негеномную активацию эндотелиальной NO-синтазы (eNOS), что обусловливает практически моментальную вазодилатацию. Кроме того, NO может оказывать противовоспалительное и противотромботическое действие за счет ингибирования агрегации тромбоцитов, процессов пролиферации и миграции гладких миоцитов, связывания свободных радикалов кислорода. Эстрогены и их основные метаболиты тормозят окисление высокоатерогенных липопротеинов низкой плотности (ЛПНП), ингибируют пролиферацию гладкомышечных клеток и апоптоз эндотелиоцитов, индуцированный под действие холестерина и свободных радикалов [10, 11]. Антитромботическая активность эстрогенов заключаться в снижении повышенного уровня фибриногена, активации фибринолиза: снижении PAI-1, повышении уровня тканевого активатора плазминогена [12, 13].
Состав, дозировка и путь введения препаратов МГТ могут влиять не только на эффективность, но и на безопасность гормональной терапии, особенно это актуально в отношении тромботических осложнений. Применения пероральных форм МГТ, также как и оральных контрацептивов является своего рода нагрузкой для желудочно-кишечного тракта и печени. Поскольку эстрогены не поступают с пищей, а синтезируются в организме, транспортные системы для их всасывания отсутствуют, а для обеспечения терапевтической концентрации в крови необходимы большие дозы эстрогенов. Высокие дозы пероральных эстрогенов, метаболизирующихся в печени, могут не только быть токсичными для печени, но и стимулировать синтез факторов свертывания крови и снижать активность естественных антикоагулянтов (табл. 1) [12–15].
На фоне приема МГТ происходит повышение активности FV, FXII, фактора фон Виллебранта (VWF), снижение содержания антитромбина III, протеинов С и S. Наиболее значимым влиянием МГТ на систему гемостаза является развитие резистентности к активированному протеину С (АРС). Показано, что повышенный уровень резистентности к АРС коррелирует с риском венозных тромбозов при МГТ [12]. Следует учесть также, что с возрастом резистентность к АРС возрастает, что усиливает риск развития тромбозов. И, конечно, вероятность тромбоза значительно увеличивается, если в дополнение к указанным выше причинам добавляется еще и скрытая форма тромбофилии.
Трансдермальные препараты в меньшей степени влияют как на прокоагулянтное, так и профибринолитическое звено гемостаза по сравнению с пероральными формами. Это объясняется отсутствием первичного прохождения трансдермальных препаратов через печень и, следовательно, меньшим влиянием на синтез компонентов системы гемостаза. По данным рандомизированных плацебо-контролируемых исследований при применении трансдермальных препаратов МГТ не наблюдается увеличения резистентности к АРС, повышения уровня прокоагулянтных факторов (VII и XI) и выявляется меньший риск венозных тромбозов, чем при применении пероральных форм.
Крупное проспективное исследование с включением более 1 миллиона женщин показало, что помимо формы приема препарата МГТ на тромботический риск также влияют тип и состав гормональной терапии: он больше у пациенток, принимающих пероральные комбинированные эстроген-прогестиновые препараты, чем пероральные препараты чистых эстрогенов. Риск венозной тромбоэмболии возрастает еще больше, если комбинированный препарат содержит медроксипрогестерона ацетат [16].
Для снижения тромботических осложнений прежде всего, должны быть четко обозначены показания к назначению МГТ: умеренно выраженный и тяжелый климактерический синдром (КС), лечение постменопаузального остеопороза и тяжелые формы вульвовагинальной атрофии. В последнем случае местные формы применения предпочтительнее. Трансдермальные препараты также являются предпочтительными.
При наличии генетических форм тромбофилии и/или антифосфолипидного синдромаАФС МГТ противопоказана. Применять МГТ необходимо в минимально эффективных дозах в течение как можно более короткого времени. Целесообразно рекомендовать методы неспецифической профилактики осложнений МГТ, связанные с образом жизни, питанием, нутритивной поддержкой. Пациентка перед решением начать МГТ должны быть проинформирована как о преимуществах, так и об известных рисках гормональной терапии.
При соблюдении данных условий представляется возможным минимизировать риски тромботических осложнений МГТ. По возможности, необходимо использовать альтернативные способы лечения.
В последнее время особое внимание уделяется роли дефицит магния в поддержании женского здоровья [17–19]. Распространенность дефицита магния значительна как у нас в стране, так и в мире. Популяционное исследование в Германии с участием ~16000 человек указало на субоптимальный уровень потребления магния у 33,7% населения, соответствующие цифры для K и Ca составили 29 и 23% [20]. В нашей стране 30% россиян получают в день менее 70% от суточной потребности железа и магния, при этом дефицит магния у женщин встречается значительно чаще (особенно при беременности, приеме КОК, ЗГТ), чем у мужчин [18, 19, 21, 22]. Представляет интерес изучение распространенности дефицита магния у пациенток с гормонально-зависимыми заболеваниями, в том числе при менопаузальных расстройствах и приеме МГТ. В 2013 году начато такое крупномасштабное наблюдательное исследование по всей России (MAGYN), публикация результатов ожидается в 2015 году.
Действительно, эстрогены участвуют в поддержании физиологического гомеостаза магния за счет увеличения уровни экспрессии гена TRPM6 и его реабсорбции в почках, а хирургическое удаление яичников вызывает значительное сокращение экспрессии TRPM6 в почках, в результате чего может снижаться реабсорбции магния, повышаться его выведение, и, в конечном итоге, приводить к дефициту магния [22, 23].
С другой стороны, прием гормональных эстрогенсодержащих препаратов также способствует развитию магнийдефицитного состояния [24, 25] за счет нежелательного воздействия эстрогенов (при приеме внутрь) на печеночный метаболизм, нарушения абсорбции магния в кишечнике, повышения активности паращитовидной железы, развития дефицита в организме важного синергиста магния – витамина В6, напряжения системы адаптации [22, 26]. Таким образом, создаются условия для развития дефицита магния в менопаузальный период, а прием МГТ может усугублять его.
 Дефицит магния способствует развитию эндотелиальной дисфункции, создавая провоспалительные, протромботические и проатерогенные условия [27]. Концентрация внеклеточного магния играет важнейшую роль в регуляции активности эндотелиальных клеток [28], а нехватка магния усиливает цитотоксическое действие свободных радикалов в эндотелиальных клетках [29]. В культивируемых эндотелиальных клетках низкая концентрация магния способствует увеличению адгезии к ним моноцитов, так как активируется адгезивная молекула сосудистых клеток. Также в этих условиях индуцируется ингибитор активатор плазминогена-1 (PAI-1), повышается уровень провоспалительных цитокинов ((ИЛ)-1 альфа), ухудшается пролиферация эндотелия и происходит старение клеток [27, 30]. В рандомизированном проспективном двойном слепом плацебоконтролируемом исследовании на примере больных с ишемической болезнью сердца показано, что применение пероральных препаратов магния ингибирует тромбоцитозависимый тромбоз [31].
Дефицит магния способствует развитию эндотелиальной дисфункции, создавая провоспалительные, протромботические и проатерогенные условия [27]. Концентрация внеклеточного магния играет важнейшую роль в регуляции активности эндотелиальных клеток [28], а нехватка магния усиливает цитотоксическое действие свободных радикалов в эндотелиальных клетках [29]. В культивируемых эндотелиальных клетках низкая концентрация магния способствует увеличению адгезии к ним моноцитов, так как активируется адгезивная молекула сосудистых клеток. Также в этих условиях индуцируется ингибитор активатор плазминогена-1 (PAI-1), повышается уровень провоспалительных цитокинов ((ИЛ)-1 альфа), ухудшается пролиферация эндотелия и происходит старение клеток [27, 30]. В рандомизированном проспективном двойном слепом плацебоконтролируемом исследовании на примере больных с ишемической болезнью сердца показано, что применение пероральных препаратов магния ингибирует тромбоцитозависимый тромбоз [31].
Ранее в некоторых экспериментальных исследованиях продемонстрирована гиперкоагуляция и повышенная агрегация тромбоцитов в условиях гипомагниемии [32, 33]. Магний ингибирует ряд агонистов агрегации тромбоцитов, таких как тромбоксан А2, а также фибриногенопосредованную агрегацию тромбоцитов, играющую ключевую роль в развитии острых тромботических состояний [31]. В последнее время активно обсуждается влияние магния на развитие тромботической микроагиопатии. In vitro магний увеличивает расщепление мультимеров фактора фон Виллебранда (vWF) металлопротеиназой ADAMTS-13, уменьшает эндотелиальную секрецию ультракрупных мультимеров vWF, а также ингибирует взаимодействие vWF с тромбоцитами [34].
Таким образом, восполнение дефицита магния, развивающегося в менопаузальный период и усугубляющегося приемом МГТ необходимо не только для нормализации уровня магния в организме, но с целью предотвращения возможных осложнений МГТ у здоровых женщин. Разработка альтернативных методов негормональной терапии имеет большой практический интерес.
Широкий спектр негормональных средств лечения менопаузальных симптомов, включающий фитэстрогены, нейротропные препараты, адаптогены, витаминно-минеральные комплексы, гомеопатию и физиотерапию при правильном подборе могут давать значительные положительные результаты [7, 9, 17, 35].
Препараты магния в виде органических солей (цитрата, лактата, пидолата) в сочетании с пиридоксином занимают достойное место в комплексном подходе негормональной коррекции менопаузальных расстройств.
Обследовано 71 женщина в периоде ранней постменопаузы, из них 50 больных с синдромом патологического климакса (основная группа), и 21 пациентка – с физиологическим течением постменопаузы (группа контроля). Женщины с патологическим климаксом были поделены на 2 подгруппы: 1-я – принимающие только фитоэстрогены (n=25) и 2-я – получающие комплекс негормональной терапии (n=25), заключающийся в следующем: в течение месяца назначался магне В6 по 2 таблетке 3 раза в день (возможна замена на магне В6 форте по 1 таблетки 3 раза в день) (с целью коррекции дефицита магния), климадинон по 30 капель 2 раза в день, одновременно осуществляли воздействие импульсным низкочастотным электромагнитным полем нетепловой интенсивности и светотерапии с помощью аппарата «Инфита-С» в количестве 10 процедур [35]. Всем пациентам помимо стандартных методов исследования, принятых у женщин в климактерическом периоде, проводилось углубленное изучение психовегетативного статуса объективными методами исследования. Изучение вегетативных тонуса, реактивности и обеспечения физической деятельности проводили в состоянии покоя и при выполнении экспериментально-клинических проб на основании спектрального и временного анализа вариабельности сердечного ритма методом кардиоинтервалографии (КИГ) с помощью компьютерной программы «Поли-Спектр-Ритм», соответствующей «Международным стандартам», на аппарате «ВНС-Микро».
Были получены положительные эффекты в обеих подгруппах, однако более значимый достоверный результат продемонстрирован в подгруппе женщин, получавших разработанный негормональный комплекс лечения. Положительное действие предложенного комплекса с включением магнийсодержащих препаратов магне В6 заключается в нормализации деятельности регуляторных систем, оптимизация функционального состояния вегетативной нервной системы у женщин с начальными признаками психовегетативной дезадаптации. В результате лечения улучшается самочувствие больных, уменьшаются психоэмоциональные и нейровегетативные проявления климактерического синдрома. У женщин на фоне проводимого лечения достоверно улучшаются показатели всех трех составляющих деятельности ВНС (рис. 2). В первую очередь оптимизируется вегетативный тонус (повышается общая мощность спектра ВРС, уменьшается относительная гиперсимпатикотония, характерная для КС, увеличивается влияние парасимпатического звена вегетативной нервной системы в покое), улучшается вегетативная реактивность (показатель К30:15 по результату ортостатической пробы увеличивается), а также вегетативное обеспечение деятельности (увеличивается общая мощность спектра ВРС и абсолютные значения вклада симпатических волн в регуляцию сердечного ритма при нагрузке). Нормализация объективных показателей состояния вегетативной нервной системы и психоэмоционального статуса позволяет после лечения приблизить психовегетативный профиль больных к таковому у женщин с физиологическим течением климактерия.
Заключение
Менопаузальная гормональная терапия, являясь эффективным методом коррекции менопаузальных расстройств, имеет ряд побочных эффектов и противопоказаний, осложняющих ее применение. Игнорирование факторов риска и бесконтрольное назначение гормональных препаратов приводит к возникновению осложнений, в том числе тромботических и, в конечном счете, дискредитации метода и усугублению гормонофобии. На этапе принятия решения о назначении МГТ необходимо проводить тщательный скрининг и, по возможности, расширенный скрининг. Многие современные лаборатории предлагают доступное комплексное обследование для определения риска тромбозов при применении МГТ и КОК. Во время приема гормональных препаратов также важен контроль за показателями гемостаза, особенно в первые полгода. Целесообразно включать оценку магниевого статуса и выявлять пациенток с дефицитом магния, а также восполнять его до и во время проведения МГТ.
Рекомендуется проводить неспецифическую профилактику осложнений МГТ, связанную с образом жизни, питанием, нутритивной поддержкой. Учитывая антиагрегантные, антикоагулянтные, антиоксидантные, противовоспалительные и эндотелиопротективные свойства магния и необходимость восполнения дефицита магния особенно в менопаузальный период, пероральные магнийсодержащие препараты, особенно органические соли магния (цитрат, пидолат, лактат) в комбинации с пиридоксином могут быть рекомендованы к совместному применению с МГТ.
Женщинам с признаками тромбофилии МГТ противопоказана, необходим поиск альтернативных методов лечения. Магнийсодержащие препараты могут быть включены в комплекс негормональной коррекции менопаузальных расстройств, учитывая их положительное влияние на психо-вегетативный статус.
Важнейшей задачей будущих клинических испытаний является изучение влияния натуральных эстрогенов, различных форм препаратов (трансдермальных, интраназальных, внутриматочных, вагинальных) на риск осложнений при ЗГТ, а также определение механизмов взаимосвязи магния и МГТ.



