Одним из актуальных вопросов акушерства в течение многих лет остается проблема преждевременных родов (ПР), которые встречаются у 5–17% беременных [1, 2]. В структуре невынашивания беременности ПР занимают особое место, так как обусловливают высокую частоту перинатальной и младенческой заболеваемости и смертности, около 75% случаев которой приходится на долю недоношенных новорожденных, в том числе – на долю родившихся до 32 недель беременности [3, 4]. Несмотря на усовершенствования, затрагивающие методы диагностики, профилактики и лечения, частота ПР остается неизменной и составляет в развитых странах 5–7%. Количество ПР, инициированных преждевременным излитием околоплодных вод, варьирует от 31 до 43,6% [1, 5, 6]. Отхождение околоплодных вод при ПР до настоящего времени представляет собой неразрешенную акушерскую проблему, являясь одновременно фактором ПР. В литературе отсутствует единое мнение по этому поводу [7, 8].
Цель исследования – изучение в сыворотке крови беременной роли нарушенной продукции предикторов сократительной деятельности матки в патогенезе преждевременных родов.
Материалы и методы
ФГБОУ ВО РостГМУ Минздрава России (НИИАП) является участником научно-образовательного медицинского кластера Южного федерального округа «Южный» совместно с Федеральным исследовательским центром «Южный научный центр» РАН. Работу осуществляли с февраля 2018 по апрель 2019 г. в соответствии с этическими нормами Хельсинской декларации и Директивами Европейского сообщества (8/609EC).
В проспективное исследование включены 134 соматически здоровые беременные женщины, поступившие в родильное отделение с преждевременными и своевременными родами. Всем пациенткам проводили полный анализ анамнестических данных и клинико-лабораторное обследование. Критериями включения явился характер родов (табл. 1), что позволило стратифицировать пациенток на 3 группы: с ранними преждевременными родами (РПР), ПР и вступившие в своевременные роды (СР) – контрольная группа. Критериями исключения были: многоплодная беременность, возраст старше 40 лет, острая фаза и обострение хронических инфекционных заболеваний.
Изучение особенностей продукции оксида азота и кахектина осуществляли для выявления возможности прогноза рассматриваемых патологий беременности и осуществления их профилактики с учетом патогенеза.
Всем женщинам выполняли стандарт обследования в течение беременности, предусмотренный приказом Минздрава России от 12.11.2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «Акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)». Перед началом эксперимента было получено информированное согласие пациенток о включении в исследование с использованием их биопроб.
Возраст 47 пациенток контрольной группы варьировал от 24 до 28 лет. В группе все дети родились с оценкой по шкале Апгар 8–9 баллов и нормальными массо-ростовыми показателями. Послеродовый период протекал без осложнений.
В 1-ю группу вошли 17 (37,8%) первобеременных и 28 (62,2%) повторнобеременных; 27 (60%) всех пациенток были старше 30 лет (30–39 лет). Во 2-й группе первобеременных оказалось 20 (48,0%) и 22 (52,3%) повторнобеременных. В контрольной группе таких женщин было 29 (61,70%) и 18 (38,3%) соответственно. Первородящие женщины составили основную часть обследованных, кроме пациенток 2-й группы, в которой больше всего выявлено повторнородящих 24 (57,1%). Возраст наступления менархе и продолжительность менструаций оказались аналогичными как при сопоставлении с женщинами контрольной группы, так и между группами.
В процессе родов в 1-й и 2-й группах пациенток оперативное родоразрешение проведено чаще по сравнению с контролем, но результаты между группами не различались. В 1-й группе очень низкую массу тела имели 17 (37,8%) новорожденных, низкую массу тела – 14 (31,1%), экстремально низкую – 4 (8,9%) с оценкой по шкале Апгар <5 баллов – 12 (27,6%). У новорожденных 2-й группы у 38 (90,1%) масса тела была в пределах от 2000 до 2500 г и оценка по шкале Апгар – 9 (21,5%).
При анализе анамнестических данных выявлено, что у пациенток 1-й и 2-й групп неразвивающиеся беременности, самопроизвольные аборты,
ПР встречались чаще, чем в контрольной группе. ПР в анамнезе имели место как у женщин 1-й группы – 5 (11,11%), так и во 2-й клинической группе – 7 (16,6%). Данный анамнестический факт повышал риск развития ранних преждевременных родов (РПР) в 1,74 (95%) раза, а ПР – в 2 (95%) раза.
Структура перенесенных гинекологических заболеваний женщин позволила установить, что хронические воспалительные заболевания органов малого таза в 1-й и 2-й группах регистрировались чаще, чем в контрольной группе, однако статистическая значимость не была выявлена. Наряду с этим проведен анализ инфекционного статуса нижнего генитального тракта рожениц всех клинических групп. Дисбиоз цервикального канала, кольпит, инфекции, передаваемые половым путем (ИППП), эндоцервицит присутствовали приблизительно в одинаковом процентном случае у женщин 1-й и 2-й групп, превышая таковой процент встречаемости у пациенток контрольной группы. Так, эндоцервицит у рожениц 1-й клинической группы встречался в 32 (71,1%) случаях, что повышало риск развития ранних преждевременных родов в 3,7 (95% ДИ 2,238–5,984) раза. Дисбиоз цервикального канала у пациенток 1-й клинической группы отмечен в 29 (64,4%) случаях, кольпит – в 16 (44,4 %), что в 3,3 и 6,4 раза соответственно чаще, чем у рожениц 3-й группы. Это повышало риск развития ранних преждевременных родов в 3,7 (95% ДИ 1,808–4,396) раз. Что касается пациенток 2-й клинической группы, то частота встречаемости дисбиоза, кольпита, эндоцервицита, ИППП также превышала частоту их присутствия у рожениц контрольной группы: дисбиоз цервикального канала выявлен – в 25 (59,5%) случаях, ИППП – в 10 (23,8%), эндоцервицит – в 24 (57,1%).
Экстрагенитальные заболевания выявлены у ряда обследованных женщин из 3 групп. В 1-й группе заболевания сердечно-сосудистой системы имели место у 5 (11,1%) женщин, во 2-й группе – у 4 (9,5%), заболевания желудочно-кишечного тракта в 1-й группе – у 5 (11,1%), во 2-й группе – у 3 (7,1%), хронический пиелонефрит и цистит были выявлены у женщин 1-й и 2-й групп – 44,4% и 42,9% соответственно. Характер течения беременности свидетельствовал о наличии угрозы ее прерывания у 33 (73,3%) женщин 1-й группы, а во 2-й – у 24 (57,1%). Также диагностирована ФПН у 32 (71,1%) обследованных в 1-й группе, у 18 (42,9%) – во 2-й группе, умеренная преэклампсия (ПЭ) у 40% пациенток 1-й группы, что в 3 раза чаще, чем у женщин 2-й группы. При этом многоводие зарегистрировано у 11 (24,4%) беременных 1-й группы, во 2-й группе – у 9 (21,4%); задержка роста плода (ЗРП) диагностирована у 4 (8,9%) женщин в 1-й группе, во 2-й – у 8 (19,0%); анемия имела место у пациенток в 4 (68,9%) случаев в 1-й группы, а во 2-й группе – в 8 (19,1%). Указанные осложнения беременности встречались в 2 раза чаще у женщин 2-й группы, чем в 1-й. В период родов у рожениц наблюдался преждевременный разрыв плодных оболочек (ПРПО): в 1-й группе – у 17 (37,8%), во 2-й – у 24 (57,1%), острый дистресс плода – у 12 (26,0%) пациенток 1-й группы, во 2-й группе – у 3 (7,14%), что почти в 4 раза чаще. У 13,3% женщин 1-й группы имела место отслойка нормально расположенной плаценты.
Для выяснения роли оксида азота и кахектина в патогенезе ПР определяли в сыворотке крови показатели комплекса биологически активных веществ, участвующих в сократительной деятельности матки. Сыворотку крови получали в первом периоде родов методом венепункции. Женщины с ранними ПР находились в латентной или активной фазе раскрытия шейки матки. Роженицы со своевременными родами были в активной фазе раскрытия шейки матки. Определяли также содержание липокортина (аннексина), активность субъединицы р65 ядерного фактора NF-kB и активность фосфолипазы А2 (ФЛА2) иммуноферментным методом, используя наборы фирмы Cytimmune systems, USA. Содержание сосудистого эндотелиального фактора роста (СЭФР-А) и кахектина определяли методом твердофазного иммуноферментного анализа. Количественную оценку СЭФР-А и кахектина осуществляли с использованием тест-систем Red& systems, USA. Работу проводили на многофункциональном счетчике для иммуноферментных методов определения с программным обеспечением (Victor Finnland).
Эндогенный уровень оксида азота в форме нитрит-аниона (NO2) после энзиматического восстановления нитратов в нитриты определяли с помощью классической реакции Грисса [9] и обозначали как NO. Активность NO-синтазы (КФ 1.14.13.39) измеряли по увеличению продукции NO из 1-аргинина в присутствии НАДФН. Количественную оценку образованного NO проводили с помощью ЭПР-спектроскопии мононитрозильных комплексов с двухвалентным железом и диэтилдитиокарбоматом (ДЭТК), обладающих характерными парамагнитными свойствами [10].
Статистическую обработку данных осуществляли с помощью лицензионного пакета программ Statistica (версия 5.1. фирмы Statsoft Inc).
Проверка данных биохимических показателей 1-й, 2-й групп и группы контроля критерием Колмогорова–Смирнова показала, что гипотеза о нормальности их распределения должна быть отвергнута. Сравнение указанных трех групп проводилось с помощью критерия Краскела–Уоллиса при последующем уточнении критерием Манна–Уитни с поправкой Бонферрони (трехкратное сравнение).
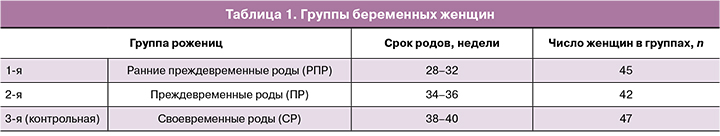
Основные описательные статистики приведены в табл. 2 в виде объема выборки, медианы, первого и третьего квартиля.
Результаты и обсуждение
Исследования, касающиеся изученных клеточных биорегуляторов в сыворотке крови женщин с РПР, выявили значимые изменения в содержании всех изученных биорегуляторов (табл. 3).
Так, уровень кахектина был снижен в 1,35 раза (р1<0,001) относительно данных при СР. Показатели активности р65 NF-kB, ФЛА2 и содержания аннексина были повышены в 1,34 раза (р1<0,001), 1,88 раза (р1<0,001) и 1,18 раза (р1<0,001) соответственно.
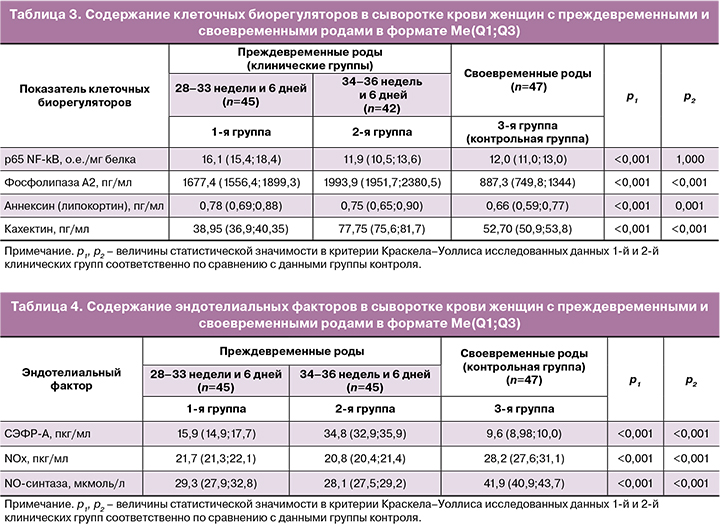
Что касается эндотелиальных факторов (табл. 4), то у женщин с РПР (1-я клиническая группа) в сыворотке крови обнаружен высокий уровень СЭФР-А, который превышал величины при СР в 1,66 раза (р1<0,001). В то же время активность NO-синтазы у данных женщин оказалась сниженной в 1,43 раза (р1<0,001), как и уровень метаболитов оксида азота – в 1,3 раза (р1<0,001) относительно данных, выявленных в сыворотке крови женщин с СР.
Обращает на себя внимание особенно значимое повышение продукции СЭФР-А в 1,66 раза (р1<0,001). Этот факт является убедительным подтверждением наличия гипоксемии [11]. Известно, что СЭФР-А относят к факторам роста, обеспечивающего рост сосудов. Современная теоретическая платформа последних лет гласит: СЭФР-А – важнейший скрининговый маркер, определяемый в сыворотке крови, предсказывающий развитие акушерской патологии, в частности РПР [12].
Другой показатель вазоактивной системы оксида азота – NO-синтаза – при РПР был снижен. Поскольку NO-синтаза относится к кислородзависимым ферментам, становится очевидным, в результате чего наблюдается падение ее активности, приводящее к довольно значимому снижению продукции NOх – важнейшего вазодилататора по сравнению с группой контроля – СР (21,7 пкг/мл против 28,2 пкг/мл) (р<0,001) [13]. С клинической точки зрения, высокий уровень СЭФР-А и сниженный уровень NOх как и падение активности NO-синтазы свидетельствуют о наличии гипоксемии.
Данные в сыворотке крови рожениц биологически активных веществ, обеспечивающих сократительную деятельность матки в развитии ПР 34–36 недель и 6 дней (2-я клиническая группа), наглядно отраженные в табл. 3, показывают, что содержание аннексина было повышено в 1,14 раза (р2=0,001), а активность субъединицы р65 ядерного фактора NF-kB осталась практически неизменной (р2=1,000). Обнаружено увеличение содержания кахектина и особенно – повышение активности ФЛА2 в 1,48 (р2<0,001) и в 2,25 (р2<0,001) раза соответственно.
Специфика метаболизма молекулярных биорегуляторов контрактильной активности матки у рожениц 2-й группы c ПР 34–36 недель и 6 дней характеризуется одновременным изменением в виде повышения содержания уровня кахектина и повышения активности ФЛА2, в то время как у женщин 1-й клинической группы с РПР показатели кахектина были сниженными.
Изучение показателей эндотелиальных факторов выявило наибольшие изменения для СЭФР-А (табл. 4). Его содержание в крови женщин 2-й группы увеличивалось в 3,63 раза относительно СР (р2<0,001), а метаболитов оксида азота (NOx) – сниженным в 1,36 раза (р2<0,001), как и активность NO-синтазы – в 1,49 раза (р<0,001). Уровень СЭФР-А при ПР у женщин 2-й группы был выше в 2,19 раза (р<0,001) по сравнению с этим показателем в 1-й клинической группе.
Изложенные выше данные убеждают в том, что у рожениц при ПР в 34–36 недель и 6 дней гипоксическое состояние более выражено, чем у женщин при ранних ПР. Указанное положение подтверждается снижением в этих условиях уровня NOx в 1,04 раза (р<0,001). При этом активность NO-синтазы в 1-й группе соответствовало величине ее активности во 2-й группе пациентов (р=0,124).
Полученные нами данные демонстрируют метаболические особенности продукции биоактивных веществ сократительной активности матки при ПР. Модификация продукции кахектина и оксида азота способствует изменению физиологического соотношения внеклеточного и внутриклеточного кальция [14].
Таким образом, при преждевременных родах снижение генерации NO и повышение уровня кахектина (ФHOα) обусловливают сокращение миометрия в результате нарушения их физиологических концентраций. Данная метаболическая ситуация приводит к нарастанию содержания внутриклеточного кальция. Роль кахектина, состоящая в контроле кальциевых каналов мембраны, при высоком уровне кахектина у беременных с ПР 34–36 недель и 6 дней, обусловливает их открытие, что способствует избыточному поступлению ионов кальция в клетки миометрия [4]. В то же время, выявленный низкий уровень оксида азота, обеспечивающий элиминацию ионов кальция, ограничивает выход Са2+ из клеток миометрия [15]. Такая метаболическая ситуация характерна для пациенток с ПР в 34–36 недель и 6 дней.
В данном исследовании выявленный сниженный уровень кахектина и оксида азота у беременных при РПР (28–34 недели и 6 дней) свидетельствует о наличии другой метаболической ситуации, когда в большей степени имели место нарушения процесса элиминации Са2+ из клеток. Продуцируемый различными клетками иммунной системы кахектин осуществляет регуляцию комплекса межклеточных взаимодействий, принимает ключевое участие в регуляции иммунного ответа. Можно полагать, что у беременных с ранними ПР – низкий уровень кахектина свидетельствует о наличии иммунодефицита как этиологического фактора данной патологии.
При выполнении исследования было установлено исключительное значение СЭФР-А в сыворотке крови в диагностике гипоксии при ПР в 34–36 недель и 6 дней, что позволяет прогнозировать нарушение генерации NO, обусловленное снижением активности NO-синтазы. При ранних ПР (28–33 недели и 6 дней) снижение генерации NO и низкий уровень кахектина обусловливают сокращение миометрия в результате изменения их физиологических показателей в организме беременной, приводящих к нарастанию внутриклеточного содержания ионов кальция. Процессы регуляции активности NO-синтазы, катализирующей образование NO из L-аргинина, имеют важное значение в продукции данного фермента. Снижение активности NO-синтазы при ранних ПР развивается под действием гипоксического состояния (высокий уровень СЭФР-А) выше в 1,66 раза (р1<0,001), а в случае с ПР 34–36 недель и 6 дней оно является не только результатом гипоксии, но и падения синтеза NO-синтазы, обусловленного значительным снижением активности р65 NF-kB. Метаболическая значимость низкой активности p65 NF-kВ относительно NO-синтазы заключается в снижении активации ее гена. Обнаруженное уменьшение активности NO-синтазы у рожениц 2-й группы, можно полагать, является фактором, обусловливающим падение количественного уровня этого фермента [16]. Последнее дает основание для понимания характера изменений обмена изученных биологически активных веществ при РПР – ПР 28–32 недели и 6 дней и ПР 34–36 недель и 6 дней.
Заключение
Выявленные особенности продукции оксида азота и кахектина, при РПР 28–33 недели, заключаются в снижении генерации NO и кахектина. При ПР 34–36 недель обнаружены низкий уровень NO и высокие значения кахектина. В обоих случаях ПР регистрировалась низкая активность NO-синтазы. Дополнительным фактором падения активности NO-синтазы при ПР 34–36 недель беременности является снижение ее количества (синтеза).
Таким образом, определение нарушенной продукции предиктора сократительной деятельности матки кахектина, в сыворотке крови беременных женщин, позволит прогнозировать данную патологию и осуществлять ее профилактику с учетом патогенеза.



