Плацента представляет собой орган, который играет динамичную роль в процессах взаимодействия двух организмов – матери и плода. Высокий темп развития плаценты, растущие потребности плода сопровождаются особыми требованиями к метаболическим и гемодинамическим процессам, лежащим в основе функциональной деятельности плаценты [1].
Нарушение функции плаценты, являясь универсальным механизмом акушерской патологии, нередко приводит к спонтанному или индуцированному преждевременному прерыванию беременности. Каскад нарушений метаболизма в плаценте при самопроизвольном преждевременном прерывании беременности может служить моделью для изучения универсальных механизмов, представляющих собой срыв адаптационно-гомеостатических реакций поддержания адекватного обмена между организмами матери и плода [2, 3].
Физиологическая беременность характеризуется развитием окислительного стресса, являющегося одним из центральных механизмов общей системы адаптации к новым условиям организма женщины. Окислительный стресс выполняет в этой ситуации важные физиологические функции, участвуя в запуске механизмов дифференцировки клеток [4]. В кратковременный период относительного дисбаланса между генерацией и элиминированием активных форм кислорода (АФК) происходит адаптация механизмов системы антиоксидантной защиты (АОЗ) к нарушению физиологического равновесия. При этом эффективность антиоксидантной системы зависит не столько от абсолютных величин отдельных компонентов системы, сколько от соотношения между ними. Неспособность системы АОЗ противостоять усилению процессов свободно-радикального окисления приводит к значительному ослаблению метаболической функции плаценты. Антиоксидантную систему, компоненты которой защищают организм от избыточного образования АФК, ряд авторов рассматривает как единую, интегрируемую и регулируемую структуру, находящуюся под генетическим контролем [5]. Важная роль в системе АОЗ принадлежит глутатион-зависимому звену, к которому относят глутатионпероксидазу (ГП), глутатионредуктазу (ГР), глутатион-S-трансферазу (ГТ) и окислительно-восстановительную систему глутатиона. Сведения об эффективности глутатион-зависимого звена антиоксидантной системы в разных зонах плаценты (центральные и периферические участки) при самопроизвольном прерывании беременности малочисленны и неоднозначны.
Целью настоящей работы было изучение антиоксидантной системы в центральном и периферическом участках плаценты при невынашивании беременности и оценка вклада глутатион-зависимого звена АОЗ плаценты в механизм патогенеза ее дисфункции, приводящего к акушерской патологии
Материал и методы исследования
Материалом для исследования служили ткани плацент 95 женщин, беременность которых самопроизвольно преждевременно прервалась в сроки до 36 недель беременности (основная группа). Контролем служили ткани плацент 97 относительно здоровых женщин, имевших физиологическую беременность, завершившуюся родами в срок (группа сравнения). У 10 из них беременность была прервана в I триместре беременности (до 13 недель) путем искусственного аборта по желанию женщин, у 15 женщин во II триместре (до 28-й недели) по социальным показаниям методом интраамниального введения энзапроста, у 72 женщин беременность закончилась срочными родами в 37–40 недель. В основной группе беременность прервалась в сопоставимые сроки. У всех обследованных женщин отсутствовали экстрагенитальные заболевания и акушерские осложнения беременности. Образцы тканей центрального и периферического участков плаценты тщательно отмывали в холодном физиологическом растворе и гомогенизировали в соотношении 1:9 (вес/объем) в ледяном буфере, содержащем 60 мМ КH2PO4 (Вектон, Россия) и 105 мМ КCl (pH 7.4) (Вектон, Россия). Гомогенат центрифугировали при 750 g в течение 15 минут при 4о С. Полученный супернатант центрифугировали повторно при 10 800 g в течение 15 минут при 4оС и использовали для дальнейших исследований. Для оценки общей антиоксидантной активности (АОА) использовали хемилюминесцентную реакцию рибофлавина (ICN, США) в присутствии ионов двухвалентного железа (Вектон, Россия). Для инициации процесса вводили 0,2 мл 0,1% раствора перекиси водорода, приготовленного ex tempоre. Измерение свечения осуществляли при 37оС в течение 2 мин на хемилюминометре БХЛ-06 (Россия) [6]. Определение супероксиддисмутазы (СОД) осуществляли с использованием нитросинего тетразолия (Reanal, Венгрия). За единицу активности фермента (Е) принимали 50% торможение реакции [7]. Активность каталазы определяли с использованием молибдата аммония (Вектон, Россия) [8]. Определение небелковых тиоловых групп осуществляли с помощью реактива Эллмана (Sigma,США) [9]. Активность ГП определяли с использованием гидроперекиси третичного бутила (ICN, США) [10], ГР – по степени окисления НАДФН (ICN, США) [11], ГТ – по скорости ферментативного образования GS-2,4-динитробензола в реакции восстановленного глутатиона (Sigma, США) с 1-хлор-2,4-динитробензолом (Fluka, Германия) [12]. Белок определяли, используя реактив Фолина (Fluka, Германия) [13]. Обработка полученных результатов осуществлялась с использованием стандартных пакетов программ прикладного статистического анализа (Statistica v.6.0, Microsoft Excel-2002), методов факторного дисперсионного анализа (ANOVA) и множественного регрессионного анализа.
Результаты исследования
 Ранее нами было показано, что при спонтанном прерывании беременности сроком 28–36 недель отмечается усиление процессов свободно-радикального окисления, наблюдаемое в периферической части плаценты: интенсивность люминолзависимой хемилюминесценции и содержание ТБК-активных компонентов были выше в плацентах женщин при преждевременных родах по сравнению с контрольной группой [14].
Ранее нами было показано, что при спонтанном прерывании беременности сроком 28–36 недель отмечается усиление процессов свободно-радикального окисления, наблюдаемое в периферической части плаценты: интенсивность люминолзависимой хемилюминесценции и содержание ТБК-активных компонентов были выше в плацентах женщин при преждевременных родах по сравнению с контрольной группой [14].
Поддержание на определенном уровне эндогенных активных форм кислорода для обеспечения основных метаболических функций плаценты осуществляется за счет антиоксидантной системы. Мы не выявили достоверных различий в величине АОА, в уровнях активностей СОД и каталазы в тканях плацент женщин исследуемых групп. Между тем, определение небелковых SH-групп, которые рассматриваются как «ловушки» свободных радикалов, показало, что их содержание в центральных и периферических участках плацент женщин основной группы было меньше, чем в соответствующих участках плацент женщин контрольной группы (таблица).
Известно, что основным низкомолекулярным SH-соединением в организме является глутатион, на долю которого приходится до 90% всех тиоловых соединений. Клеточный пул глутатиона формируется в результате динамического равновесия процессов его биосинтеза и деградации. К ключевым ферментам, принимающим участие в метаболизме глутатиона и являющимися компонентами антиоксидантной системы клеток, относят ГП, ГР и ГТ.
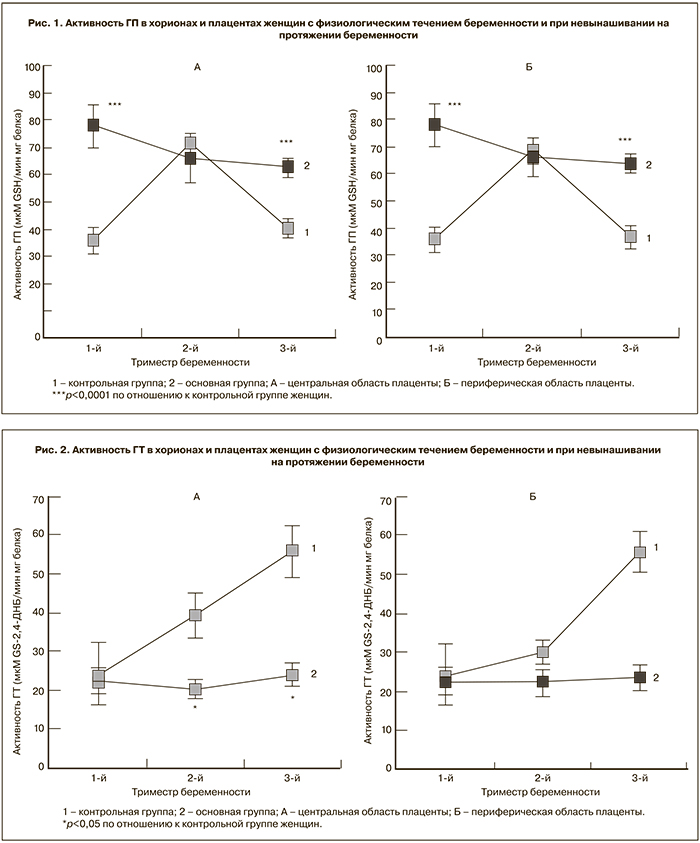
Выяснено, что активность ГП (рис. 1) в хорионе и плаценте основной группы достигает максимальной величины как по центру, так и по периферии уже в первом триместре беременности и превышает в 1,5–2 раза активность фермента в контрольной группе на протяжении всего срока беременности. Активность ГП в плаценте контрольной группы в первом и третьем триместрах не изменялась. Увеличение активности ГП во втором триместре мы связываем с тем, что плаценты женщин контрольной группы этого триместра были получены при прерывании беременности по социальным показаниям с применением интраамниального введения энзапроста (простагландина Е2α). Согласно литературным данным, в плаценте женщин с физиологическим течением беременности активность ГП достоверно не меняется 15]. Достоверных различий в уровне активности ГР в хорионах и плацентах женщин основной группы и группы сравнения выявлено не было на протяжении всей беременности. Таким образом, в плацентах женщин при самопроизвольном спонтанном прерывании беременности преобладает более интенсивное использование пула восстановленного глутатиона, чем его пополнение.
В тканях млекопитающих восстановленный глутатион используется, кроме ГП, семейством многофункциональных белков ГТ, многочисленные функции которых демонстрируют важное значение этого фермента не только в клеточных процессах метаболизма, детоксикации, но в защите от деструктивного действия окислительного стресса.
Активность ГТ в плацентах женщин при физиологической беременности увеличивалась в динамике развития беременности, при невынашивании оставалась на уровне первого триместра в центральной и периферической областях (рис. 2).
Полученные данные позволяют заключить, что в центральной и периферической областях плацент женщин при самопроизвольном преждевременном прерывании беременности наблюдается дефицит активности глутатион-зависимого звена антиоксидантной системы плаценты. Следовательно, при невынашивании беременности в плаценте происходит развитие окислительного стресса, связанное с нарушением сбалансированности между интенсивностью образования АФК и активностью глутатион-зависимого звена АОЗ.
Для определения значимости активности ферментов глутатион-зависимого звена АОЗ в плацентах обследованных женщин при выявлении риска преждевременного прерывания беременности был проведен многофакторный линейный дискриминантный анализ на основании ретроспективных данных. В качестве переменных были использованы уровни активности ферментов глутатион-зависимого звена АОЗ в плаценте, а в качестве зависимой характеристики – факт спонтанного преждевременного прерывания беременности. На основании этого анализа разработана модель расчета индекса преждевременного прерывания беременности (ИППБ), в которой ключевая роль принадлежит функциональному состоянию ГП и ГТ центрального участка плаценты:
ИППБ=0,093ГТ(ц) – 0,028ГП(ц)
где: ИППБ – индекс преждевременного прерывания беременности; ГT(ц) – значение активности ГT в центральной части плаценты; ГП(ц) – значение активности ГП в центральной части плаценты.
Пороговое значение ИППБ, рассчитанное по выше представленной модели, равно 1,06. Величина индекса имеет обратную зависимость с риском развития преждевременного прерывания беременности. Метод расчета риска преждевременного прерывания беременности имеет чувствительность 73,7%, специфичность – 64,7% и точность 70,9% (χ2=5,80; р=0,016; ТМФ: р<0,015), что свидетельствует о важной роли уровня активности ГП и ГТ для физиологического течения беременности.
Обсуждение
На сегодняшний день направленность и степень изменений в работе ферментов глутатион-зависимого звена АОЗ в плаценте женщин окончательно не ясна. Это затрудняет своевременное прогнозирование глубины и выраженности системного окислительного стресса, развивающегося в плаценте при различных акушерских и экстрагенитальных заболеваниях у матери, в том числе и при невынашивании беременности. Так литературные данные об активности ГП в плацентах женщин, беременность которых осложнена гестозом, противоречивы. M.F. Knapen с соавт. [16] отмечали, что у женщин с преэклампсией наблюдалось увеличение уровня активности ГП в тканях плаценты и децидуальной оболочке на протяжении беременности. Причем активность фермента в децидуальной оболочке была выше, чем в самой ткани плаценты как у женщин с физиологической беременностью, так и у женщин с преэклампсией. Другие исследователи не выявили достоверных различий в уровне активности ГП в плацентах женщин, беременность которых протекала физиологически, и в плацентах женщин, имевших преэклампсию [17]. Третья группа исследователей обнаружила более низкий уровень активности ГП [18] и снижение экспрессии мРНК в плацентах женщин с преэклампсией. При этом S.W. Walsch и Y. Wang, перфузируя изолированные плацентарные котиледоны человека буфером, содержащим 95% О2, 5% СО2 и разные концентрации бутилгидроксида, выявили в образцах, полученных от женщин с преэклампсией, увеличение содержания эндогенных гидроперекисей липидов [19]. Образование гидроперекисей липидов происходило более интенсивно с материнской стороны плаценты, чем со стороны плаценты, обращенной к плоду. Авторы на основании полученных результатов высказали гипотезу, согласно которой плацента может быть источником циркулирующих в крови матери гидроперекисей липидов. При физиологически протекающей беременности ГП связывает гидроперекиси липидов, лимитируя активность простагландин-Н-синтетазы. Недостаток активности ГП в плаценте женщин с преэклампсией способствует увеличению гидроперекисей липидов, что, в свою очередь, стимулирует активность простагландин-Н-синтетазы и увеличивает образование тромбоксана и гидроперекисей. Преобладание тромбоксана и гидроперекисей липидов может привести к повреждению эндотелия сосудов плаценты с последующим развитием в них тромбоза.
Согласно данным, полученным А.В. Шестопаловым, при неразвивающейся в I триместре беременности в хорионах наблюдалась депрессия глутатион-зависимого звена АОЗ: активность ГП уменьшалась на 51%, содержание восстановленного глутатиона снижалось более чем на треть относительно соответствующих показателей в плаценте женщин с физиологической беременностью. Эти биохимические особенности, по мнению автора, «являются факторами, дополнительно усугубляющими нарушения в регуляции развития беременности и приводящими не только к ее прекращению, но и отсутствию включения эффекторных механизмов отторжения плодного яйца» [20].
Оценивая направленность изменений в работе ферментов глутатион-зависимого звена АОЗ при спонтанном самопроизвольном прерывании беременности, мы показали, что активность ГП в хорионе и плаценте женщин достигала максимальной величины уже в первом триместре, превышая значения уровня активности фермента в плацентах женщин группы сравнения на протяжении всего срока беременности более чем в 1,5–2 раза. Наши данные согласуются с результатами, полученными M.F. Knapen с соавт. на плацентах женщин с преэклампсией [16].
Обнаруженные изменения активности ГП при неизменном уровне активности ГР в каждом рассматриваемом сроке беременности в плацентах женщин при невынашивании, сопряженные с падением уровня содержания SH-групп, свидетельствуют о возрастающем дефиците пула восстановленного глутатиона.
В последние годы представления об участии глутатиона в антиоксидантных процессах существенно расширились. Сохранение оптимального для клеток соотношения GSH/GSSG является важным фактором ее жизнеспособности. Незаменимым компонентом антиоксидантной системы является ГТ, которая использует GSH для конъюгации с неполярными соединениями и участвует в детоксикации продуктов окислительного стресса. Наши исследования показали, что при спонтанном преждевременном прерывании беременности уровень активности ГТ на протяжении всего срока беременности оставался низким как в центральной, так и периферической частях плаценты, и не превышал активность фермента в первом триместре беременности.
Суммируя вышеизложенное, можно предполагать, что снижение антиоксидантной емкости глутатион-зависимого звена АОЗ в плаценте при спонтанном преждевременном прерывании беременности происходит вследствие нарушения баланса в универсальных процессах метаболизма глутатиона. Повышение уровня активности ГП, использующей восстановленный глутатион, не сопровождается эквивалентным увеличением уровня активности ГР, превращающей GSSG форму в GSH. В этих условиях возникающий дефицит восстановленного глутатиона может приводить к снижению уровня активности ГТ, играющей центральную роль в процессах детоксикации плаценты в функциональной системе мать – плацента – плод. С другой стороны, уменьшение активности глутатион-зависимого звена АОЗ в плаценте женщин связано с дальнейшим усилением состояния окислительного стресса, которое может завершаться дисфункцией плаценты, как это происходит при невынашивании беременности. Вышесказанное позволяет рассматривать уровни активностей ГП и ГТ в качестве биохимических маркеров дисфункции плаценты. Значение уровней активности ферментов глутатион-зависимого звена АОЗ в плаценте в процессах вынашивания беременности подтверждается разработанной нами прогностической моделью, позволяющей рассчитать потенциальный риск прерывания беременности. Следует отметить, что представленная модель прогноза невынашивания позволяет рассматривать центральные области плаценты наиболее важными участками, ответственными на формирование в ней функциональной активности глутатион-зависимого звена АОЗ.



