В настоящее время отмечен рост частоты ранних потерь беременности. Женщины с отягощенным акушерско-гинекологическим анамнезом (ОАА) составляют группу риска по развитию гестационных осложнений, таких как самопроизвольный выкидыш, неразвивающаяся беременность, угроза прерывания беременности, хроническая плацентарная недостаточность, эклампсия и др.
В настоящее время отсутствует возможность достоверного прогнозирования такой акушерской патологии, как самопроизвольные выкидыши, замершая беременность, вследствие схожести факторов риска развития данной патологии и других осложнений гестации (угроза прерывания беременности, эклампсия, хроническая плацентарная недостаточность) [1–3].
В основе развития ряда осложнений беременности некоторые авторы выделяют эмбриоплацентарную дисфункцию, клинические проявления которой определяются как генетическим кодом, так и характером экзогенных и эндогенных влияний [3].
Исследование генетических причин развития акушерских осложнений было выполнено на генах-кандидатах, имеющих отношение к тромбофилии, метаболизму фолиевой кислоты, липидному обмену, окислительному стрессу, функционированию ренин-ангиотензиновой системы и др. Однако предложенные на сегодняшний день диагностические системы наследственной предрасположенности к данной патологии не имеют достаточной прогностической значимости. Это объясняется нелинейностью и сложностью взаимоотношений генотип-фенотип. Большинство ассоциативных генетических исследований не учитывает таких феноменов, как фенокопии, ген-средовые и межгенные взаимодействия [4–6].
По мнению ряда исследователей, эпистатические (ген-генные) взаимодействия – обязательный компонент широко распространенных заболеваний человека [4, 5]. Отдельные же генетические варианты имеют достаточно низкий вклад в формирование патологического фенотипа. Основываясь на данном предположении, следует искать сочетания генетических вариантов и анализировать межгенные и ген-средовые взаимодействия, играющие роль в формировании патологического фенотипа.
В настоящее время разработаны различные статистические методы анализа межгенных и ген-средовых взаимодействий: логистическая регрессия, нейронные сети, метод снижения многомерной размерности (Multifactor dimensionality reduction method), метод комбинаторного разбиения (Combinatorial partitional method), метод рестрикционного разбиения и другие [6].
Цель исследования: анализ межгенных взаимодействий генов-кандидатов тромбофилии, нарушений обмена гомоцистеина, регуляторов артериального давления сосудистого тонуса у женщин с различными вариантами акушерской патологии в анамнез.
Материал и методы исследования
В исследовании проанализированы данные молекулярно-генетического тестирования полиморфных вариантов генов предрасположенности к различной мультифакториальной патологии 400 женщин, обратившихся за медицинской помощью в НИИ Охраны материнства и младенчества Минздрава России г. Екатеринбурга в период с 2009 по 2012 г.
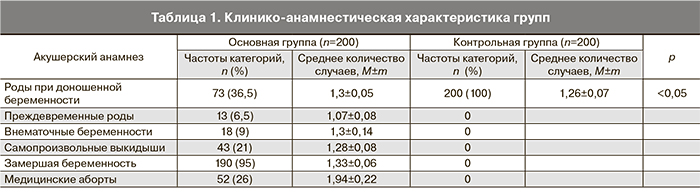
В исследование были включены беременные и женщины на этапе предгравидарной подготовки. Пациентки были разделены на две группы в зависимости от характера акушерского анамнеза. Опытную группу составили 200 женщин с отягощенным акушерским анамнезом (самопроизвольные выкидыши, преждевременные роды, замершая беременность). Также у женщин этой группы зарегистрированы медицинские аборты до 12 недель гестации, внематочные беременности и беременности с рождением доношенных детей. Контрольная группа была представлена 200 женщинами с физиологическим течением беременностей и родов в анамнезе (табл. 1). Среднее количество беременностей в группах составило: в основной группе 2,7±0,13, в группе сравнения 3,6±0,13 беременности. Возраст беременных в обеих группах варьировал от 21 до 42 лет, средний возраст пациенток с невынашиванием беременности составил 25–42 (31,3±0,4) года, в контрольной группе – 21–38 (36,5±0,7) лет. По показателю среднего возраста и количеству беременностей группы были сопоставимы.
Для изучения межгенных взаимодействий генов – кандидатов тромбофилии, гипергомоцистеинемии, регуляторов артериального давления и сосудистого тонуса была сформирована группа женщин с перинатальными потерями как ранних, так и поздних сроков гестации. Это обусловлено тем, что все продукты изучаемых в работе полиморфных вариантов генов объединяет участие в регуляции системы гемостаза и фетоплацентарного кровообращения. Нарушения в системе гемостаза и сосудистого тонуса ведут к снижению маточно-плацентарного кровотока, что неблагоприятно влияет на процесс инвазии трофобласта на ранних сроках беременности. Это в свою очередь ведет к прерыванию беременности на ранних сроках гестации, а на более поздних – к формированию фетоплацентарной недостаточности, эклампсии, что также может привести к прерыванию беременности или преждевременным родам [7].
Пациенткам основной и контрольной групп проводилось молекулярно-генетическое типирование полиморфных вариантов генов предрасположенности к различной многофакторной патологии:
- Гены ключевых ферментов обмена гомоцистеина: MTHFR 677 С>T, MTHFR 1298 A>C, MTR 1256 A>G и MTRR 66 A>G.
- Гены компонентов системы гемостаза: FGB -455 G>A, F2 20210 G>A, F5 1691 G>A, F7 10976 G>A, F13 163 (100) G>T (Val34Leu), ITGA2 807 C>T, ITGB3 1565T>C, PAI-1 -675 5G>4G.
- Гены регуляции артериального давления крови: ADD1 1378G>T, AGT 704 T>C, AGT 521C>T, AGTR1 1166 A>C, AGTR2 1675G>A, CYP11B2 -344C>T, GNB3 825C>T, NOS3-786T>C, NOS3 894 G>T.
Образцы ДНК пациенток получали из буккального эпителия, используя коммерческие наборы реагентов и протоколы для выделения ДНК (НПО «ДНК-Технология», Россия). Для оценки количества выделенной геномной ДНК использовали набор реагентов «КВМ» контроля взятия материала для метода ПЦР (НПО «ДНК-Технология», Россия). В исследование брали не менее 1,0 нг геномной ДНК на реакцию. Генотипирование образцов по аллельным вариантам исследуемых генов проводили методом аллель-специфичной полимеразной цепной реакции (ПЦР) в «режиме реального времени» со снятием кривых плавления продуктов амплификации. Анализ результатов ПЦР проводили в автоматическом режиме программного обеспечения детектирующего амплификатора ДТ-96 (НПО «ДНК-Технология», Россия).
Статистический анализ данных проводился с помощью пакета статистических программ Statistica 7.0 и SPSS 13.0. Различия между параметрическими переменными с нормальным распределением устанавливались при помощи t-критерия Стьюдента. Сравнение частот генотипов полиморфных вариантов отдельных генов между анализируемыми группами проводилось при помощи критерия χ2 Пирсона (Person) и χ2 Йетса (Yates) для числа наблюдений менее 10. Для оценки роли межгенных взаимодействий в патогенезе формирования акушерских осложнений использовали логистический регрессионный анализ (регрессионную модель пропорционального риска Кокса). Относительный вклад отдельных предикторов выражался величиной статистики Вальда χ2 и величиной стандартизированного коэффицента регрессии. Данным статистическим методом был проанализирован комплексный вклад независимых генотипических предикторов в патогенезе различных акушерских осложнений: самопроизвольных выкидышей, преждевременных родов, замершей беременности. Нулевая гипотеза отвергалась при р<0,05. Тест на соответствие распределения генотипов закону Харди–Вайнберга в обеих выборках проводили с помощью критерия χ2 с использованием программы Hardy–Weinberg equilibrium.
Построение модели логистической регрессии предполагает получение математического уравнения, с помощью которого можно предсказать вероятность изучаемого события (формирование различной акушерской патологии). Алгоритм расчетов предполагает разделение всех имеющихся данных на две части: обучающую и тестовую выборку. На обучающей выборке формируется уравнение решающего правила, позволяющего правильно предсказать вероятность изучаемого события (беременности) на данной выборке. Далее уравнение решающего правила применяется на тестовой выборке и результаты предсказания сравниваются с истинными классами объектов из тестовой выборки (разделение женщин на группы с отягощенным акушерским анамнезом и без такового). Это позволяет оценить точность полученного уравнения решающего правила. Для формирования обучающей и выборки методом случайной рандомизации из исходного множества пациенток основной и контрольной групп было отобрано по 150 женщин для обучающей выборки и по 50 – для тестовой выборки.
Результаты исследования и обсуждение
По результатам однофакторного анализа, включавшего 21 вариант однонуклеотидных замен в генах компонентов системы гемостаза, обмена гомоцистеина и регуляции артериального давления, сравниваемые группы женщин с отягощенным и с нормальным акушерско-гинекологическим анамнезом достоверно не отличались по частоте встречаемости альтернативных аллелей и генотипов. Наблюдалась тенденция более высокой частоты встречаемости среди женщин основной группы генотипа АG полиморфизма MTRR 66 A>G (χ2=9,8, р=0,07). Для большинства полиморфных вариантов генов наблюдаемое распределение частот генотипов в группах соответствовало равновесию Харди–Вайнберга, за исключением полиморфизмов FGB 455G>A, AGTR2 1675G>A, CYP11B2 -344C>T.
Полученные результаты подтверждают известный факт слабого эффекта отдельных однонуклеотидных замен (SNPs) на развитие заболевания без их связи с остальной частью генома и без учета влияния внешней среды [5, 6, 8, 9]. Для основной массы изученных генов – маркеров относительный риск (RR, relative risk) развития заболевания не превышает 1,5. Следовательно, реальный вклад отдельно взятого полиморфизма в развитие мультифакторной патологии сравнительно не велик [7]. Другими словами, чтобы выявить ассоциацию генетического фактора (SNP) с определенным заболеванием, необходимо рассматривать совокупность множества генов, вовлеченных в сложные механизмы патогенеза, факторы внешней среды и клинико-анамнестические данные [5, 6].
По этой причине для дальнейшего поиска ассоциаций изучаемых полиморфизмов генов с развитием акушерской патологии мы применили специальный метод статистического анализа (логистическая регрессия), который позволяет учитывать статистические взаимодействия мутаций множества генов в исследуемых группах [6].
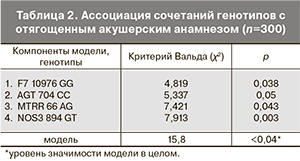
Для учета возможного влияния различных комбинаций изучаемых генов на развитие акушерско-гинекологических осложнений была использована логистическая регрессионная модель пропорционального риска Кокса. В пошаговый логистический регрессионный анализ были включены три группы полиморфных вариантов генов: обмена гомоцистеина (MTHFR 677 С>T, MTHFR 1298 A>C, MTR 1256 A>G и MTRR 66 A>G); компонентов системы гемостаза (FGB -455G>A, F220210 G>A, F5 1691G>A, F7 10976G>A, F13 163(100) G>T (Val34Leu), ITGA2 807C>T, ITGB3 1565T>C, PAI-1 -675 5G>4G); регуляции артериального давления и сосудистого тонуса (ADD11378G>T, AGT 704 T>C, AGT 521C>T, AGTR11166 A>C, AGTR2 1675G>A, CYP11B2 -344C>T, GNB3 825C>T, NOS3 -786T>C, NOS3 894 G>T). Анализ включал результаты генотипирования 400 пациенток, среди которых у 200 наблюдался отягощенный акушерский анамнез (самопроизвольные выкидыши, регрессы беременности, преждевременные роды), а у 200 – нормальный акушерский анамнез. По данным многофакторного анализа на обучающей выборке была сформирована модель, представляющая собой совокупность четырех генотипов: два из них относятся к генам системы регуляции артериального давления и сосудистого тонуса (AGT 704CC, NOS3 894GT), один – к системе генов, кодирующих ферменты метаболизма гомоцистеина (MTRR 66AG), и последний – к генам плазменных факторов свертывания крови (F7 10976G>A). В табл. 2 представлены критерии достоверности включения в модель каждого компонента модели и статистическая значимость модели как совокупности четырех генотипов. Чувствительность модели составила 91% (χ2=15,8, р<0,04). Полученная модель была проверена на тестовой выборке (n=100), и ее чувствительность составила 82±3,4%. На основании полученных расчетов можно вывести логлинейное уравнение прогноза риска отягощенного акушерского анамнеза:

где В, a, b ,c, d – расчетные коэффициенты, xn – генотипы, включенные в модель.
В статистически сформированную модель вошли как гомозиготные (F7 10976 GG, AGT 704 CC), так и гетерозиготные (MTRR 66 AG, NOS3 894 GT) генотипы. Наблюдаемое распределение частот генотипов и аллелей, вошедших в модель однонуклеотидных замен, соответствует ожидаемому равновесию Харди–Вайнберга, следовательно, гетерозиготные и гомозиготные генотипы могут статистически достоверно преобладать в обследуемых группах.
 В построении данной модели прогноза отягощенного акушерского анамнеза мы использовали в качестве независимых предикторов только полиморфные варианты генов – кандидатов тромбофилии, нарушений обмена гомоцистеина, регуляторов артериального давления и сосудистого тонуса. Но, пользуясь подобными моделями, можно использовать более широкий спектр генетических вариантов генов (SNPs), клинико-анамнестических показателей и средовых факторов для прогнозирования индивидуальной предрасположенности к акушерско-гинекологической патологии на любом этапе консультирования женщины. Для этого необходимо провести на локальной популяции исследование на достаточно большой выборке пациентов для получения статистически достоверных данных, чтобы экстраполировать результаты моделирования на генеральную выборку. Необходимо учитывать, что обнаруженные статистически значимые ассоциации могут быть недостоверными на других популяциях [9]. Например, по данным метаанализа 2427 случаев привычного невынашивания беременности выявлена ассоциация генотипа 677ТТ гена MTHFR для монголоидной популяции, а для европеоидной такой ассоциации не обнаружено [10].
В построении данной модели прогноза отягощенного акушерского анамнеза мы использовали в качестве независимых предикторов только полиморфные варианты генов – кандидатов тромбофилии, нарушений обмена гомоцистеина, регуляторов артериального давления и сосудистого тонуса. Но, пользуясь подобными моделями, можно использовать более широкий спектр генетических вариантов генов (SNPs), клинико-анамнестических показателей и средовых факторов для прогнозирования индивидуальной предрасположенности к акушерско-гинекологической патологии на любом этапе консультирования женщины. Для этого необходимо провести на локальной популяции исследование на достаточно большой выборке пациентов для получения статистически достоверных данных, чтобы экстраполировать результаты моделирования на генеральную выборку. Необходимо учитывать, что обнаруженные статистически значимые ассоциации могут быть недостоверными на других популяциях [9]. Например, по данным метаанализа 2427 случаев привычного невынашивания беременности выявлена ассоциация генотипа 677ТТ гена MTHFR для монголоидной популяции, а для европеоидной такой ассоциации не обнаружено [10].
Комплексная оценка различных групп полиморфизмов, влияющих на различные пути патогенеза определенной мультифакториальной патологии, является более перспективной, чем однофакторный анализ [5]. Мультифакторный анализ позволяет учесть генетическую архитектуру сложных отношений генотип-фенотип. Реализация генотипа отдельных генов зависит от локусной гетерогенности, наличия фенокопий, межгенных влияний, ген-средовых взаимодействий [4, 6, 11].
В проведенном исследовании на фоне отсутствия достоверных различий между группами по отдельным полиморфизмам, статистически значимым предиктором отягощенного акушерского анамнеза стало определенное сочетание генотипов (F7 10976GG, AGT 704CC, MTRR 66AG, NOS3 894GT).
Все четыре полиморфных варианта генов отвечают за различные метаболические пути, но, встречаясь в совокупности в одном генотипе, могут являться одним из факторов формирования коагулопатии и, как следствие, плацентарной недостаточности.
Полиморфный аллель 66G гена MTRR ассоциирован с риском анеуплоидии и дефектов нервной трубки у плода, что приводит к выкидышам или замершей беременности на ранних сроках гестации [12]. Есть немногочисленные работы, в которых определена ассоциация аллеля 66G гена MTRR с риском преждевременных родов [13]. Можно предположить, что генетически обусловленная сниженная активность ферментов фолатного цикла оказывает влияние на систему гемостаза, увеличивая риск развития тромботических осложнений и, соответственно, предрасполагает к невынашиванию беременности во II–III триместрах.
Генотип 1565GG гена F7 является дополнительным фактором риска тромбозов и акушерских патологий (регресс беременности на малом сроке, задержка внутриутробного развития плода, гипотрофия плода, фетоплацентарная недостаточность, аномалии внутриутробного развития плода) [7].
Генотип AGT 704 CC, ассоциированный с риском повышения преимущественно диастолического артериального давления, в сочетании с генотипом NOS3 894 GT, ассоциированным со сниженным синтезом оксида азота и дисфункцией эндотелия, могут аддитивно влиять на развитие гипертензии и преэклампсии беременных [14].
В клинической практике достаточно часто у женщин высокого риска перинатальной патологии наблюдается хроническая плацентарная недостаточность. Беременность у таких женщин протекает на фоне угрожающего аборта или преждевременных родов. При сохранности компенсаторных реакций в плаценте ее недостаточность имеет относительный характер, и беременность может закончиться своевременным рождением здорового ребенка.
Можно предположить, что на лабильность компенсаторно-приспособительных реакций на фоне ряда других факторов (эндокринные, инфекционные и др.) влияет и определенное сочетание генотипов генов предрасположенности к акушерским осложнениям (гены факторов гемостаза, метаболизма гомоцистеина, контроля уровня артериального давления и сосудистого тонуса).
Выводы
- В проведенном исследовании 21 полиморфизма генов обмена гомоцистеина, компонентов гемостаза и регуляции артериального давления, на фоне отсутствия достоверных различий между группами по отдельным полиморфизмам, статистически значимым предиктором исследуемых акушерских осложнений стало определенное сочетание генотипов (F7 10976GG, AGT 704CC, MTRR 66 AG, NOS3 894GT).
- Анализ одного генетического фактора не всегда позволяет выявить ассоциацию с определенной мультифакториальной патологией, поэтому комплексная оценка полиморфных вариантов генов, влияющих на различные звенья патогенеза, представляется более перспективной.
- Статистические методы моделирования позволяют изучать межгенные взаимодействия и выявлять ассоциации множества генетических комбинаций с определенным патологическим процессом.



