Врожденная диафрагмальная грыжа (ВДГ) – это порок, который возникает в результате замедления процесса закрытия плевроперитонеального канала или несостоятельности диафрагмы. Последнее приводит к нарушению разделения грудной и брюшной полостей, а также к смещению желудка, селезенки, кишечника и печени в грудную клетку [1, 2]. Вследствие эвентрации органов брюшной полости в грудную клетку ограничивается рост и развитие легких, возникает их гипоплазия с уменьшением общего количества ветвей бронхов. Частота встречаемости этой патологии – 0,28–0,8 случаев на 1000 новорожденных [2, 3]. Широко принятой является классификация диафрагмальных грыж по расположению дефекта: левосторонние (80%), правосторонние (20%), двусторонние (1%) [1–3].
Многоцентровые клинические исследования показали, что частота пренатального выявления диафрагмальной грыжи у плода не превышает 50% [3, 4]. По данным О.И. Гусевой [5], диагностика ВДГ на первом уровне (женские консультации) составила всего 28,6%, на втором (Центр пренатальной диагностики) – 86,9%. Точность пренатальной диагностики ВДГ зависит от их локализации [6]. Наилучшие результаты были получены при диагностике изолированных левосторонних диафрагмальных грыж – 93,6%, тогда как при правосторонней локализации – только 33%.
ВДГ может быть изолированным пороком, однако в 25–57% она сочетается с аномалиями развития других органов и систем плода [3]: в 20% – с врожденными пороками сердца, в 10,7% – с пороками центральной нервной и мочевыделительной системы. Около 10–12% случаев диафрагмальных грыж являются составной частью различных наследственных синдромов (пентада Кантрелла, синдром Фринса, де Ланге, Марфана и др.). Частота хромосомных болезней (трисомия 21, 18, 13) при диафрагмальной грыже варьирует от 16 до 30% [1, 2].
Основным методом дородового выявления диафрагмальной грыжи является эхография. Ультразвуковая диагностика данного порока развития возможна уже с начала II триместра беременности. Однако чаще он выявляется только в конце II триместра в связи с отсутствием характерных ультразвуковых признаков этой патологии в ранние сроки гестации.
При ультразвуковом исследовании при диафрагмальной грыже отмечается аномальное изображение органов грудной клетки, сдавление и смещение сердца (вправо при левосторонней грыже, влево при правостороннем дефекте диафрагмы) в сочетании с появлением в ней патологических анэхогенных образований – желудка, петель тонкого кишечника, в некоторых случаях печени и селезенки [2]. Эхографическая диагностика правосторонних диафрагмальных грыж более сложная, так как грыжевое выпячивание печени в правую половину грудной клетки может быть ошибочно принято за правое легкое плода в связи со схожей эхогенностью. К ультразвуковым признакам данной патологии относят незначительное смещение сердца кпереди и небольшой сдвиг вправо. Однако окончательный диагноз может быть поставлен только при визуализации печени в правой половине плевральной полости, а желудка и петель кишечника – в левой. Дополнительными ориентирами могут служить сосуды печени и пупочная вена, выявленные при допплерометрии, а также аномальное расположение желчного пузыря [7].
 Наиболее сложна диагностика двусторонней диафрагмальной грыжи. В литературе представлены лишь единичные случаи данной аномалии, причем в большинстве случаев диагноз был поставлен уже посмертно [8–10]. Важность диагностики данного порока в пренатальном периоде обусловлена тем, что постнатальная летальность его достигает практически 100% в связи с двусторонней гипоплазией легких. Данный порок в 10% случаев является наследственным заболеванием, а также чаще чем односторонняя диафрагмальная грыжа сочетается с множественными аномалиями развития и хромосомными заболеваниями, такими как синдром Фринса (диафрагмальная грыжа, расщелина неба, гипоплазия пальцев кистей, пороки половых органов, врожденные пороки сердца и др.) [9, 10].
Наиболее сложна диагностика двусторонней диафрагмальной грыжи. В литературе представлены лишь единичные случаи данной аномалии, причем в большинстве случаев диагноз был поставлен уже посмертно [8–10]. Важность диагностики данного порока в пренатальном периоде обусловлена тем, что постнатальная летальность его достигает практически 100% в связи с двусторонней гипоплазией легких. Данный порок в 10% случаев является наследственным заболеванием, а также чаще чем односторонняя диафрагмальная грыжа сочетается с множественными аномалиями развития и хромосомными заболеваниями, такими как синдром Фринса (диафрагмальная грыжа, расщелина неба, гипоплазия пальцев кистей, пороки половых органов, врожденные пороки сердца и др.) [9, 10].
Определение прогноза жизни для плода при ВДГ остается довольно сложной задачей. Перинатальный исход в первую очередь зависит от наличия сочетанных аномалий развития, а также от выраженности гипоплазии легких. В группе плодов с изолированной диафрагмальной грыжей выживаемость новорожденных составляет 60–70%. Основной причиной смерти в неонатальном периоде является гипоплазия легких и легочная гипертензия [11, 12]. По данным J. Bedoyan и соавт. [11], выживаемость новорожденных с диафрагмальной грыжей и сопутствующими пороками развития составляет лишь 36%.
К факторам, позволяющим оценить прогноз жизни новорожденного при диафрагмальной грыже, относят месторасположение печени. При выявлении печени в грудной клетке частота выживания новорожденного не превышает 43%, тогда как при нормальном ее расположении она составляет 80–90% [3].
Тем не менее, по данным ряда авторов [13], четкой корреляции между положением печени и исходом беременности выявлено не было. Наличие желудка в составе диафрагмальной грыжи свидетельствует о менее благоприятном прогнозе, тогда как при расположении желудка под диафрагмой выживаемость детей достигает 90%. Обнаружение многоводия является неблагоприятным косвенным прогностическим признаком. Наличие генерализованного отека плода свидетельствует о крайне тяжелом его состоянии и возможной скорой внутриутробной гибели. При ранней диагностике ВДГ выживаемость новорожденных составляет только 33%, при поздней манифестации порока и соответственно поздней диагностике – 67% [14].
При прогнозировании постнатального исхода наибольшее значение придают оценке объема легких. Поэтому для определения выраженности гипоплазии легких при диафрагмальной грыже рекомендуют вычислять отношение площади контрлатерального легкого, измеренной на уровне четырехкамерного среза сердца плода, к окружности головы плода (LHR). Площадь легкого определяется путем перемножения двух наибольших взаимно перпендикулярных фрагментов легкого [15].
Установлено, что при величине этого отношения 0,9 и менее прогноз для жизни плода неблагоприятный [3]. Однако некоторые авторы подвергают сомнению информативность данного параметра [13].
J. Jani и соавт. [12] считают, что индекс легочной гипоплазии может служить предиктором выживаемости только в сроке 22–28 недель беременности и при условии вхождения печени в грудную клетку. В группе плодов с наличием печени в грудной полости при индексе гипоплазии легкого 0,4–0,7 выживаемость новорожденных составила 0%, при индексе 0,8–0,9 – 15%, при индексе 1,0–1,5 – 65%, при индексе >1,6 – 80%.
К недостаткам данного метода относят то, что, во-первых, LHR возрастает со сроком гестации [16], во-вторых, величина LHR может служить предиктором выживаемости только при внутригрудном вхождении печени у плодов с диафрагмальной грыжей. В-третьих, точное измерение легкого не всегда возможно в связи со схожестью его с эхогенностью печени.
В настоящее время с целью создания условий для нормального развития легочной ткани у детей с неблагоприятным постнатальным прогнозом выполняют фетальное оперативное вмешательство. При соотношении реальное/ожидаемое LHR менее 15% плод имеет выраженную гипоплазию легочной ткани. При такой степени гипоплазии выживаемости отмечено не было. При наличии этого соотношения, находящегося в интервале 15–25%, можно предполагать развитие тяжелой гипоплазии, выживаемость при которой составляет около 15%. При лучших показателях она может достигать 60% и более [16].
Чтобы уменьшить число неблагоприятных исходов, некоторые авторы рекомендуют применять трахеальную окклюзию плода (FETO). Данную операцию проводят у плодов при соотношении реальное/ожидаемое LHR менее 27% и расположении печени в грудной полости при сроке беременности 26–28 нед. Фетоскоп диаметром 3,3 мм применяют для размещения баллона между кариной и голосовыми связками под контролем ультразвука. Баллон удаляют на 34-й неделе гестации. Полагают, что данный баллон способствует снижению компрессии легких органами брюшной полости и увеличению объема легких [17]. К наиболее частым осложнениям следует отнести многоводие, разрыв плодных оболочек, дородовое излитие околоплодных вод [1].
В настоящее время вопрос применения FETO у плодов с ВДГ остается дискутабельным. По данным L. Gucciardo и соавт. [7], J. Deprest и соавт. [17], в группе плодов, где реальное/ожидаемое LHR составляет 15–25%, применение FETO повышает выживаемость с 15 до 50–57%. В то же время M. Harrison и соавт. [18] на основании проведенного рандомизированного исследования не выявили достоверных различий в частоте выживаемости у новорожденных при пренатальной окклюзии трахеи по сравнению со стандартной консервативной тактикой ведения беременности.
Неотложная помощь ребенку с ВДГ начинается еще в родильном зале и заключается в интубации трахеи и искусственной вентиляции легких (ИВЛ), после этого необходимо установить желудочный зонд для эвакуации содержимого. Предоперационная подготовка новорожденного проводится в течение 12–24 ч после рождения и направлена на стабилизацию дыхания и гемодинамики. Она включает в себя ИВЛ, применение оксида озота, силденафилов, раствора магния сульфата, экстракорпоральную мембранную оксигенацию (ЭКМО), инфузионную терапию. Время проведения оперативного вмешательства является одним из наиболее важных вопросов неонатальной хирургии. У новорожденных, которым оперативное вмешательство выполнено в первые сутки после рождения, смертность выше, чем у детей, оперированных в более поздние сроки. Увеличение выживаемости на 10–15% может быть обеспечено благодаря использованию высокочастотной осцилляторной ИВЛ и ЭКМО, что позволяет отложить хирургическое лечение и снизить легочную гипертензию [1].
 Оперативное вмешательство осуществляют из абдоминального доступа в подреберье на пораженной стороне, из плевральной полости извлекают органы. Если дефект в диафрагме представляет собой узкую щель, то ее ушивают. Более крупные дефекты (2/3 части диафрагмы и более) закрывают каким-либо синтетическим материалом (например, «Гор-Текс»). Если имеет место аплазия купола диафрагмы, то синтетический материал вшивают в виде купола к ребрам с «запасом», что позволяет отсрочить выполнение повторной операции по замене «протеза» диафрагмы на больший размер [1].
Оперативное вмешательство осуществляют из абдоминального доступа в подреберье на пораженной стороне, из плевральной полости извлекают органы. Если дефект в диафрагме представляет собой узкую щель, то ее ушивают. Более крупные дефекты (2/3 части диафрагмы и более) закрывают каким-либо синтетическим материалом (например, «Гор-Текс»). Если имеет место аплазия купола диафрагмы, то синтетический материал вшивают в виде купола к ребрам с «запасом», что позволяет отсрочить выполнение повторной операции по замене «протеза» диафрагмы на больший размер [1].
Уровень выживаемости новорожденных с диафрагмальной грыжей существенно различается в различных лечебных учреждениях и колеблется от 35 до 80%. У всех детей, оперированных по поводу диафрагмальной грыжи, отмечается тяжелое течение послеоперационного периода. По данным В.Е. Щитинина и соавт. [19], из 29 пациентов, прооперированных по поводу диафрагмальной грыжи, у 13 детей в последующем развилась бронхолегочная дисплазия, назокомиальная инфекция дыхательных путей выявлена у 6, ишемически-гипоксическое поражение центральной нервной системы III степени – у 12, гипербилирубинемия – у 9, острая печеночная недостаточность – у 4, хилоторакс – у 2. У 7 младенцев, у которых желудок первоначально располагался в грудной полости, в послеоперационном периоде отмечался стойкий гастроэзофагеальный рефлюкс. У 6 детей развилась интерстициальная эмфизема с пневмотораксом справа (5 из них умерли). Продолжительность ИВЛ составила в среднем 11,5 койко-дня, пребывание в отделении реанимации – 21 койко-день, в стационаре – 30–38 койко-дней.
Таким образом, ВДГ является сложным врожденным пороком с неоднозначным перинатальным прогнозом. Использующиеся в настоящее время пренатальные прогностические критерии и применяемые методы исследования не всегда позволяют достаточно точно предсказать конечный исход данного заболевания для новорожденного.
Учитывая это, нами был предложен новый прогностический критерий, заключающийся в том, что при ультразвуковом исследовании определяется индекс компрессии сердца (ИКС) путем вычисления отношения длины сердца к его толщине. Изменения данного показателя связаны с тем, что при дефекте диафрагмы органы брюшной полости, проникая в грудную клетку, оттесняют и сдавливают сердце, что приводит к увеличению его длины и уменьшению толщины [20].
Материал и методы исследования
При проведении настоящего исследования нами проанализированы 73 случая ВДГ у плода, выявленной на базе отделения функциональной диагностики НЦАГиП им. В.И. Кулакова за период с 2005 по 2012 гг.
Первоначально для установления срока беременности, массы и роста плода измеряли бипариетальный и лобно-затылочный размеры его головы, межполушарный размер мозжечка, средний размер живота, средний поперечный размер сердца, длину плеча, бедра, большеберцовой кости и стопы. Затем определяли локализацию и размер плаценты. Особое внимание обращали на состояние внутренних органов и других анатомических образований плода. При выявлении ВДГ оценивали выраженность смещения сердца, объем легочной ткани, особое внимание обращали на расположение кишечника, печени, желудка и селезенки. Проводили также динамическое ультразвуковое наблюдение за состоянием плода в течение всего оставшегося периода гестации и после рождения ребенка.
Оценка информативности ИКС была произведена у 114 плодов при физиологическом течении беременности и у 43 с изолированной врожденной левосторонней грыжей. При ультразвуковом исследовании определение ИКС производили на уровне его четырехкамерного среза. При этом определяли два его наибольших взаимно перпендикулярных диаметра – длину и толщину. ИКС вычисляется путем деления длины сердца на его толщину.
Ультразвуковое исследование осуществляли при помощи прибора Siemens SONOLINE Elegra (Германия) и Alfa 10 (Aloka, Япония) с использованием трансабдоминального конвексного датчика частотой 3,5 МГц и линейного датчика частотой 7,5 МГц. Наряду с этим у всех пациенток проводилась допплерография и кардиотокография с использованием полностью автоматизированного кардиомонитора («Анализатора состояния плода») фирмы «Уникос» (Москва).
Результаты исследования
Из 73 находившихся под нашим наблюдением плодов у 66 (90%) имелась левосторонняя грыжа, у 5 (7%) – правосторонняя и у 2 (3%) – двусторонняя. Правильный диагноз локализации диафрагмальной грыжи установлен у 71 беременной (97%), в 2 случаях (3%) был получен ошибочный результат: в одном из них правосторонняя грыжа ошибочно принята за левостороннюю и в другом двусторонняя диафрагмальная грыжа была расценена как левосторонняя.
Срок диагностики варьировал от 18 до 40 недель (в среднем 31 нед), во II триместре беременности данный порок выявлен у 19 пациенток (26%), в III – у 54 (74%) и зависел от времени обращения беременной в Центр за консультативной помощью.
Выполненные нами исследования показали, что левосторонняя диафрагмальная грыжа на сканограммах проявлялась аномальным изображением органов грудной клетки. Сердце плода в подавляющем большинстве случаев было резко смещено вправо, а в грудной клетке определялись патологические анэхогенные образования – в основном петли кишечника и желудок, а в ряде случаев и паренхиматозные органы – селезенка и часть левой доли печени (рис. 1, 2).
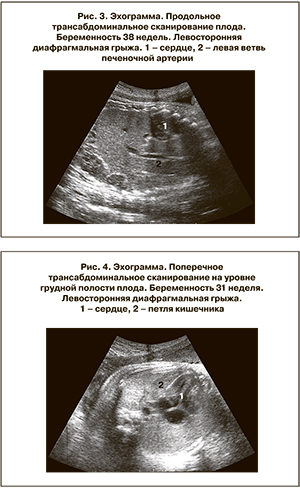
Вхождение левой доли печени в грудную клетку на сканограммах обычно определялось с трудом и идентифицировалось на основании выявления левых печеночной артерии и вены, идущих вдоль всей этой доли от ворот до ее угла (рис. 3).
Значительные трудности в диагностике левосторонней грыжи возникают также тогда, когда в грудной клетке оказывается только небольшой фрагмент кишки. В наших наблюдениях это имело место у двух плодов. В подобных случаях сердце располагается как обычно, а фрагмент кишки локализуется различно. В одном из двух наших наблюдений фрагмент кишки располагался возле задней поверхности грудной клетки, в другом непосредственно примыкал к левой боковой поверхности сердца (рис. 4).
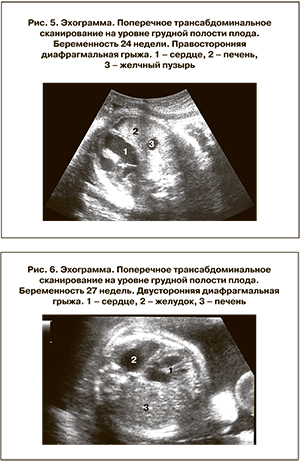
Правосторонняя диафрагмальная грыжа при ультразвуковом исследовании проявлялась смещением сердца влево, в грудной клетке справа определялось паренхиматозное образование средней эхогенности – печень, при использовании допплерографии визуализировались печеночные артерии, а также вены печени, которые на сканограммах изображались в виде двух или трех трубчатых структур небольшого диаметра, в виде веера впадающие в нижнюю полую вену. Желчный пузырь также имел аномальное расположение и определялся непосредственно в правой половине грудной клетки (рис. 5).
Следует отметить, что наиболее характерным признаком всех диафрагмальных грыж являлось его нахождение на стороне возникновения грыжевого образования. В значительном числе случаев это могло быть единственным признаком, позволяющим поставить правильный диагноз в ранние сроки беременности.
Двусторонняя диафрагмальная грыжа характеризовалась тем, что сердце плода несколько смещалось кпереди, располагалось срединно, а поперечный размер был уменьшен. Справа в грудной клетке рядом с сердцем определялась печень с желчным пузырем. При проведении допплерографии визуализировались ее сосуды. В левой половине грудной клетки также на уровне сердца выявлялись петли кишечника и желудок (рис. 6).
При изучении содержимого левосторонней диафрагмальной грыжи было установлено, что в 7 (10%) случаях в нее входили только петли кишечника, в 5 (8%) – петли кишечника и желудок, в 4 (6%) – петли кишечника и селезенка, в 31 (47%) – петли кишечника, желудок и селезенка, в 17 (26%) – петли кишечника, желудок, селезенка и печень. В 1 (1,5%) наблюдении имелась истинная диафрагмальная грыжа, в составе грыжевого мешка определялась только правая доля печени, в 2 (3%) помимо петель кишечника, желудка, селезенки определялась верхняя половина почки.
 Во всех случаях правосторонней диафрагмальной грыжи в плевральную полость входила печень.
Во всех случаях правосторонней диафрагмальной грыжи в плевральную полость входила печень.
При двусторонних дефектах в плевральной полости справа определялась печень, слева петли кишечника и желудок. Следует отметить, что одной из наиболее важных особенностей данной патологии является полное отсутствие на сканограммах изображения легких.
Ложная диафрагмальная грыжа установлена у 54 пациентов, истинная у 19.
Антенатальная гибель плода произошла в 2 (3%) случаях в сроке 24 и 32 недели беременности. Прерывание беременности по медицинским показаниям произведено в 8 (11%) наблюдениях.
Беременность закончилась своевременными родами у 60 (82%) пациенток и преждевременными (в сроках 31–35 недель) у 3 (4%). Роды через естественные родовые пути произошли у 46 (73%) женщин, путем операции кесарева сечения – у 17 (27%). Масса тела новорожденных варьировала от 1232 до 4350 г и составляла в среднем 3218 г, рост – от 46 до 56 см, в среднем – 52 см. В асфиксии легкой степени родилось 15 (24%) детей, средней – 25 (40%), тяжелой – 23 (36%). После рождения средняя оценка по шкале Апгар на 1-й минуте составила 4 балла, на 5-й – 6 баллов.
Гипотрофия I–II степени установлена у 5 новорожденных. Врожденные пороки развития выявлены у 13 (21%) новорожденных. Среди сопутствующих пороков развития преобладали пороки сердца и мочевыделительной системы – по 4 наблюдения, пищеварительного тракта (атрезия двенадцатиперстной кишки и удвоение желудка) – 2, кистозный аденоматоз легкого – 1, хромосомная патология – 2.
После рождения у 36 (57%) новорожденных развилась высокая легочная гипертензия.
Из 63 новорожденных прооперированы 44 (70%). До операции умерли 19 (30%) новорожденных, из них 12 с левосторонней диафрагмальной грыжей, 5 – с правосторонней и 2 – с двусторонним дефектом. Рецидив диафрагмальной грыжи отмечен в 2 (5%) наблюдениях. Послеоперационная выживаемость составила 86% (38 новорожденных), летальность – 14% (6 новорожденных).
В группе новорожденных с летальным исходом до и после операции во всех случаях отмечалась высокая легочная гипертензия. У 5 (20%) новорожденных диафрагмальная грыжа сочеталась с задержкой внутриутробного развития, у 6 (24%) с сопутствующими аномалиями (в 4 случаях пороки сердца, в 2 – хромосомная патология), в 3 (12%) случаях произошли преждевременные роды в сроке 31, 32 и 35 недель беременности.
В составе грыжевого мешка при левосторонней диафрагмальной грыже с летальным исходом у 1 (6%) ребенка выявлены только петли кишечника, у 3 (17%) – петли кишечника и желудок, у 6 (33%) – петли кишечника, желудок и селезенка, у 8 (44%) – помимо этого определялась и часть печени.
С целью повышения эффективности пренатального прогнозирования состояния новорожденного с ВДГ нами при ультразвуковом исследовании плода определялся ИКС у 114 плодов при физиологическом течении беременности и у 43 – с изолированной левосторонней диафрагмальной грыжей. У 20 новорожденных состояние было расценено как легкое и средней тяжести, у 23 – как тяжелое и крайне тяжелое (из них 12 новорожденных умерли).
В результате проведенного исследования было установлено, что предложенный нами индекс (ИКС) не зависел от срока гестации и у здоровых плодов в норме варьировал от 1,0 до 1,2, составляя в среднем 1,02, при диафрагмальной грыже – от 1,1 до 1,9, в среднем – 1,5. При этом было констатировано, что если ИКС составлял менее 1,2, то точность правильного прогнозирования (специфичность) состояния новорожденных составила 88%, ложноположительный результат отмечен в 12%.
В группе плодов с диафрагмальной грыжей при величине ИКС более 1,2 точность прогнозирования состояния новорожденных (чувствительность) составила 79%, ложноотрицательный результат отмечен в 21%.
Наряду с этим было установлено, что если ИКС составил менее 1,5, то 75% детей с диафрагмальной грыжей родились в состоянии легкой и средней тяжести, а если он составлял 1,5 и более, то в 91% состояние здоровья детей было оценено как тяжелое и крайне тяжелое.
Обсуждение
Точность пренатальной диагностики ВДГ варьирует от 25 до 90% [1–3, 11]. Основными эхографическими критериями данной аномалии является выявление смещения сердца (вправо при левосторонней грыже и влево при правостороннем дефекте) и появление в грудной клетке патологических анэхогенных образований – желудка и петель кишечника, в некоторых случаях паренхиматозных органов – печени и селезенки. Диагноз этой патологии может быть поставлен уже в конце I триместра. Однако чаще он устанавливается в конце II триместра в связи с отсутствием выраженных ультразвуковых признаков в ранние сроки беременности. В наших исследованиях данная патология была диагностирована в среднем в 31 неделю при первом обращении пациенток за консультативной помощью.
Данные литературы свидетельствуют, что около 50% случаев диафрагмальной грыжи сочетаются с пороками развития других органов и систем, среди них преобладают пороки сердца, центральной нервной и мочевыделительной системы. Хромосомная патология встречается в среднем в 16%, причем более часто при наличии сочетанной патологии [1–3]. В наших исследованиях сочетанная патология выявлена в меньшем числе наблюдений – у 13 (20%) новорожденных, среди них преобладали пороки сердца, мочевыделительной системы и пищеварительного тракта.
Несмотря на то что методы хирургической коррекции диафрагмальной грыжи хорошо разработаны, выживаемость новорожденных с этим пороком развития остается низкой и колеблется от 35 до 80%.
В наших исследованиях общая летальность составила 42% (из них антенатальная гибель плода произошла в 2 наблюдениях, до операции умерли 19 новорожденных, после операции – 6). Послеоперационная выживаемость составила 86% (38 новорожденных), послеоперационная летальность констатирована в 14% (6 новорожденных).
Данные литературы и анализ наших случаев с неблагоприятным исходом свидетельствуют, что к дополнительным факторам, отрицательно влияющим на исход, относятся сочетанные пороки развития. В наших наблюдениях в группе с летальным исходом у 24% плодов имелись сопутствующие аномалии. Задержка внутриутробного развития констатирована у 20% новорожденных. Преждевременные роды произошли у 12% женщин.
Выполненные исследования показали, что при прогнозировании постнатального исхода важное значение имеет сторона дефекта. В наших исследованиях во всех случаях правосторонней и двусторонней диафрагмальной грыжи (соответственно в 5 и 2 наблюдениях) наступил летальный исход.
Установлено, что основной причиной летальных исходов при диафрагмальной грыже являются респираторные проблемы. В результате сдавления легких органами брюшной полости возникает гипоплазия легких и легочная гипертензия. По нашим данным, в состав грыжевого мешка у новорожденных с летальным исходом при левосторонней диафрагмальной грыжей в 44% случаев входили петли кишечника, желудок, селезенка и печень, в 33% – кишечник, желудок, селезенка, в 17% – петли кишечника, желудок, в 6% – только петли кишечника.
Принято считать, что при определении постнатального прогноза при диафрагмальной грыже наибольшее значение имеет оценка объема легких (коэффициент LHR). К недостаткам данного метода, на наш взгляд, можно отнести то, что точное измерение легкого не всегда представляется возможным, учитывая его схожую эхогенность с печенью, что объясняет довольно невысокую информативность данного коэффициента.
Предложенный нами ИКС является довольно надежным маркером прогнозирования постнатального исхода при диафрагмальной грыже. Преимущество данного метода состоит в том, что он не зависит от срока гестации и позволяет с достаточно высокой точностью проводить необходимые измерения, в связи с четкой визуализацией сердца. При этом установлено, что если ИКС составляет менее 1,5 – это соответствует легкой и средней тяжести постнатального состояния новорожденного, при индексе компрессии сердца от 1,5 и более – тяжелой и крайне тяжелой степени тяжести.
Таким образом, представленные нами данные свидетельствуют, что ВДГ, несмотря на возможность хирургической коррекции, является серьезной врожденной патологией плода с высокой постнатальной летальностью. Применение в этих случаях эхографии позволяет в значительном числе наблюдений с достаточно высокой точностью прогнозировать состояние новорожденных и, основываясь на полученных данных, решать вопрос о целесообразности сохранения или прерывания беременности.



