Рак шейки матки (РШМ) многие годы занимает второе место по распространенности среди онкологических заболеваний органов репродуктивной системы в мире и первое место среди причин женской смертности от рака в развивающихся странах. В последние годы во многих странах отмечается тенденция к увеличению заболеваемости РШМ у женщин репродуктивного возраста вдвое [1]. Внедрение скрининговых программ во многих развитых странах позволило значительно снизить заболеваемость и смертность от РШМ за счет раннего выявления и лечения предраковых заболеваний шейки матки. Ранняя диагностика предрака предусматривает возможность первичной и вторичной профилактики. Первичная профилактика – это система мер по выявлению факторов риска развития РШМ и их устранение. Это прежде всего пропаганда здорового образа жизни, повышение образования населения, борьба с курением, использование барьерных методов контрацепции, профилактика и выявление факторов риска распространения папилломавирусной инфекции (ПВИ) и других инфекций, передаваемых половым путем (ИППП), разработка и внедрение профилактических вакцин. Вторичная профилактика – это цервикальный скрининг, то есть обследование всех женщин с целью выявления изменения эпителия шейки матки и своевременного лечения предрака и РШМ. Организованный скрининг разрабатывается на государственном уровне и должен отвечать двум основным требованиям: быть эффективным и недорогим по стоимости. Скрининговый тест должен быть простым, неинвазивным, чувствительным и специфичным, безопасным, недорогим и доступным. Повышение эффективности профилактики связывают с возможным привлечением к обследованию большого числа женщин, а также с внедрением новых технологий (жидкостная цитология, тестирование на наличие вируса папилломы человека (ВПЧ), компьютерная диагностика и др.) [2–4].
Факторами риска возникновения и развития предрака и РШМ являются: раннее начало половой жизни, наличие большого числа половых партнеров, роды и аборт в очень молодом возрасте.
Ведущая роль в развитии патологии шейки матки принадлежит ВПЧ, особенно штаммам с высокой онкогенной активностью. Роль ВПЧ в качестве причины развития предраковых заболеваний шейки матки подтверждается:
- эпидемиологическими данными, подтверждающими связь между опухолевым процессом и наличием вирусного генетического материала в опухолевых клетках;
- обнаружением в пораженных клетках вирусной ДНК (как в интегрированной, так и в эписомальной форме);
- экспрессией вирусных генов в опухолевых клетках.
Методы исследования при патологии шейки матки направлены на диагностику тех изменений шеечного эпителия, которые вызваны высокоонкогенными типами ВПЧ. Исследования последних 20 лет привели к пониманию многих моментов биологии ВПЧ и сыграли большую роль в поиске и разработке новых методов диагностики.
В диагностике предраковых заболеваний и РШМ применяются различные методы: клинико-визуальный; расширенная вульвовагино- и кольпоскопия; цитологический; жидкостная цитология; молекулярно-генетические (генотипирование вируса, экспрессия вирусных онкобелков Е6, Е7); определение вирусной нагрузки Hybride Capture (Digene-тест); морфологическое исследование; иммуноцитохимическое и иммуногистохимическое исследование маркеров p16, Кi67; оптико-электронное сканирование ткани шейки матки (TruScreen); аноскопия (при помощи кольпоскопа).
Клинико-визуальный метод диагностики является одним из наиболее распространенных в диагностике заболеваний шейки матки, влагалиша и вульвы. С помощью рутинного осмотра шейки матки и влагалища с добавлением теста с 3–5% уксусной кислотой и раствором Люголя выявляются выраженные патологические изменения эпителия. Визуальный метод в сочетании с другими тестами в некоторых исследованиях показал чувствительность, эквивалентную цитологическому методу. Поэтому при отсутствии возможности сделать кольпоскопию при первичном осмотре следует оценить состояние слизистой оболочки эктоцервикса визуально с применением указанных проб. Атипически измененный эпителий можно увидеть и невооруженным глазом, как ацетобелое пятно после аппликации раствором уксусной кислоты или как йоднегативный участок после нанесения раствора Люголя, что, безусловно, является основанием для направления пациентки на кольпоскопическое исследование [5].
Если визуально после проб аномальные образования не определяются, можно ограничиться мазком на цитологию по Папаниколау, после отрицательных результатов которого женщина подлежит традиционному наблюдению. Следует подчеркнуть, что визуальный метод является альтернативой цитологии для развивающихся стран. Он дешевый, чувствительность и специфичность его составляют 69–94%/74–94%, может выполняться медицинской сестрой. В то же время данный метод имеет недостатки: возможность гипердиагностики, не надежен в менопаузе, не стандартизован.
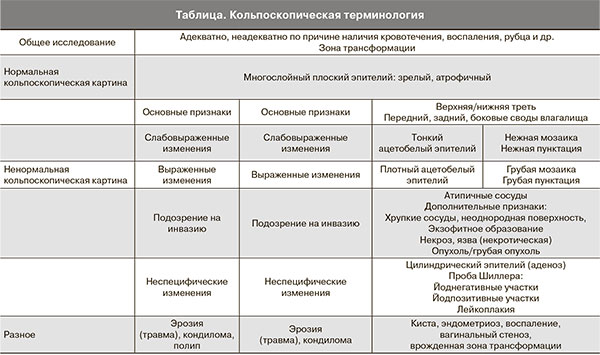
Кольпоскопия представляет собой высокоинформативный и недорогой метод ранней диагностики заболеваний шейки матки, влагалища и вульвы, без которого сегодня невозможно представить обследование женщины с гинекологической патологией. Наиболее популярной разновидностью его является расширенная кольпоскопия, включающая в себя осмотр и ревизию состояния слизистой оболочки шейки матки, влагалища и вульвы при увеличении с помощью микроскопа в 7–30 раз и применением некоторых эпителиальных тестов, при которых оценивается реакция тканей в ответ на их обработку различными медикаментозными средствами. Общепризнанной в настоящее время является международная терминология кольпоскопических терминов, принятая в 2011 г. на 14-м Всемирном конгрессе IFCPC в Рио-де-Жанейро (таблица).
Классификация отражает патологические изменения эпителия шейки матки в соответствии с современными знаниями, структуирована и удобна для практического применения. Одним из важнейших критериев информативности кольпоскопического исследования является возможность визуализации зоны стыка эпителиев (удовлетворительная/неудовлетворительная кольпоскопическая картина). В новой классификации зона трансформации делится на 3 типа по соотношению эктоцервикального и эндоцервикального компонентов.
Варианты ненормальной кольпоскопической картины включают ряд признаков, подозрительных в отношении интраэпителиальных неоплазий. Наиболее важным является ацетобелый эпителий (интенсивность побеления обычно коррелирует со степенью тяжести процесса). Пунктация и мозаика представляют собой проявления атипической васкуляризации эпителия.
Однако кольпоскопический метод исследования является малоспецифичным методом диагностики, в известной мере субъективным и требует квалифицированной подготовки специалистов. Поэтому в соответствии с международными стандартами он не отнесен к скрининговым методам исследования [6].
Молекулярно-биологические методы диагностики
Учитывая, что РШМ является ВПЧ-ассоциированным заболеванием, значительное место в диагностике ПВИ занимают молекулярно-биологические методы диагностики, направленные на обнаружение мельчайших частиц ДНК вируса папилломы в материале. Методы обнаружения ВПЧ основаны на способности ДНК к гибридизации. Использовавшийся ранее метод классической полимеразно-цепной реакции (ПЦР) позволял определить только факт наличия ВПЧ, нередко давал ложноположительные результаты [7]. Перспективным для изучения различных генов ВПЧ, участвующих в злокачественной трансформации, является метод ПЦР в режиме реального времени. Метод ПЦР в режиме реального времени позволяет определить типы ВПЧ и количество ДНК клинически значимых типов ВПЧ в образце, что крайне важно при длительной персистенции вируса.
Прогностическая значимость ВПЧ-теста возрастает: в первичном скрининге у женщин старше 30 лет в сочетании с цитологическим исследованием; для разрешения сомнительных результатов цитологического исследования (ASCUS); для мониторинга терапии цервикальных поражений высокой степени (цервикальная интраэпителиальная неоплазия (CIN 2)); при длительной персистенции ВПЧ высокоонкогенных типов.
В настоящее время в ряде стран внедрен метод, позволяющий определить вирусную нагрузку ВПЧ Digene-тест. Digene-тест основан на методе «гибридного захвата» и применяется для выявления ВПЧ, ассоциированных с неоплазией шейки матки (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68). Digene-тест позволяет выявить клинически значимое количество вируса, имеет высокую чувствительность, прогностическую ценность, однако не позволяет дифференцировать тип ВПЧ и достаточно дорог.
В процессе развития предраковых состояний происходят генетические и эпигенетические изменения, такие как интеграция вирусного генома в геном клетки-хозяина, из-за этого регуляция экспрессии вирусных генов Е6 и Е7 нарушается. Поскольку гены Е6 и Е7 принимают непосредственное участие в процессе развития злокачественных изменений в клетках, возможно использование мРНК Е6 и Е7 в качестве более точных маркеров, чем вирусная ДНК [8].
Это может позволить различить инфекции, протекающие бессимптомно, и инфекции, представляющие опасность для здоровья.
В настоящее время существует три коммерчески доступных теста для определения мРНК Е6/Е7 ВПЧ. Они применяются в большинстве проводимых исследований. PreTect HPV-Proofer (NorChip) и NucliSENS EasyQ HPV (bioMerieux) основаны на одних и тех же технологиях, но выпускаются в разных странах и под разными названиями. Они позволяют определять экспрессию мРНК Е6/Е7 пяти наиболее распространенных типов ВПЧ высокого риска (16, 18, 31, 33, 45). Третья тест-система – APTIMA HPV Assay (Gen-Probe) определяет экспрессию мРНК 14 онкогенных типов ВПЧ, зарегистрирована и рекомендована FDA к использованию для мазков типа ASCUS по результатам цитологического теста.
Цитологический скрининг признан классическим методом и рекомендован ВОЗ для проведения в масштабах национальных программ. Чувствительность цитологического метода исследования, по данным разных авторов, составляет 66–83%, специфичность – 60–85%. Подсчитано, что скрининг женщин в возрасте 25–64 лет с интервалом в 5 лет может привести к снижению смертности от РШМ на 84% [19].
Информативность цитологического метода определяется уровнем подготовки специалистов, а также качеством забора материала для цитологического исследования, так как неправильный забор материала повышает частоту ложноотрицательных результатов. Полноценное взятие мазка с использованием специальных инструментов (цитобраши, цервикс-браши) позволило значительно повысить информативность цитологического метода. Мазок для цитологического исследования следует брать с поверхности экзоцервикса, влагалища и вульвы с помощью шпателя, из эндоцервикса – с помощью щетки-эндобраша. Наносят материал тонким слоем на специально обработанное обезжиренное стекло. Допустимо два образца (с экзоцервикса и эндоцервикса) наносить на одно стекло. Важно помнить, что для получения адекватного результата мазок немедленно должен быть обработан специальным составом во избежание высыхания клеток, поскольку их структура может необратимо деформироваться, и трактовка такого материала будет неправильной.
В 1988 году Национальным институтом по изучению рака США предложена новая цитологическая система оценки теста Папаниколау – система Бетесда (TBS-Terminology Bethesda System). Цитологическая классификация Бетесда основана при термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. Клиническое значение имеют три вида препаратов:
- нормальные мазки, без цитологических изменений, клетки, негативные в отношении интраэпителиального поражения или злокачественности (NILM – Negative for intraepithelial lesion or malignancy);
- «непонятные» мазки, не позволяющие исследователю точно ответить на вопрос о характере поражения, но в то же время не являющиеся нормой (ASC-US – Atypical squamous cells of undetermined significance, плоскоклеточная атипия неопределенной значимости);
- предраки (SIL – Squamous Intraepitelial Lesions, плосколеточные интраэпителиальные поражения) низкой (LSIL- Low-Grade Squamous Intraepitelial Lesions) и высокой (HSIL – High-Grade Squamous Intraepitelial Lesions) степени выраженности [1, 9].
Еще более качественные препараты с использованием взятого цитологического материала можно получить при применении жидкостной цитологии, анализ которой можно эффективно проводить с помощью компьютера. Собранные с помощью цервикальной щетки клетки помещаются в жидкую консервированную среду. В лаборатории тонкий слой суспензии помещается на стекло для изучения. Оставшийся образец сохраняется для проведения тестирования на ВПЧ. Данные свидетельствуют, что методика жидкостной цитологии уменьшает число ложноотрицательных результатов по сравнению с Рар-тестом и повышает выявляемость цервикального рака. Очевидно, что использование жидкостной цитологии также уменьшит число неудовлетворительных мазков и затраты времени для получения образцов. Однако данный метод является дорогостоящим для многих лечебных учреждений и недоступным для большинства сельских больниц [1].
Гистологический метод диагностики мог бы служить «золотым стандартом» диагностики предраковых заболеваний шейки матки, влагалища и вульвы, однако высокая стоимость, невозможность использовать многократно, не всегда точный прицельный забор материала ограничивают его использование.
К проведению биопсии шейки матки имеются определенные показания, однако практика свидетельствует о том, что лучше произвести биопсию с последующим гистологическим исследованием, чем недооценить серьезность процесса и поздно провести эту процедуру. Гистологический метод также нельзя считать скрининговым, он используется в клинической практике только на этапе окончательной постановки диагноза.
Новым в диагностике предраковых заболевании шейки матки и РШМ является определение маркеров пролиферации Р16ink4a и Ki67, то есть иммуноцитохимическое исследование и иммуногистохимическое исследование полученного материала. У женщин с CIN отмечено достоверное повышение экспрессии Р16ink4a и Ki67.
Р16ink4a – клеточный протеин, участвующий в регуляции клеточного цикла. В нормальных эпителиальных клетках шейки матки протеин Р16ink4a экспрессируется в очень малом количестве и иммуногистохимическими методами не выявляется. Нарушение регуляции Р16ink4a, вероятно, связано с угнетением функции белка – супрессора опухолевого роста pRb в результате формирования инактивирующих комплексов с онкопротеином Е/7 (E/7/pRb). Поэтому Р16ink4a может рассматриваться как непрямой маркер активной онкогенной экспрессии ВПЧ высокого онкологического риска. В таких клетках избыточная экспрессия p16INK4a легко выявляется посредством иммунохимического окрашивания.
Ki67 является показателем пролиферативной активности опухолевой ткани, коррелирует с гистологической степенью дифференцировки опухоли, определяет ее злокачественный потенциал. Используется в качестве прогностического фактора при оценке течения предрака и РШМ, его гиперэкспрессия связана с их неблагоприятным течением [9, 10].
Таким образом, определение Р16ink4a и Ki67 позволяет выявить участки, подозрительные на наличие неопластических изменений в визуально не измененном эпителии, помогает отличить диспластически измененные клетки от дистрофических и атрофических.
Оптико-электронное сканирование (TruScreen) позволяет идентифицировать наличие предраковых процессов тканей шейки матки в режиме реального времени при обычном гинекологическом обследовании. Наконечник зонда содержит электроды для измерения сопротивления ткани и источники света для измерения оптических свойств ткани.
Нельзя не сказать и о том, что в отдаленных районах ряда регионов нашей страны цитологических лабораторий нет. Поэтому для скринингового обследования женщин требуются такие методы, которые являются неинвазивными, позволяющими получить результат в режиме реального времени. Этим требованиям соответствует диагностический сканер TruScreen, зарегистрированный в нашей стране. Преимущество метода – моментальный результат при высокой чувствительности и специфичности (80–90%) [16, 17]. В НЦАГиП им. В.И. Кулакова было проведено исследование, в которое включили 56 пациенток в возрасте от 19 до 48 лет с диагностированной патологией шейки матки. Оптико-электронная технология продемонстрировала сопоставимую чувствительность с цитологическим (L-SIL – 65,3%, H-SIL – 86,7%), гистологическим (СIN 1 – 64,7%, СIN 2 – 78,9%, СIN 3 – 88,9%) и кольпоскопическим методами в диагностике как цервикальных интраэпителиальных поражений в целом, так и поражений высокой степени тяжести.
Аноскопия (с использованием кольпоскопа) у пациенток с тяжелыми интраэпителиальными неоплазиями позволяет визуализировать анальную зону трансформации и выявлять участки поражения. В настоящее время распространенность анальной интраэпителиальной неоплазии в популяции женщин с патологией шейки матки, в том числе с генитальными неоплазиями, длительной персистенцией высокоонкогенных типов ВПЧ не изучена и представляет большой интерес [20].
Современные методы лечения патологии шейки матки делятся на медикаментозные и деструктивные. Используемые хирургические методы лечения патологии шейки матки в амбулаторной практике делятся на аблативные и эксцизионные. Аблативные (патологическая ткань во время операции разрушается): диатермокоагуляция, криодеструкция и лазерная вапоризация. Обязательными условиями для выполнения аблативных методов лечения патологии шейки матки являются: четкая визуализация переходной зоны; отсутствие расхождения между гистологическим (биопсия), цитологическим диагнозом и кольпоскопической картиной поражения; отсутствие поражения в цервикальном канале (цитология, соскоб); исключен РШМ.
Аблация является щадящим методом лечения с низким процентом осложнений последующей беременности, обладает рядом преимуществ. В нашей стране широко применяется метод аргоноплазменной аблации прибором «Фотек ЕА141». Достоинства метода: отсутствие послеоперационных стенозов, фиксированная глубина коагуляции, четкая визуализация операционного поля.
Эксцизионные – патологический участок удаляют в пределах здоровых тканей и он может быть исследован гистологически. Наиболее широко используется петлевая электроэксцизия шейки матки – иссечение ткани тонкой проволочной петлей различной формы. В США процедура называется LEEP (Loop electrosurgical excision procedure), в Европе — LLETZ (Large loop excision of Transformation zone). Метод используют как для диагностики, так и для лечения CIN. В настоящее время в арсенале практикующего врача имеются различные методы диагностики, позволяющие выявить изменения эпителия шейки матки на ранних этапах, определить их характер и прогнозировать течение процесса. Современные методы лечения должны применяться дифференцированно в зависимости от каждой конкретной ситуации. Мониторинг диагностики и лечения является залогом успеха ведения больных с патологией шейки матки.
В нашей стране широко применяется иммуномодулирующая терапия, обоснованием для использования которой является доказанное участие иммунных механизмов в развитии ВПЧ-инфекции, проявляющееся вторичным иммунодефицитом. Иммуномодулирующее лечение подавляет репликацию вируса, усиливает защитные механизмы иммунной системы, особенно у пациенток с ее нарушениями. Иммуномодулирующие и неспецифические противовирусные препараты (имихимод, изопринозин, гроприносин, панавир, галавит, виферон) и другие применяются в терапии ВПЧ-ассоциированных заболеваний шейки матки, влагалища и вульвы. На сегодняшний день существует целый ряд исследований, доказывающих положительные результаты использования оригинального российского препарата панавир при ряде вирусных инфекций, в частности папилломавирусной и герпетической [7, 19]. На первом этапе лечения больные по поводу цервикальной интраэпителиальной неоплазии и РШМ по показаниям подвергались деструктивным методам лечения (электрокоагуляция, криодеструкция, лазеровапоризация, электроконизация). На втором этапе проводилось противовирусное лечение, так как персистенция вируса является ключевым фактором для возникновения рецидива заболевания [11, 13, 15]. Применение Панавира в комбинированных схемах лечения показало высокую эффективность, составляющую от 78,6 до 92,3% [12, 14].
Индинол Форто (в марте 2013 года получено регистрационное удостоверение лекарственного препарата для медицинского применения) вызывает апоптоз вирусинфицированных клеток, элиминирует ВПЧ из организма, блокирует переход вирусинфицированных клеток в злокачественные, повышает эффективность терапии в 2 раза и снижает число рецидивов в 4 раза.
Имихимод является модификатором иммунного ответа, стимулирует врожденный и клеточный иммунный ответ, необходимый для элиминации поражений, уничтожает инфицированные клетки, обеспечивает иммунную память в отношении ВПЧ, снижает число рецидивов и вирусную нагрузку. Имидазохинолоны являются первыми известными лекарственными веществами, активирующими toll-подобные рецепторы 7, относящиеся к семейству рецепторов, которые играют ключевую роль в регуляции иммунного ответа. Для лечения аногенитальных кондилом применяется имихимод местно (5% крем). Эффективность терапии составляет 82–91%.
Вакцинация – первичная профилактика ПВИ и РШМ. Доказательство того, что РШМ является последствием ВПЧ-инфекции, поставило его в ряд заболеваний, потенциально предотвратимых с помощью вакцинации. Результаты исследования двух вакцин (квадривалентной и бивалентной) в больших рандомизированных плацебо-контролируемых, двойных слепых исследованиях с участием девушек-подростков и молодых женщин продемонстрировали хорошие результаты. В частности, комбинированный анализ результатов исследования и последующего 5-летнего наблюдения показал:
- 100% эффективность в отношении цервикальной инфекции, персистирующей на протяжении как минимум 12 месяцев (бивалентная вакцина);
- 100% защита от развития СIN 2/3, рака in situ, интраэпителиальной неоплазии вульвы (VIN 2/3) и влагалища (VaIN 2/3) (квадривалентная вакцина) – срок наблюдения более 5 лет.
Максимальная выраженность иммунного ответа отмечена сразу по завершении курса вакцинации. Основываясь на результатах проведенных клинических исследований, в мире широко используются квадривалентная вакцина против ВПЧ 6, 11, 16, 18-го типов, содержащая адьювант алюминия гидроксифосфат-сульфат аморфный (гардасил®, MSD), и бивалентная вакцина против ВПЧ 16, 18-го типа, содержащая адъювант AS04 (Церварикс, GSK) [3]. В России эти вакцины зарегистрированы и одобрены для применения в 2006–2007 гг. Полученные и накапливаемые в настоящее время данные позволяют рассматривать вакцинацию как вполне реальный путь борьбы с РШМ. Первые результаты ВПЧ-вакцинации оценены в странах, где применялась четырехвалентая вакцина, было показано снижение частоты аногенитальных кондилом в популяции – до 60%. По итогам первых 3 лет (2007–2099 гг.) национальной программы вакцинации против ВПЧ в Австралии отмечено снижение частоты дисплазии шейки матки на 38% в популяции девушек до 18 лет [18]. В России на сегодняшний день существует 20 региональных программ по вакцинопрофилактике РШМ [21]. Более подробные данные о вакцинах и их использовании изложены в руководстве для врачей по профилактике РШМ [1]. Таким образом, внедрение новых скрининговых технологий и вакцинации открывает новые возможности для профилактики РШМ, что является основой для снижения заболеваний в целом и открывает новые перспективы в сохранении здоровья женщин.