При доношенной беременности в современном акушерстве хориоамнионит (ХА) принято подразделять на две категории по следующим признакам: гистологический и клинический [1]. Гистологический ХА базируется на выявлении воспалительной инфильтрации плодных оболочек нейтрофилами, макрофагами и Т-лимфоцитами в отсутствие клинических признаков заболевания. Диагноз гистологического ХА выставляется в 20-34% доношенных беременностей [2]; при этом какие-либо клинические проявления воспалительного процесса отсутствуют.
Клинический ХА основан на манифестации локального и системного воспаления: повышение температуры тела, гнойные выделения, тахикардия, лейкоцитоз, повышение С-реактивного белка. Хотя физиологические механизмы, участвующие в ини-циации родов, остаются неясными, доказано, что преобладание провоспалительного звена иммунной системы играет ключевую роль в развязывании родовой деятельности как при доношенной, так и недоношенной беременности [3-6]. Известно, что в процессах созревания шейки матки и в начале родов участвует локальное привлечение макрофагов и Т-лимфоцитов в децидуальную ткань, увеличение продукции провоспалительных цитокинов (фактор некроза опухоли (ФНО), интерлейкин (ИЛ)-1, ИЛ-6, ИЛ-8) и простагландинов [1, 7-9].
Этиологическими факторами развития ХА принято считать бактериальное и вирусное поражение, а участниками патогенетической реализации ХА являются все вышеперечисленные медиаторы и клетки иммунной системы. Однако в последнее время взгляд на патогенез ХА несколько изменился. Ряд авторов утверждают, что гистологический ХА является отражением закономерного физиологического процесса родов, особенно когда клинических данных за инфекцию нет [1, 3, 8, 10]. В пользу этого исследования свидетельствует более частое выявление гистологического ХА в плацентах у пациенток со схватками, по сравнению с плацентами после планового кесарева сечения [11]. По мнению других авторов, гистологический ХА - это воспалительный процесс инфекционной этиологии, но на момент родов процесс был локализован и клинические проявления ХА отсутствовали [12].
Пока невозможно определить, что первично: гистологические изменения воспалительного характера являются причиной начала родов или приобретаются в процессе родов. Сейчас накоплены данные, что гистологические признаки воспаления в плаценте в родах возникают и в отсутствие какого-либо инфекционного агента, так называемое асептическое воспаление [1]. И действительно, из 34% гистологического ХА от всех доношенных родов только 4% имеют установленный инфекционный фактор [9].
Таким образом, в целом 96% случаев гистоло-гического ХА не сопровождались клиническими проявлениями инфекции и не имели негативных последствий для здоровья новорожденного и матери. Любой воспалительный процесс сопровождается реакцией со стороны иммунной системы; происходит миграция иммунокомпетентных клеток в очаг воспаления; повышается выработка хемокинов, провоспалительных цитокинов, меняется профиль Т-хелперов в очаге воспаления. То же самое наблю-дается при физиологических родах.
Оценка изменений в иммунологическом окружении, а в особенности Т-хелперов, при развитии гистологического ХА в различных тканях фето- плацентарного комплекса является интересным перспективным направлением. Ведущую роль в дифференцировке Т-хелперов (Th1, Th2, Th17, Treg) с последующей выработкой характерных для них цитокинов играют транскрипционные факторы (ТФ). В их функции входит дифференцировка клеток с экспрессией определенных генов, стабилизация паттернов экспрессированных и доступных для индукции генов [12].
ТФ для Th2 является GATA3, для Th17 - RORC2, Treg - FOXP3. В современной литературе мало данных об особенностях экспрессии этих ТФ при доношенной физиологически протекающей беременности и взаимодействии их между собой; однако баланс Treg/Th2, Th 17-типов является одним из важных моментов как при физиологически протекающей беременности, так и при ее осложнениях [13-17].
Treg контролируют Th1-, Th2-, ТЫ7-типы эффек-торного иммунного ответа на собственные антигены и патогены посредством FOXP3-зависимых супрес-сорных программ (forkhead box protein 3, FOXP3). Клетки-продуценты FOXP3 выявлены в децидуальной оболочке, и доказана их значимая роль в поддержании беременности и обеспечении толерантности между матерью и плодом [6, 15]. Бесплодие, выкидыши и преэклампсия часто связаны с дефицитом количества и функции Treg, в то время как нормальная беременность избирательно стимулирует накопление материнской FOXP3 CD4(+) Treg- клеток с фетальной специфичностью [6].
Клетки Th2 определяются другим ТФ - GATA3 (GATA binding protein 3), осуществляющем защиту от антигенов гельминтов и белковых антигенов, а также ответственным за аллергические реакции [10]. В исследованиях [18] было показано, что GATA3 связан с началом родов, активируя каскад выработки цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, циклооксигеназа (СОХ)-2, ФНО, матриксная металлопротеиназа (ММП)-9). Продемонстрировано, что при преждевременном разрыве плодных оболочек при недоношенной беременности, наоборот, наблюдалось подавление GATA3 [4, 19].
В настоящее время признано, что клетки Th17 составляют третье эффекторное плечо Th-клеток, дополняя клоны Th1 и Th2. RORC2 является основным ТФ, который может управлять дифференцировкой клеток Th17; кроме того, программирование человеческих ТЬ17-клеток с помощью RORC2 приводит к частичной устойчивости этих Т-клеток к супрессии под действием Treg.
В литературе описана роль ТФ (GATA3, RORC2, FOXP3) в реализации хронических воспалительных процессов [12, 15, 16], отторжении аллотрансплантата плода, преждевременных родах и преэклампсии [20].
Клиническая значимость и прогностическая цен-ность гистологического ХА в прогнозе реализации септических осложнений точно пока неизвестна [11], так же, как и не определена роль ТФ, отвечающих за дифференцировку Т-клеток, как при гистологическом ХА, так и в его отсутствие.
Цель исследования: оценить уровень экспрессии мРНК генов трансформирующих факторов (GATA3, RORC2, FOXP3) в цервикальном канале, плаценте и плодных оболочках при доношенной беременности в зависимости от наличия гистологических признаков ХА.
Материалы и методы
Исследование выполнено на базе родильных отделений ГБУЗ ГКБ № 1 им. Н.И. Пирогова г. Самары, в которое были включены 42 беременных в сроке гестации 37-41 неделя низкой группы риска акушерских осложнений. Все пациентки были родоразрешены путем операции кесарева сечения в плановом порядке, показаниями к которой являлись неправильное положение и предлежание плода и/или наличие рубца на матке после операции кесарева сечения.
Критерии исключения: 1) беременность, отно-сящаяся к группе высокого риска по соматической патологии (сахарный диабет, гестационный диабет), особенностям плацентации и акушерским осложнениям (преэклампсия, синдром задержки развития плода); 2) наличие острых и обострения хронических воспалительных заболеваний, в том числе наличие кольпита на момент исследования; 3) применение антибактериальной терапии во время беременности.
Всем пациенткам было выполнено исследование мазка цервикального канала и образца плаценты и плодных оболочек методом обратной транскрипции и полимеразной цепной реакции с детекцией результатов в режиме реального времени (ОТ-ПЦР) на базе лаборатории молекулярногенетических методов лаборатории ООО «ДНК- технология» согласно инструкциям производителя («ДНК-Технология», Россия) с использованием набора реагентов «Проба НК» с дополнительной фенольной депротеинизацией. Проводилось определение уровня экспрессии мРНК генов GATA-3, RORC2, FOXP3, а также экспрессия мРНК В2М, который относится к генам «домашнего хозяйства» (housekeeping gen) и использован для нормирования полученных показателей. Забор образца эпителия цервикального канала выполнялся непосредственно перед родоразрешением с помощью цитощетки в зеркалах, которая вводилась в цервикальный канал на глубину 1,0-1,5 см, и аккуратными вращательными движениями производился соскоб эпителиальных клеток цервикального канала. Забор образца плаценты и плодных оболочек проводился в стерильных условиях во время операции кесарева сечения в пределах операционного поля. Забор плаценты выполняли посередине расстояния от места прикрепления пуповины до наиболее отдаленной точки края плаценты с помощью конхотома с диаметром рабочей поверхности 9,4 мм; отсекался стандартный образец ткани плаценты с захватом участка из глубины плаценты (с предварительным отсечением амниона, хорионической пластинки и децидуальной ткани с материнской стороны). Забор плодных оболочек выполнялся посередине между плацентой и внутренним зевом с помощью стерильного конхотома с диаметром рабочей поверхности 9,4 мм; отсекался стандартный образец плодных оболочек. Полученные образцы помещались в «эппендорфы» с транспортной средой («ПробаНК» производства ООО «НПО ДНК-Технология»).
Для патоморфологического исследования плаценты и плодных оболочек брали 6 кусочков: пуповину в плодной и материнской части, плодные оболочки плаценты - края разрыва в виде ленты, скрученные в виде роллов, второй ролл, вырезанный у края плацентарного диска, фрагмент деци-дуальной пластины с ворсинами и фрагмент хори-альной пластины с ворсинами. Полученные образцы фиксировались в 10% нейтральном формалине на фосфатном буфере, обрабатывались в аппарате гистологической проводки тканей фирмы «Leica ST 4040» (Германия) и заливались в парафин, затем после подготовки срезов по стандартной методике их окрашивали гематоксилином и эозином, заключали синтетической монтирующей средой «Витрогель». Согласно классификации Amsterdam Placenta Workshop Group [21], все изменения плаценты объединены в три группы: сосудистые нарушения, воспалительные и так называемые другие. На гистологических препаратах оценивали степень зрелости ворсинчатого дерева и соответствие его сроку гестации, ширину межворсинчатого пространства, наличие и характер патологических изменений. Полуколичественно оценивали выраженность компенсаторно-приспособительных (синцитиальные узелки, синцитио-капиллярные мембраны) и инволютивно-дистрофических процессов (отложения периворсинчатого фибриноида, солей кальция), а также степень отека ворсин. Также проводили качественную сравнительную оценку содержания клеток синцитиотрофобласта (фибробластов, фиброцитов), клеток цитотрофобласта, децидуальных клеток, сосудистого компонента и признаков воспаления. Среди воспалительных изменений выделялись изменения со стороны матери (острый ХА) или со стороны плода (флебит, фунизит), поражения ворсин плаценты и межворсинчатого пространства — виллиты и интервилли- ты), а также децидуальной пластинки, граничащей с полостью матки, — децидуит.
Обработка результатов осуществлялась с помощью программы MS Excel на основании данных, полученных с помощью прибора. Использован метод сравнения индикаторных циклов (метод AACq). Уровень экспрессии мРНК генов измерялся в относительных единицах (10-3 ОЕ), отражающих представленность транскрипта относительно нор-мировочного фактора, рассчитанного на основе уровня экспрессии мРНК референсного гена (В2М).
Статистический анализ
Обработку результатов исследования проводили с помощью программы Statistica 10.0, SPSS 13. Для описания количественных данных использована медиана (Ме), а в качестве интервальной оценки — верхний (Q1) и нижний (Q3) квартили, так как исследуемые выборки не подчиняются закону нормального распределения (несоответствие нормальному распределению определено методом Шапиро-Уилка). Сравнение в двух группах выпол-нялось с помощью критерия Манна-Уитни, более двух групп - критерия Краскелла-Уолиса, затем попарное сравнение с помощью критерия Манна- Уитни. Статистически значимыми считали различия при p<0,05; при сравнении более двух групп для количественных переменных использовалась поправка Бонферрони, где для трех групп критический уровень значимости составлял р=0,017.
Все женщины дали письменное согласие, и исследование было одобрено комитетом по биоэтике СамГМУ (протокол № 207 от 20 мая 2020 г.). Гестационный возраст рассчитывали по данным ультразвукового исследования или по первому дню последней менструации.
Результаты
Медиана возраста обследованных женщин соста-вила 28 лет (28;34), срок беременности - 39,1 (39;39,4) недели. В среднем на одну пациентку приходилось 2,0 (1,0;3,0) беременностей, число первородящих - 14/42 (33,33%). У беременных отсутствовала тяжелая соматическая патология, хронические и острые воспалительные заболевания. Все пациентки были родоразрешены путем операции кесарева сечения; послеоперационный период протекал без особенностей; у новорожденных также осложнений в раннем неонатальном периоде не было.
Все последы были подвергнуты патологоанатоми-ческому исследованию. У всех пациенток клинические данные за какую-либо акушерскую патологию и инфекцию отсутствовали (это было критериями исключения), но в ряде случаев патологоанатомиче-ское исследование плаценты продемонстрировало признаки воспалительного процесса и хронической плацентарной недостаточности. Так, соответствие плаценты сроку гестации наблюдалось только в 13/42 случаях (30,9%); гипоплазия плаценты выявлена в 5/42 случаях (11,9%); патологическая незрелость ворсин - в 29/42 случаев (69%); диссоциированное развитие ворсин - в 2/42 (4,7%); нарушение ветвления ворсин - в 8/42 (19,0%); стеноз опорных ворсин - в 6/42 (14,2%); инволютивно-дистрофические нарушения - в 33/42 (78,5%); неадекватные компенсаторные реакции - в 3/42 (7,1%); признаки инфицирования последа и плодных оболочек - в 28/42 (66,7%), флебит и фуникулит - в 3/42 (7,1%), плацентарный ХА - в 3/42 (7,1%), париетальный ХА - в 27/42 (64,3%), базальный дециду- ит - в 20/42 (47,6%), лейкоцитарная инфильтрация плодных оболочек - в 11/42 (26,1%), лимфоцитарная инфильтрация - в 15/42 (35,7%), хроническая плацентарная недостаточность - в 35/42 (83,3%).
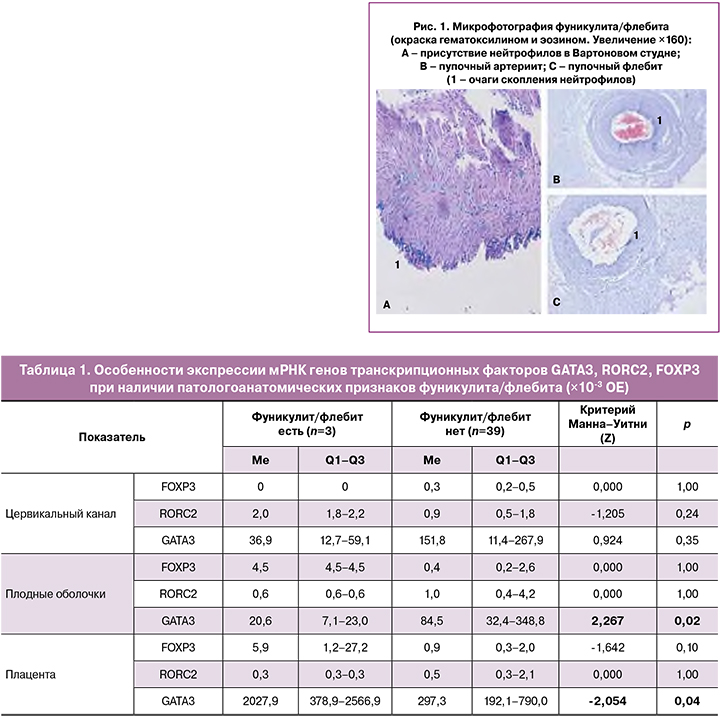
Воспалительные изменения плаценты и плодных оболочек делятся на острые (представленные в виде лейкоцитарной инфильтрации, вызываемые, как правило, бактериями) и хронические изменения (представленные в виде лимфоцитарной инфильтрации, причинами которой могут служить вирусные инфекции, аутоиммунные процессы). В развитии острого ХА выделяют три стадии: стадия 1 - начальная реакция, локализующаяся в области субхориального фибрина и внутренних хорио-деци- дуальных мембран (субхорионит, хорионит); стадия 2 - поражение соединительной ткани между хорионом и амнионом (ХА); стадия 3 - некроз амниотического эпителия (некротический ХА). Согласно Амстердамским критериям, для оценки воспалительной реакции следует использовать только стадии 2 и 3, представляющие собой гистологически развитый ХА. В нашем исследовании за гистологический ХА мы принимали 2-ю стадию; пациенток с признаками 3-й стадии в нашем исследовании выявлено не было. Со стороны плода в воспалительном ответе также выделяют 3 стадии: стадия 1 — острый хорионический васкулит/ пупочный флебит/хорионический васкулит): ней-трофилы идентифицируются в стенке любого сосуда хориона или в пупочной вене (незначительное количество нейтрофилов обычно присутствует в желе Уортона, но без агрегатов или концентрических полос воспалительных инфильтратов); стадия 2 (пупочный артериит): нейтрофилы видны в одной, или в обеих пупочных артериях, и/или в пупочной вене; стадия 3 (некротический фунизит): присутствие нейтрофилов, клеточного мусора и/ или минерализации в концентрических полосах, кольцо или ореол нейтрофилов вокруг одного или нескольких пупочных сосудов (рис. 1) [22].
Анализ связей экспрессии мРНК генов GATA3, RORC2, FOXP3 и патологоанатомических особен-ностей последа показал следующее: нами не было выявлено корреляционных связей между массой плаценты и особенностями экспрессии мРНК ТФ (GATA3, RORC2, FOXP3).
При выявлении гистологических признаков фуникулита/флебита все значимые различия касались экспрессии генов мРНК GATA3 (табл. 1): при фуникулите/флебите отмечалось повышение экспрессии в плаценте (2027,9x10-3 (378,9 х10-3;2566,9х10-3) ОЕ и 297,3x10-3 (192,1х10-3;790,0х10-3) ОЕ (р=0,04)) и снижение в плодных оболочках (20,6х10-3 (7,1х10-3;23,0х10-3) ОЕ и 84,5х10-3 (32,4х10-3; 348,8х10-3) ОЕ (р=0,02)).
При наличии париетального ХА наблюдается конкордантное повышение уровня экспрессии RORC2 и FOXP3 в плаценте: 0,7х10-3 (0,5х10-3; 3,0х10-3) ОЕ и 1,4х10-3 (0,9х10-3;2,9х10-3) ОЕ, в сравнении с плацентами без признаков ХА: 0,3х10-3 (0,1х10-3;1,4х10-3) ОЕ и 0,6х10-3 (0,3х10-3; 1,2х10-3) ОЕ (р=0,04 и р=0,02) соответственно (табл. 2). Экспрессия мРНК гена GATA3 не зависела от наличия париетального ХА и во всех локусах сохранялась высокой.
Ниже представлена морфологическая картина лимфоцитарной инфильтрации плодных оболочек (рис. 2) и лейкоцитарной инфильтрации (рис. 3).
В зависимости от преобладания лейкоцитарной либо лимфоцитарной инфильтрации пациентки были подразделены на 3 подгруппы, в рамках которых выполнялось сравнение экспрессии мРНК генов транскрипционных факторов (табл. 3).
Экспрессия GATA3 в цервикальном канале сни-жалась как при лейкоцитарной, так и при лимфоци-тарной инфильтрации плодных оболочек (табл. 3); однако с учетом выполнения сравнения в трех группах значимые различия были достигнуты только для наличия лейкоцитарной инфильтрации — 31,7x10-3 ОЕ (3,6х10-3;217,6х10-3) в сравнении с плодными оболочками без признаков инфильтрации — 307,8x10-3 ОЕ (56,3x10-3;1000,0x10-3; р=0,01); для лимфоцитарной инфильтрации эти различия находились на грани значимых (р=0,02). Экспрессия мРНК RORC2, FOXP3 во всех локусах, а также экспрессия мРНК GATA3 в плодных оболочках и в плаценте значимо не менялись при наличии гистологических признаков инфильтрации плодных оболочек.
Обсуждение
Несмотря на большое количество исследований роли воспалительных биомаркеров в реализации родовой деятельности, окончательно ее механизм и место каждого из участников иммунного процесса еще не определены. Конкордантное увеличение провоспалительных маркеров во всех тканях фето- плацентарного комплекса в родах свидетельствует об их гармоничной работе в инициации родовой деятельности [4, 20 ,23]. В запуске любого воспа-лительного процесса, в том числе и ХА, важную патогенетическую роль играют провоспалительные цитокины. Гистологический ХА, по сути, является неоднородным состоянием, имеющим разные гистологические особенности, связанные с гестационным возрастом на момент родов, наличием спонтанных родов, участием бактериальных и вирусных агентов. В большинстве случаев нет связи между гистологическим диагнозом ХА и клиническими проявлениями ХА [1, 8, 11, 24].
Согласно данным литературы [25], гистологический ХА при доношенной беременности чаще ограничен децидуальной оболочкой и хорионической пластиной. Гистологические признаки воспаления плодных оболочек, имеющие материнское происхождение, встречаются в 20—34% доношенных беременностей [7, 24]. При преждевременных родах процесс чаще ассоциирован с фунизитом, для которого характерно повышение вероятности нео-натального сепсиса и других долгосрочных ослож-нений, например, церебрального паралича [1, 24, 25]. Однако в ряде исследований изменения, характерные для гистологического ХА, ассоциированы с недоеданием матери и воздействием химикатов, нарушающих работу эндокринной системы (соеди-нения, которые могут присутствовать в пестицидах, пластиковых пищевых контейнерах и др.) [7, 25]. В нашем исследовании гистологические признаки инфицирования последа и плодных оболочек наблюдались в 28/42 (66,7%) случаев, флебит и фуникулит — в 3/42 (7,1%), плацентарный ХА — в 3/42 (7,1%), париетальный ХА - в 27/42 (64,3%), базальный децидуит — в 20/42 (47,6%), лейкоцитарная инфильтрация плодных оболочек - в 11/42 (26,1%), лимфоцитарная инфильтрация - в 15/42 (35,7%) при отсутствии клинических признаков воспаления. Таким образом, у 2/3 пациенток при доношенной беременности незадолго до родов имеются какие-либо гистологические признаки воспаления плаценты и плодных оболочек, но они играют низкую прогностическую роль для матери и плода в аспекте риска реализации клинической инфекции при доношенной беременности, что подтверждают результаты работ других авторов [8, 25]. Считается, что в прогностическом плане для плода наиболее неблагоприятно выявление фуни- зита/фуникулита [24] - таких случаев в нашем исследовании было 3/42 (7,1%); однако каких-либо патологических изменений со стороны новорожденных впоследствии не наблюдалось. В литературе также представлены данные, что в норме у каждой третьей пациентки наблюдаются признаки фуникулита/флебита [3]. Наличие воспалительных изменений плодных оболочек без клинического ХА достигает 20-34% [3, 8, 25], однако в нашем исследовании воспалительные изменения плодных оболочек установлены в 27/42 (64,3%) случаев. Возможно, отсутствие клинических проявлений ХА и его осложнений для матери и плода говорит о том, что процесс был либо идентифицирован на ранней доклинической стадии, либо формирование процесса воспаления присуще самому акту родов [3].
В данном аспекте интересно поведение иммунных клеток и их ТФ в качестве патогенетических и прогностических маркеров воспалительного процесса при доношенной беременности и гистологических признаках ХА.
GATA3 представляет собой ТФ, ответственный за дифференцировку Th2, роль которых заключается в выработке противовоспалительных цитокинов (ИЛ-4, ИЛ-10), формировании аллергических реакций, антигельминтной защите, пролиферации и регенерации клеток. Прогрессирование и поддержание беременности основано на переключении особенностей иммунного ответа с Th1 на Th2 [13], т.е. с провоспалительного каскада на противовоспалительный и обратно с наступлением родов. Согласно данным литературы, наличие воспалительных изменений репродуктивного тракта коррелирует со снижением GATA3 [13, 17, 26, 27]. Так, в работах О.В. Бурменской и соавт. [17], О.В. Будиловской и соавт. [26] было установлено, что при наличии локального воспалительного компонента во влагалище наблюдалось значимое снижение уровня экспрессии GATA3. В работах Н.Ю. Катковой выявлено также уменьшение уровня экспрессии GATA3 в цервикальном канале при преждевременных родах в сочетании с преждевре-менным разрывом плодных оболочек [26]. В нашем исследовании при лейкоцитарной инфильтрации плодных оболочек выявлено снижение экспрессии мРНК GATA3 в цервикальном канале в 10 раз по сравнению с неизмененными оболочками. Можно предположить, что у обследованных беременных присутствовал субклинический воспалительный процесс во влагалище, сопровождающийся снижением экспрессии GATA3 клетками цервикального канала, а лейкоцитарная инфильтрация - это следствие неадекватной защиты плодных оболочек от восходящего инфицирования из нижних отделов половых путей. Инфильтрация плодных оболочек лейкоцитами и лимфоцитами является одним из гистологических признаков ХА. Об остром ХА, вызванном бактериями, свидетельствует лейкоци-тарная инфильтрация; для хронического ХА вирусной этиологии более характерна лимфоцитарная инфильтрация [27, 28].
В родах, наоборот, было показано увеличение экспрессии GATA3 с активацией каскада выработки цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, СОХ-2, ФНО, ММП- 9) [18]. Мы наблюдали значительное повышение экспрессии GATA3 в плаценте и снижение в плодных оболочках при наличии флебита/фуникулита. Повышение экспрессии мРНК GATA3 в плаценте при флебите/фуникулите, по нашему мнению, связано с реакцией плацентарных иммунокомпетентных клеток: дендритных клеток и макрофагов (продуцентов GATA3) на воспалительный процесс. Можно предположить, что причиной флебита/фуникулита в данном случае служили внутриклеточные агенты, либо белковые антигены, инициирующие повышение экспрессии GATA3. Альтернативной гипотезой является то, что флебит при отсутствии инфекционных факторов может быть следствием аллергических и аутоиммунных реакций. Данная гипотеза находит подтверждение в работах Tsuda S. at al. (2018) [16], Xu Y., Romero R. (2018) [3], Меджидовой М.К., Бурменской О.В. (2012) [29].
При выявлении признаков париетального ХА в нашем исследовании наблюдалось конкордантное увеличение экспрессии RORC2 и FOXP3 в плаценте, что совпадает с данными литературы [30, 31]. RORC2 является ключевым ТФ, который координирует работу клеток Th17, являющихся значимыми участниками воспалительного процесса и ряда аутоиммунных заболеваний (ревматоидный артрит, рассеянный склероз) [29, 30, 32].
ТФ FOXP3, по данным различных источников, относится к факторам, ответственным за ограничение воспалительного процесса [12, 29, 30]. В нашем исследовании и этот показатель был повышен при париетальном ХА. Недавние исследования показали, что FOXP3-экспрессирующие Т-клетки человека с функцией Treg также могут секретировать ИЛ-17, цитокин, продуцируемый преимущественно Th17 [10, 14], а в некоторых клетках наблюдается содружественная экспрессия RORC и FOXP3 [3], что мы собственно и наблюдали в своей работе.
При отсутствии клинических признаков воспаления у матери и ребенка гистологические признаки ХА наблюдались в 66,7% случаев. При наличии признаков фуникулита/фунизита выявлено повышение экспрессии мРНК GATA3 в плаценте в 10 раз и снижение в плодных оболочках в 4 раза; при париетальном ХА - повышение уровня экспрессии RORC2, FOXP3 в плаценте в 2 раза. При лейкоцитарной инфильтрации плодных оболочек наблюдалось снижение экспрессии мРНК GATA3 в цервикальном канале в 10 раз.
Заключение
Таким образом, настоящее исследование показало, что гистологический ХА при физиологически протекающей доношенной беременности встречается более, чем в половине случаев. Исследование экс-прессии ТФ GATA3, RORC2, FOXP3 в диагностике воспалительного процесса плаценты и плодных обо-лочек может быть перспективным направлением.



