Лейомиома матки, представляющая собой гормонально-зависимую доброкачественную опухоль миометрия, относится к наиболее распространенным гинекологическим заболеваниям и диагностируется у 20–40% всех женщин репродуктивного возраста [1]. Обильные менструальные кровотечения, сопровождающиеся выраженным болевым синдромом и нарушениями репродуктивной функции, существенно снижают качество жизни пациенток с лейомиомой [2, 3]. До сих пор наиболее распространенным методом лечения пациенток с лейомиомой матки больших размеров является хирургический метод. Однако в последние годы лейомиома матки все чаще диагностируется у молодых женщин с нереализованной репродуктивной функцией, что диктует необходимость разработки медикаментозных методов лечения миомы матки, направленных на сохранение репродуктивного потенциала пациенток.
В настоящее время большинство медикаментозных препаратов используется для симптоматического лечения миомы матки малых размеров, и только небольшое число препаратов оказывает прямое воздействие на рост лейомиомы матки [4]. К таким препаратам относятся селективные модуляторы прогестероновых рецепторов, или SPRMs. Из препаратов этой группы в последние годы интенсивно изучается улипристала ацетат, который с февраля 2012 г. был одобрен для использования в странах Европы в качестве препарата предоперационной подготовки пациенток с лейомиомой матки. Результаты международных многоцентровых исследований показали, что лечение улипристала ацетатом приводит к снижению объема маточных кровотечений, развитию аменореи и уменьшению размера миоматозных узлов [5, 6]. Дальнейшие исследования подтвердили клиническую эффективность применения улипристала ацетата в предоперационном периоде для лечения умеренных и тяжелых симптомов миомы матки [7], а также для предоперационной подготовки пациенток с простой и пролиферирующей лейомиомой [8].
При изучении механизмов влияния улипристала ацетата на лейомиому матки было выявлено антипролиферативное, проапоптотическое и антифиброзноедействие препарата in vitro в отношении клеток миоматозных узлов [4]. В исследованиях in vivo также было показано, что уменьшение размеров лейомиом ассоциировано с активацией апоптоза и снижением пролиферативной и митотической активности клеток опухоли [9]. Однако пока еще нет единого мнения о том, какие молекулярные механизмы активации апоптоза включаются под влиянием улипристала ацетата. Сообщалось об усилении активности каспазы-3 при отсутствии изменений в экспрессии Bcl-2 в ткани миомы матки под действием SPRMs [9, 10], тогда как в работе других авторов изменений в экспрессии каспазы-3 в миоматозных узлах пациенток, получавших улипристала ацетат, выявлено не было [11]. Известно, что рост лейомиомы обусловлен не только усилением клеточной пролиферации, но зависит также от интенсивности продукции компонентов экстрацеллюлярного матрикса и его ремоделирования [12]. Проведенные исследования показали, что SPRMs влияют на активность процессов тканевого протеолиза в миоматозных узлах, усиливая экспрессию ферментов из семейства матриксных металлопротеиназ и их ингибиторов клетками миомы in vitro [13]. Но пока еще не изучено, в какой мере эти изменения связаны с уменьшением размеров миоматозных узлов под действием SPRMs.
Целью нашего исследования было определить молекулярные механизмы воздействия in vivo улипристала ацетата на апоптоз клеток миоматозных узлов и протеолиз компонентов экстрацеллюлярного матрикса, а также выявить особенности ответа опухолевых клеток на препарат при различной клинической эффективности терапии улипристала ацетатом.
Материал и методы исследования
Исследования проводились на базе гинекологической клиники ФГБУ ИвНИИ МиД им. В.Н. Городкова Минздрава России. В исследование были включены 32 женщины в возрасте 27–46 лет с лейомиомой матки. 17 из 32 женщин проводили оперативное лечение лейомиомы матки лапароскопическим доступом без предоперационной подготовки (группа сравнения). 15 женщин, которым планировалось провести органосохраняющее хирургическое лечение, прошли курс предоперационной подготовки, получая в течение 3 месяцев 5 мг улипристала ацетата ежедневно (основная группа). Всем пациенткам основной группы до и после курса терапии проводили магнитно-резонансное исследование органов малого таза с оценкой количества миоматозных узлов, их расположения и размеров. Исследования выполнялись на магнитно-резонансном томографе GE Signa HDxt c индукцией магнитного поля 1,5 Тл.
Материалом для генетического исследования служили полученные в ходе хирургического лечения биоптаты миоматозных узлов и ткани неизмененного миометрия. Из образцов ткани выделяли тотальную РНК феноловым методом, которую переводили в кДНК (комплементарную ДНК) с использованием коммерческого набора для постановки обратной транскрипции производства ООО «Фрактал Био» (Санкт-Петербург, Россия). В полученных образцах определяли уровень экспрессии мРНК факторов, регулирующих апоптоз и инвазию, таких как Х-связанный ингибитор апоптоза (XIAP), рецептор, активируемый пероксисомным пролифератором (PPARγ), фосфатаза и гомолог тензина (PTEN) и матриксная металлопротеиназа-2 (ММР-2) методом количественной полимеразной цепной реакции в режиме реального времени. В работе использовали наборы ферментов, праймеров и зондов производства ООО «Фрактал Био» (Санкт-Петербург, Россия). Реакцию амплификации и обработку данных проводили на приборе iCycler iQ (BioRad, USA). Результаты по экспрессии генов представлены как нормализованное относительно уровня экспрессии мРНК гена домашнего хозяйства (β2-микроглобулина) количество копий специфического гена в образце х102/мкл для мРНК XIAP, PPARγ, PTEN и как количество копий специфического гена в образце/мкл для мРНК ММР-2.
При статистической обработке данных проводился расчет нормальности распределения в выборках с использованием критерия Колмогорова–Смирнова и Лиллифорса. В выборках с нормальным распределением достоверность различий оценивалась по t-критерию Стьюдента, в случаях отсутствия нормального распределения в выборках использовали непараметрический критерий достоверности различий Манна–Уитни. Все полученные данные представлены как среднее арифметическое ± ошибка среднего арифметического.
Результаты исследования и обсуждение
Средний возраст пациенток достоверно не различался в двух клинических группах наблюдения и составил 37,73±1,75 года в группе сравнения и 35,40±1,47 года у женщин основной группы. Основными клиническими проявлениями лейомиомы матки были циклические маточные кровотечения и увеличение размера узла более чем на 2 см в год. Показатели гемоглобина в группе сравнения составили 121,36±1,36 г/л, в основной группе – 117,91±1,21 г/л (р=0,061). У всех женщин группы сравнения и у 14 из 15 (93,3%) женщин основной группы была выявлена интрамурально-субсерозная лейомиома матки, у 1 женщины основной группы (6,6%) – интрамурально-субмукозная лейомиома матки. Размер доминирующего узла варьировал по данным МРТ от 4 до 12 см и составил в среднем 5,85±0,78 см у пациенток без предоперационной подготовки и 7,86±0,50 см у пациенток основной группы до начала курса лечения улипристала ацетатом, что достоверно не различалось (p=0,055). После лечения показатели гемоглобина у пациенток основной группы достоверно не изменились и составили 119,82±1,22 г/л (р=0,234). Толщина эндометрия после лечения увеличилась с 6,40±0,97 мм до 15,64±2,62 мм (р=0,009), что хорошо согласуется с данными литературы о доброкачественных и обратимых изменениях в эндометрии под влиянием SPRMs, получивших название PAEC (ассоциированные с модулятором рецепторов прогестерона изменения эндометрия) [6]. Оценка динамики изменения размеров миоматозных узлов до и после курса медикаментозного лечения показала, что в целом статистически значимых изменений размеров узлов не произошло. Среднее значение размеров доминирующих узлов у женщин основной группы после лечения составило 6,94±0,81 см (р=0,360). При этом у 10 пациенток (66,7%) было отмечено уменьшение размеров узла (с 5,89±0,88 см до 4,94±0,86 см). У 5 пациенток (33,3%) размеры узлов после лечения остались прежними или незначительно увеличились (с 7,80±0,54 до 8,70±0,45 см). Наши данные по клинической эффективности улипристала ацетата согласуются с ранее полученными результатами. Так, большинство исследователей отмечают уменьшение размеров миоматозных узлов после лечения улипристала ацетатом [3–5]. В то же время есть данные, что в ряде случаев препарат не оказывал влияния на размер лейомиомы матки [14]. Интраоперационно у 13 из 15 пациенток основной группы отмечались меньшая кровоточивость и большая эластичность ткани миометрия, что позволило сократить время операции в среднем на 20–25 мин за счет экономии времени на коагуляцию и коаптацию краев раны.
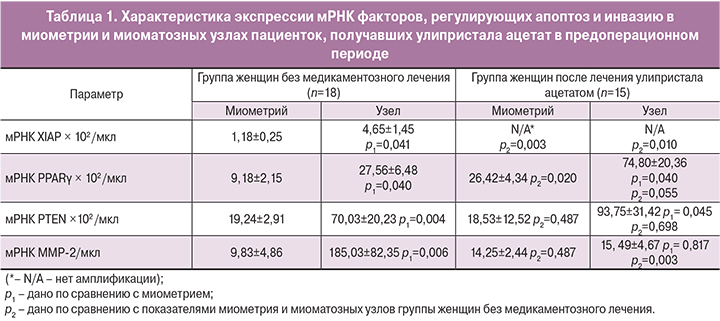
Проведение сравнительной оценки характера экспрессии генов, регулирующих апоптоз, в ткани миометрия и миоматозных узлов показало, что у пациенток группы сравнения, не получавших медикаментозного лечения в предоперационном периоде, в ткани лейомиомы отмечалось достоверное повышение по сравнению с миометрием уровня экспрессии мРНК XIAP, PPARγ и PTEN (р=0,041, р=0,040 и р=0,004 соответственно) (табл. 1). Кроме того, в миоматозных узлах женщин данной клинической группы отмечалось выраженное практически 20-кратное усиление экспрессии мРНК протеолитического фермента ММР-2 по сравнению с показателями миометрия (р=0,006) (табл. 1).
Таким образом, отличительной особенностью ткани лейомиомы матки является одновременное усиление синтеза факторов с про- и анти-апоптотическим действием. Известно, что ингибитор апоптоза XIAP способен связываться с каспазами -9, -3, -7 и инактивировать их, подавляя развитие Fas-индуцированного апоптоза [15], что определяет участие XIAP в развитии опухолевого роста [15]. По-видимому, высокий уровень синтеза в миоматозных узлах XIAP может играть важную роль в индукции роста лейомиомы. В то же время в миоматозных узлах, по нашим данным, одновременно повышался и синтез факторов, стимулирующих апоптоз, таких как PPARγ и PTEN. Ядерный рецептор PPARγ выполняет многочисленные функции в организме, регулируя воспалительные реакции и процессы клеточной пролиферации [16]. Ранее в экспериментах in vitro было продемонстрировано ингибирующее влияние PPARγ на рост клеток лейомиомы [17]. Другой изученный нами проапоптотический фактор PTEN подавляет активность клеточной пролиферации и индуцирует апоптоз, ингибируя проведение внутриклеточного сигналинга по PI3K/Akt пути [18]. Можно предположить, что повышение экспрессии PPARγ и PTEN компенсирует высокий уровень активности ингибитора апоптоза XIAP в миоматозных узлах, определяя доброкачественный характер роста лейомиомы матки.
Нами также былo выявлено повышение экспрессии мРНК протеолитического фермента ММР-2 в миоматозных узлах, что хорошо согласуется с имеющимися литературными данными. Показано, что как в миометрии, так и в ткани миомы матки продуцируются и секретируются в больших количествах MMP-1, MMP-2, MMP-3 и MMP-9; при этом ММР-2 и ММР-9 в большей степени вырабатываются в ткани опухоли, чем в неизмененном миометрии [19]. Известно, что ММР-2 деградирует коллаген I и IV типа [19], что, в свою очередь, приводит к высвобождению различных факторов роста, ковалентно связанных с компонентами экстрацеллюлярного матрикса. Существует гипотеза о том, что постоянная деградация внеклеточного матрикса матриксными металлопротеиназами приводит к усилению сигналинга от факторов роста, которые высвобождаются при этом [20]. Важная роль факторов роста в патогенезе лейомиомы матки была доказана многочисленными исследованиями [21].
Таким образом, прямым следствием усиления синтеза ММР-2 в миоматозных узлах может быть индукция роста опухоли за счет усиления активности факторов роста.
У женщин, получавших в предоперационном периоде улипристала ацетат, по нашим данным значительно изменялся характер экспрессии генов, регулирующих апоптоз и тканевой протеолиз (см. табл. 1). Так, после курса лечения экспрессия мРНК ингибитора апоптоза XIAP как в миометрии, так и в миоматозных узлах падала до недетектируемого уровня, а синтез проапототических факторов PPARγ и PTEN в лейомиоме оставался повышенным по сравнению с показателями миометрия (р=0,040, р=0,045 соответственно). При этом экспрессия мРНК PPARγ в миометрии и миоматозных узлах после лечения улипристала ацетатом была выше соответствующих показателей в группе женщин, не получавших препарата в предоперационном периоде (р=0,020, р=0,055). Ранее было показано, что PPARγ вызывает арест клеточного цикла и усиление апоптоза клеток лейомиомы по Fas-зависимому пути, одновременно активируя внутриклеточные Ca2+-зависимые каналы [16]. Можно предположить, что улипристала ацетат усиливает Fas-зависимый апоптоз клеток миоматозных узлов за счет угнетения синтеза ингибитора апоптоза XIAP и усиления экспрессии PPARγ. Наши результаты хорошо согласуются с полученными ранее данными, свидетельствующими об увеличении количества апоптирующих клеток в ткани лейомиомы матки у пациенток, получавших курс предоперационной подготовки улипристала ацетатом [9].
Заслуживает особого внимания тот факт, что после лечения улипристала ацетатом в ткани лейомиомы экспрессия мРНК ММР-2 снижалась до уровня показателей, характерных для миометрия (см. табл. 1). Таким образом, улипристала ацетат не только усиливал апоптоз клеток лейомиомы, но и снижал активность протеолитических процессов, обусловленных ММР-2, что может приводить к угнетению активности факторов роста в ткани опухоли.
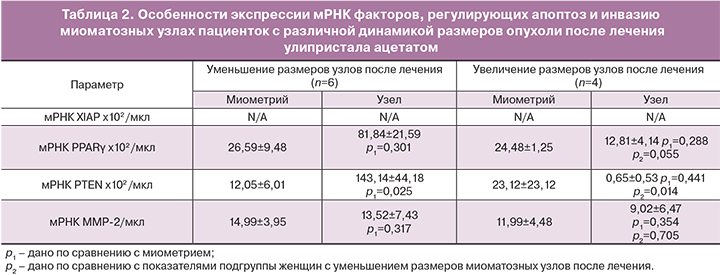
Учитывая тот факт, что у некоторых обследованных нами пациенток после лечения улипристала ацетатом было отмечено увеличение размеров лейомиомы, мы попытались проанализировать, с чем было связано отсутствие динамики размеров узлов. Ретроспективно мы выделили 2 подгруппы из основной клинической группы: подгруппа пациенток, у которых отмечалось выраженное уменьшение размеров доминантных узлов после лечения (n=6) и подгруппа пациенток, у которых было выявлено увеличение размеров миомы после лечения (n=4) (табл. 2). Анализ данных генетического обследования показал, что уменьшение размеров миоматозных узлов после лечения улипристала ацетатом отмечалось у пациенток с максимально высоким уровнем экспрессии мРНК PPARγ и PTEN. В то же время отсутствие уменьшения размеров миомы было отмечено в тех случаях, когда усиление синтеза проапоптотических факторов в лейомиоме не происходило. Более того, уровень экспрессии мРНК PPARγ и PTEN в миоматозных узлах таких пациенток был ниже аналогичных параметров в миоматозных узлах тех женщин, у которых было отмечено уменьшение размеров узлов после лечения (p=0,055, p=0,014 соответственно) (табл. 2).
Таким образом, значительное уменьшение размеров миомы матки после терапии улипристала ацетатом ассоциировано с выраженным усилением апоптоза в ткани лейомиомы за счет повышения синтеза PPARγ и PTEN. Отсутствие уменьшения размеров миомы после применения улипристала ацетата наблюдается при низких значениях экспрессии апоптоз-индуцирующих факторов в ткани лейомиомы, что может приводить к угнетению апоптоза клеток лейомиомы и как следствие – к увеличению размера опухоли. В настоящее время нельзя однозначно сказать, с чем связано отсутствие ответа клеток опухоли на препарат: либо с особенностями функционирования самих рецепторов прогестерона, либо с особенностями регуляции апоптоза у этих пациенток. Выявление факторов, определяющих ответ клеток миомы на улипристала ацетат, позволит в дальнейшем решить проблему персонифицированного назначения препарата для достижения максимальной эффективности медикаментозного лечения.
Заключение
Уменьшение размеров миоматозных узлов после применения улипристала ацетата в предоперационной терапии пациенток с лейомиомой матки больших размеров определяется апоптоз-индуцирующим действием препарата за счет индукции синтеза в ткани опухоли факторов PPARγ и PTEN, а также снижением под влиянием препарата протеолитической активности ММР-2 в миоматозных узлах, что может обусловливать угнетение активности факторов роста в ткани лейомиомы. Отсутствие выраженного клинического эффекта улипристала ацетата на размеры миомы матки отмечается в тех случаях, когда активность проапоптотических факторов PPARγ и PTEN в миоматозных узлах снижается и/или является изначально низкой. Необходимо проведение дальнейших исследований, направленных на разработку дифференцированных критериев назначения препарата улипристала ацетата с целью достижения максимальной эффективности медикаментозного лечения, направленного на уменьшение размеров лейомиомы матки.



