Отличительной чертой современного акушерства является неуклонный рост оперативного родоразрешения с целью улучшения исходов беременности как для матери, так и для новорожденного. Высокий процент абдоминального родоразрешения отмечается по данным ФГБУ НИИ ОММ Минздрава России – в 2012 году 47,2% женщин были родоразрешены путем кесарева сечения. В этих условиях большое значение приобретает выбор анестезиологического пособия. К анестезиологическому пособию в акушерстве предъявляются особые требования: необходимо обеспечить защиту организма роженицы от операционной травмы и в то же время не оказывать отрицательного воздействия на плод, максимально сохранить его адаптивно-регуляторные механизмы, ответственные за постнатальную адаптацию [1, 2].
Регионарная или общая анестезия (ОА) обычно используется для большинства кесаревых сечений. Каждый вид анестезии имеет свои достоинства и недостатки, к каждому существуют достаточно строгие показания и противопоказания [2, 3]. На фоне нейроаксиальных методов обезболивания нередки артериальная гипотензия и брадикардия, в то время как артериальная гипертензия и тахикардия сопровождают ОА. Вопрос о том, что вызывает более значимое напряжение гемодинамики в системе мать – плод и связанные с этим нарушения транспорта кислорода у матери и плода, остается нерешенным [4–6].
Цель исследования – провести сравнительный анализ параметров центральной гемодинамики матери, состояния газового гомеостаза и кислотно-основного состояния (КОС) плода и перинатальных исходов при абдоминальном родоразрешении в условиях общей и спинальной анестезии (СА).
Материал и методы исследования
Проведено проспективное рандомизированное сравнительное исследование. В исследование включены 65 пациенток без соматической патологии с физиологически протекающей беременностью, родоразрешенные в сроке доношенной беременности путем кесарева сечения в плановом порядке. В зависимости от метода анестезиологического пособия пациентки были разделены на две исследуемые группы методом конвертов: в I группу вошли 30 беременных женщин, родоразрешенные в условиях общей анестезии (ОА); II группу составили 35 пациенток, кесарево сечение у которых выполнено в условиях спинальной анестезии (СА). Из исследования исключены пациентки с наличием противопоказаний к одному из методов анестезиологического пособия, преэклампсией, многоплодной беременностью, заболеваниями сердечно-сосудистой системы, ожирением II и более степени (индекс массы тела ≥35).
Средний возраст пациенток исследуемых групп составил 28,72±0,75 года в группе ОА и 30,27±0,84 года в группе СА (р=0,17), средний срок гестации 39,0±0,12 и 38,7±1,18 (р=0,21) соответственно. Паритет родов, росто-весовые показатели, данные акушерского анамнеза беременных не имели достоверных межгрупповых отличий. Кесарево сечение производилось преимущественно по акушерским показаниям: рубец на матке 55%, тазовое или поперечное положение плода в 24,5%, незрелая шейка матки, рубцовые деформации в 12,5% случаев, симфизиопатия у 8% пациенток.
Все беременные в группе ОА на операционном столе получали внутривенно премедикацию, включающую холинолитик (атропин 0,01 мг/кг), антигистаминный препарат (димедрол 0,1–0,2 мг/кг) и метоклопрамид 10 мг. Индукция в наркоз проводилась тиопенталом натрия (5–6 мг/кг), интубацию осуществляли на фоне миорелаксации листеноном (1,5–2 мг/кг). Искусственную вентиляцию легких проводили аппаратом «Drager Fabius GS» в режиме, контролируемом по объему, с параметрами, поддерживающими нормовентиляцию под контролем капнографии («Drager Vamos»). Анестезия осуществлялась с использованием севофлурана в кислородно-воздушной смеси (1:1) по закрытому контуру с низким потоком 2 л/мин (low flow anaesthesia), концентрация севофлурана на выдохе поддерживалась на уровне 2,0 об.%. После извлечения плода внутривенно вводились фентанил 0,1 мг, тракриум 0,4–0,6 мг/кг. Для выполнения спинальной анестезии (СА) использовался 0,5% гипербарический раствор бупивакаина в дозе 10–12,5 мг. Пункция выполнялась на уровне L4-5 в положении сидя, на фоне преднагрузки раствором гидроксиэтилкрахмала 6% 500,0 (130/0,4). Коррекция артериальной гипотензии проводилась микроструйным внутривенным введением мезатона до стабилизации артериального давления. Самостоятельное дыхание осуществлялось воздушно-кислородной смесью через лицевую маску (FiO2=50об%). Профилактика синдрома аорто-кавальной компрессии осуществлялась поворотом операционного стола влево на 15–30º.
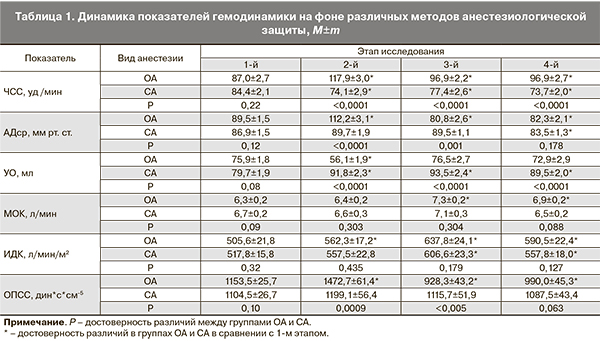
Оценка состояния гемодинамики пациенток проводилась с помощью неинвазивной биоимпедансной технологии мониторной системой «МАРГ 10-01» на базе компьютера «Pentium IV» (Россия, Челябинск). Анализировались основные параметры кровообращения: ЧСС – частота сердечных сокращений (уд/мин); АДср – артериальное давление среднее (мм рт. ст.); УО – ударный объем (мл); МОК – минутный объем кровообращения (л/мин); ИДК – индекс доставки кислорода (мл/мин/м2); ОПСС – общее периферическое сосудистое сопротивление (дин*с/см5/м2). Регистрация параметров производилась в режиме от удара к удару (beat to beat) с выборкой за 500 ударов. Регистрация параметров центральной гемодинамики проводилась на четырех этапах: 1-й этап – исходный, до начала анестезии; 2-й этап – пренатальный, до извлечения плода; 3-й этап – основная анестезия, после извлечения плода; 4-й этап – конец операции.
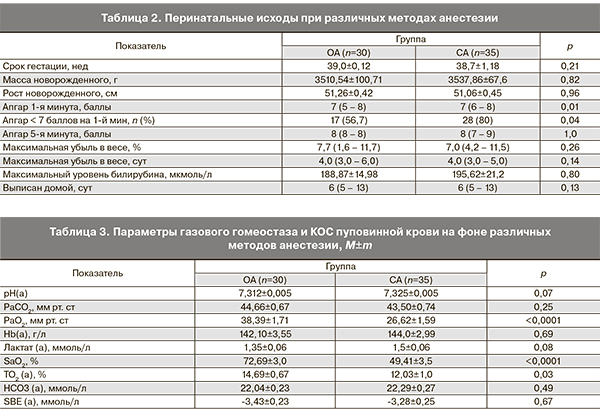
Состояние новорожденных оценивали по шкале Апгар на 1-й и 5-й минутах после рождения. Образцы пуповинной крови новорожденного забирались из вены пуповины сразу после его рождения (после клеммирования пуповины) до первого вдоха. Газовый гомеостаз и КОС артериальной пуповинной крови плода определяли на газовом анализаторе «ABL-700» («Radiometer», Дания) по следующим показателям: pH(а), парциальное давление углекислого газа (РаCO2), парциальное давление кислорода (РаO2), степень насыщения артериальной крови кислородом (SаO2), транспорт кислорода (ТО2(а)), бикарбонат (HCO3(а)), стандартный избыток оснований (SBE(а)), лактат(а).
Статистическая обработка данных проводилась с помощью программы Statistica 7.0 (StatSoft Inc., CША). Данные представлены в виде средних величин ± среднеквадратичное отклонение (M±m). Для сравнительного анализа применяли параметрические (t-критерий Стьюдента) и непараметрические методы (U-критерий Манна-Уитни). Различия считали статистически значимыми при р<0,05.
Результаты исследования и обсуждение
При анализе деталей оперативного вмешательства в условиях различных анестезиологических технологий не выявлено достоверных отличий в продолжительности хирургического вмешательства, времени извлечения плода, объеме интраоперационной кровопотери. Средняя продолжительность операции в группе ОА составила 47,5±2,2 мин, в группе СА – 52,4±2,0 мин (р=0,06), время извлечения плода – 6,5±0,4 и 6,7±0,3 мин, соответственно (р=0,69). Суммарная кровопотеря, измеренная гравиметрическим методом, в среднем составила 594,6±26,0 мл для группы ОА и 561,4±17,3 мл в группе СА (р=0,25).
Исходно, на дооперационном этапе, у беременных женщин обеих исследованных групп достоверных различий основных параметров центральной гемодинамики не выявлено, у всех пациенток отмечался эукинетический режим кровообращения. Результаты проведенного сравнительного анализа полученных данных на этапах операции представлены в табл. 1.
В группе ОА на пренатальном (2-м) этапе отмечалось достоверное увеличение АДср от исходных значений (р<0,0001), на этапе основной анестезии (3-й этап) показатель АДср начинал достоверно (р<0,005) снижаться и в конце операции (4-й этап) оставался значительно ниже исходного уровня (р<0,005). В группе СА показатель АДср оставался стабильным на 2-м и 3-м этапах исследования, достоверно (р<0,05) снижаясь к концу операции (4-й этап). На пренатальном этапе в группе ОА АДср было достоверно выше, чем в группе СА (р<0,0001), что обусловлено прессорным ответом на интубацию. После извлечения плода (3-й этап) показатели АДср на фоне ОА были достоверно ниже, чем у пациенток, родоразрешенных в условиях СА (р<0,005), к моменту окончания операции достоверных отличий между группами по уровню АДср не получено.
ЧСС на фоне ОА значительно возрастала на пренатальном этапе (р<0,0001) и оставалась повышенной после извлечения плода (р=0,003) и в конце операции (р=0,006). На фоне СА отмечалось достоверное снижение ЧСС на всех этапах исследования, начиная с пренатального этапа (р=0,003). Интраоперационно ЧСС была достоверно выше в группе родоразрешенных в условиях ОА на всех этапах операции (р<0,0001), что можно объяснить использованием атропина для премедикации перед ОА.
УО на фоне ОА достоверно снижался (р<0,0001) на пренатальном этапе, после извлечения плода возвращался к исходным значениям (3-й и 4-й этапы). В условиях СА УО сердца достоверно увеличивался на всех этапах анестезии и операции, начиная с пренатального (р<0,0001). Интраоперационные значения УО были достоверно выше в группе СА на всех этапах операции (р<0,0001).
МОК как результирующий показатель не изменялся на пренатальном этапе в обеих группах. В условиях ОА снижение УО компенсировалось возрастанием ЧСС, при СА увеличение УО нивелировалось снижением ЧСС, за счет симпатической блокады. В дальнейшем отмечался достоверный прирост МОК (р<0,05) на 3-м и 4-м этапах в группе ОА, что связано с устранением аорто-кавальной компрессии после извлечения плода, а также с сокращением матки и перераспределением объема маточного кровотока. Достоверных отличий МОК между группами на этапах исследования не отмечалось.
ИДК в условиях ОА возрастал на 2-м (р=0,023), 3-м (р=0,0001) и 4-м (р=0,004) этапах исследования. При родоразрешении под СА ИДК достоверно возрастал на 3-м и 4-м этапах после извлечения плода (р=0,005). Показатель ИДК не имел достоверных отличий между группами на всех этапах операции.
ОПСС достоверно возрастало после интубации трахеи на пренатальном этапе (р<0,0001), затем значительно снижалось на 3-м и 4-м этапах анестезии на основе севофлурана (р<0,001). В группе СА не получено достоверных отклонений ОПСС от исходных значений на всех этапах операции. При сравнительном анализе выявлены более высокие значения ОПСС в группе ОА на пренатальном этапе (р=0,0009) и более низкий уровень ОПСС (р<0,005) после извлечения плода, в сравнении с группой СА.
Применение СА при оперативном родоразрешении пациенток с физиологически протекающей беременностью сопровождалось более благоприятными гемодинамическими сдвигами, особенно на пренатальном этапе, на фоне стабильных показателей АДср, МОК, ИДК и ОПСС отмечалось возрастание УО. Использование ОА на основе севофлурана сопровождалось возрастанием АДср, ЧСС и ОПСС, снижением УО, при стабильном результирующем показателе МОК и повышении ИДК на пренатальном этапе. Достоверные отличия между группами сопровождались более высокими значениями АДср (р<0,0001), ЧСС (р<0,0001) и ОПСС (р=0,0009) в группе ОА и более низкими значениями УО (р<0,0001), в сравнении со СА на пренатальном этапе.
При анализе состояния новорожденных обеих исследованных групп не выявлено отличий гестационного возраста и росто-весовых показателей (табл. 2). В группе ОА с использованием севофлурана выявлены достоверно более низкие значения оценки по шкале Апгар на 1-й минуте по сравнению с группой СА (р=0,01), также отмечалось значительно большее число новорожденных с оценкой по шкале Апгар <7 баллов на 1-й минуте жизни (р=0,04). К 5-й минуте достоверной разницы между группами не получено. Ранний неонатальный период у всех новорожденных протекал без осложнений. Сравнение показателей убыли в весе и уровня билирубина не показало значимых отличий в группах с различными методами анестезии. Новорожденные обеих исследуемых групп были выписаны из роддома в среднем на 6-е сутки жизни (р=0,13). Низкая оценка по Апгар на 1-й минуте жизни свидетельствует о медикаментозной депрессии, однако она не может быть достаточно объективным критерием внутриутробной гипоксии. Надежным показателем благополучия плода является КОС, измеренное в крови пуповины [4, 5].
Показатели газового гомеостаза и КОС в вене пуповины в условиях различных методов анестезии приведены в табл. 3. Значение рН в вене пуповины сразу после извлечения находилось в пределах физиологической нормы в обеих группах (р=0,07). В группе ОА наблюдались более высокие показатели оксигенации пуповинной крови: РаO2 было выше на 44% (p<0,0001), SаO2 – на 47% (p<0,0001), TO2 – на 22% (p<0,028), чем в группе СА, что, возможно, связано с проведением искусственной вентиляции легких в группе ОА. Значения гемоглобина (Hb(a)), PаСO2, и SBE(a) не имели существенных отличий между группами исследования (р>0,05). Уровень лактата – маркера клеточной гипоксии находился в пределах физиологической нормы и не имел достоверных отличий в группе общей и СА (р=0,08).
Выводы
Применение СА при оперативном родоразрешении пациенток с физиологически протекающей беременностью сопровождалось более благоприятными гемодинамическими сдвигами на всех этапах операции, особенно на пренатальном этапе, на фоне стабильных показателей АДср, МОК, ИДК и ОПСС отмечалось возрастание УО.
Применение ОА севофлураном сопровождалось более низкой оценкой по шкале Апгар на 1-й минуте, что может свидетельствовать о медикаментозной депрессии, однако отличия к 5-й минуте полностью нивелировались.
ОА обеспечивает более высокий уровень оксигенации пуповинной крови, однако оба метода анестезии свидетельствуют о сохранении адекватной маточно-плацентарной перфузии и безопасны для плода.



