Для повышения эффективности программ вспомогательных репродуктивных технологий (ВРТ) важным является подбор оптимальных параметров культивирования эмбрионов человека [1–4]. При культивировании в условиях in vitro эмбрион постоянно подвергается стрессовым воздействиям, которые он не испытал бы при развитии в организме матери. К ним относятся изменение рН среды культивирования (СК), температурные колебания, воздействие атмосферных концентраций кислорода, естественного и искусственного света [5]. Для оптимизации систем культивирования эмбрионов человека проводится подбор оптимального состава культуральной среды [6–8], однако большинство систем культивирования представляют собой относительно небольшой (до 1 мл) и полностью статичный объем среды [9–11]. Эти условия далеки от тех, в которых находится эмбрион человека в условиях in vivo, – постоянного динамического взаимодействия со своим микроокружением за счет перистальтических сокращений мышечной стенки маточной трубы и биения ворсинок ее слизистой оболочки [12–14].
Помимо секреторного эпителия, слизистая оболочка маточной трубы представлена клетками ворсинчатого эпителия, ворсинки которых постоянно колеблются с частотой от 4,9 (0,2) Гц в пролиферативную фазу до 5,8 (0,3) Гц в секреторную фазу менструального цикла [15, 16]. По данным Исаченко и соавт. [17], в естественных условиях эмбрион находится под постоянным воздействием вибрации с частотой до 20 Гц. Цилиарные сокращения не только оказывают непосредственное воздействие на эмбрион, но и способствуют диффузии питательных веществ [18].
Новым подходом к улучшению условий культивирования эмбрионов человека в программах ВРТ может стать сочетание стандартных систем культивирования с микровибрацией [14, 17, 19, 20], однако влияние контролируемой механической микровибрации на метаболизм и развитие эмбрионов человека на сегодняшний день изучено недостаточно. Цель исследования – оценить влияние контролируемой механической микровибрации на профиль метаболитов в средах культивирования эмбрионов человека на 5-е сутки развития.
Материалы и методы
Характеристика пациентов
В проспективное исследование были включены 44 супружеские пары без наличия противопоказаний и развития осложнений в ходе проведения программ ВРТ. Перед включением в протокол экстракорпорального оплодотворения (ЭКО) пациентки были обследованы согласно приказу Минздрава Российской Федерации от 30.08.2012 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [21]. Критерии включения в исследование: нормальный кариотип обоих супругов, возраст женщины 18–45 лет включительно. Критерии невключения в исследования: использование ооцитов донора, плановая криоконсервация всех полученных ооцитов. Все пациентки подписали добровольное информированное согласие на участие в исследовании. Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Отбор и культивирование эмбрионов
Стимуляция функции яичников проводилась по протоколу с антагонистами гонадотропин-рилизинг-гормона (ГнРГ). В качестве триггера овуляции использовали хорионический гонадотропин или агонист ГнРГ. Эмбрионы культивировали в индивидуальных каплях культуральной среды Irvine CSC (Fujifilm, США) равного объема (25 мкл) в течение 5 дней в смешанной атмосфере N2/O2/CO2 (89/5/6%). Морфологическую оценку эмбрионов по классификации Гарднера (Gardner DK, 1999) проводил эмбриолог через 120–122 ч после оплодотворения. При культивировании в условиях механической микровибрации инкубатор помещали на платформу ArisTT180-s (K&S Advanced Systems Ltd, Израиль) в режиме активной вибрации с частотой 40 Гц в течение 30 секунд с интервалом покоя 30 минут, как было описано ранее [14]. Культивирование в условиях микровибрации осуществляли на протяжении всего срока от получения ооцитов до проведения переноса (или криоконсервации) эмбриона, после чего отбирали СК и криоконсервировали при -80°C. Оценку реальной частоты и амплитуды микровибрации проводили при помощи встроенного осциллографа [14].
Для получения метаболомного профиля равные объемы использованной СК были отобраны на 5-й день культивирования эмбрионов и заморожены до проведения анализа при -80° С. Всего было проанализировано 62 образца СК эмбрионов человека 5-х суток развития, из них 20 эмбрионов культивировали в условиях контролируемой механической микровибрации, 42 эмбриона – в стандартных условиях. Все эмбрионы относились к классу эмбрионов высокого качества (классы 3AA, 3AB, 4AA, 4AB, 5AA по классификации Гарднера).
Пробоподготовка и детекция метаболитов
Экстракция метаболитов проводилась путем добавления трех объемов метанола к одному объему СК. Затем смесь вортексировали, центрифугировали при 14 000 g, надосадок использовали для анализа. Для проведения высокоэффективной жидкостной хроматографии с масс-спектрометрией (ВЭЖХ-МС) в хроматографические флаконы со стеклянными вставками отбирали 20 мкл экстракта каждого образца. Разделение проб проводили на колонке Atlantis T3 C18 диаметром 1 мм, длиной 150 мм и размером частиц 3 мкм (Waters, США) в хроматографической системе Ultimate 3000 Nano LC System (Thermo Scientific, США) [22].
Элюирование компонентов образцов проводили в градиенте подвижной фазы B (ацетонитрил с добавлением 0,1% муравьиной кислоты по объему): 5% в течение первых 11 минут, затем градиент 5–95% фазы B в течение 10 минут, затем промывка в течение 5 минут при 95% фазы B, затем возврат 95–5% фазы B в течение 1 минуты, с последующим уравновешиванием колонки в течение 3 минут при концентрации фазы B 5%. Скорость потока была равна 40 мкл/мин, общее время хроматографии одного образца составило 30 минут. Детекция метаболитов проводилась на гибридном масс-спектрометре Bruker Maxis Impact (Bruker Daltoniks, Германия) со следующими параметрами: напряжение на капилляре – 4100 В, давление небулайзера – 0,4 бар, осушающий газ – 4 л/мин при температуре 180ºС, масс – 100–1500 m/z [22].
Обработка масс-спектров и статистический анализ
Детекцию пиков и дальнейшую обработку масс-спектров проводили программным пакетом XCMS со следующими параметрами: алгоритм детекции пиков Centwave со временем выхода пиков от 10 до 45 с и точностью 15 ppm; алгоритм группировки пиков Matched filter [23].
Статистический анализ
Для статистического анализа полученных данных использовалась платформа MetaboAnalyst (www.metaboanalyst.ca) [24]. Для многомерного статистического анализа использовался метод ортогональных частичных наименьших квадратов с дискриминантным анализом (OPLS-DA) [25]. Для одномерного анализа использовался t-критерий Стьюдента. Статистически значимыми считались различия с уровнем p<0,05 и разницей сигналов (интегрированная площадь пика) минимум в 2 раза [26, 27]. Для первичной идентификации отобранных таким образом молекулярных ионов была использована база данных метаболитов человека – Human metabolome database (HMDB, www.hmdb.ca) c допустимой погрешностью m/z в 15 ppm [28].
Результаты
В результате обработки масс-спектров в СК от эмбриона человека 5-х суток развития было выявлено 1146 различных молекулярных ионов. Из них были отобраны 26 метаболитов, значимо различающихся в группах сравнения с кратностью различий интенсивности сигналов более двух. Для оценки кластеризации образцов и выявления потенциальных выбросов был проведен многомерный статистический анализ методом OPLS-DA, который выявил статистически значимые различия между исследуемыми группами (рис. 1).
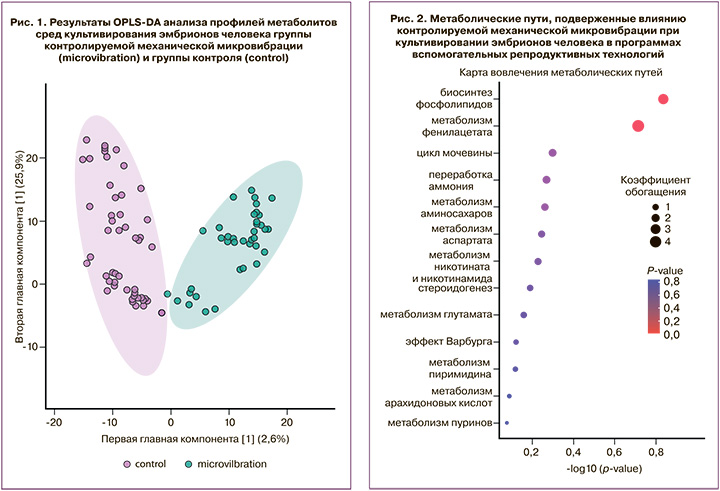
Для выявления наиболее значимых метаболитов, обуславливающих различия между исследуемыми группами, были отобраны метаболиты, статистически значимо различающиеся между группами с разницей общей площади соответствующих пиков (пропорциональной концентрациям веществ) в 2 и более раза между группами. Первичная идентификация найденных молекулярных ионов проводилась с помощью поиска в специализированной базе данных HMDB. Таким образом был выявлен ряд потенциальных метаболитов, изменяющихся под действием КММВ (таблица).
Наиболее значимыми молекулами, уровень которых различался в группах сравнения, являлись прогестерон, глутамин, гидроксипролил-глутамат, лизил-гамма-глутамат, ацетилхолин, олеамид, простагландин A2 и его конъюгат с глутатионом, 2,3-динор-тромбоксан B2 и 20-гидрокси-простагландин E2.
Прогестерон – важнейший эндогенный стероид, оказывающий влияние на менструальный цикл, беременность и развитие эмбрионов человека [29]. Согласно полученным данным, содержание прогестерона в СК группы КММВ было в 2,8 раза выше, чем в группе контроля.
Глутамин – одна из 20 стандартных аминокислот, входящих в состав белка. Аминокислоты играют важную роль в преимплантационном развитии эмбриона, служат источниками энергии, биосинтетическими предшественниками, буферами внутриклеточного рН, антиоксидантами и регуляторами клеточной дифференцировки [30–32]. Потребление аминокислот является одним из развивающихся методов оценка качества и имплантационного потенциала эмбрионов [33, 34]. Известно, что потребление глутамина в СК эмбрионов ассоциировано с развитием эмбрионов первых 3 суток развития [35]. Кроме того, потребление аспартата и глутамина связано с функцией митохондрий развивающегося эмбриона [36]. Согласно полученным данным, содержание глутамина в СК группы КММВ было в 2,3 раза ниже, чем в группе контроля. Важно учитывать, что при 37°C аминокислоты спонтанно дезаминируют и высвобождают аммоний, причем глутамин является наиболее лабильным. Накопление аммония ингибирует развитие эмбриона, изменяет их метаболизм и экспрессию генов [37].
Другой важной для метаболизма эмбриона аминокислотой является глутамат. Так, для 2–3-дневных эмбрионов, развивающихся в дальнейшем до стадии бластоцисты, характерно более низкое поглощение глутамина, аргинина и метионина, а также более низкое выделение аланина и аспарагина по сравнению с эмбрионами, не формирующими бластоцисту [38]. Снижение уровня глицина и лейцина, повышение содержания аспарагина и глутамата в СК связаны с повышением частоты наступления беременности и живорождения [9, 39]. В исследовании было выявлено положительное влияние КММВ на метаболизм глутамата развивающихся эмбрионов – уровень гидроксипролил-глутамата был в 4,8 раза выше, а уровень лизил-гамма-глутамата – в 6,9 раза выше, чем в группе контроля.
Ацетилхолин – важный возбуждающий нейромедиатор, может деполяризовать или гиперполяризовать клеточную мембрану в зависимости от типа рецепторов. Известно, что добавление холина (предшественник ацетилхолина) в СК эмбрионов крупного рогатого скота повышает долю эмбрионов, развивающихся до стадии бластоцисты, число клеток бластоцисты, долю эмбрионов, способных к самопроизвольному хетчингу [40]. Согласно полученным данным, содержание ацетилхолина в СК группы КММВ было в 3,1 раза выше, чем в группе контроля.
Олеамид представляет собой амид олеиновой кислоты и, вероятно, взаимодействует с несколькими системами нейротрансмиттеров. Крайне важным свойством олеамида является разобщение межклеточных щелевых контактов [41, 42]. В норме разобщение щелевых контактов происходит только на стадии декомпактизированной морулы и нехарактерно для других стадий развития эмбриона. Согласно полученным данным, содержание олеамида в СК группы КММВ было в 2,2 раза ниже, чем в группе контроля.
Также было выявлено 4 метаболита различия, относящихся к эйкозаноидам или их производным. Эйкозаноиды состоят из простагландинов (PG), тромбоксанов (TX), лейкотриенов (LT) и липоксинов (LX). Все эйкозаноиды действуют локально в месте синтеза через рецептор-опосредованные сигнальные пути.
Простагландин A2, или медуллин (PGA2), – эндогенный метаболит, полученный из арахидоновой кислоты. В высоких концентрациях проявляет антипролиферативную активность. Согласно полученным данным, содержание PGA2 в СК группы КММВ было в 3,0 раза выше, чем в группе контроля, а содержание его метаболита (S-(PGA2)-glutathione) –в 3,8 раза ниже.
2,3-Динор-тромбоксан B2 – метаболит тромбоксана B2. Его экскреция с мочой изучена у пациенток в программах ВРТ и имеет важное прогностическое значение в отношении наступления беременности [43, 44], однако влияние тромбоксана и его метаболитов на развивающийся эмбрион на сегодняшний день изучено недостаточно [45, 46]. Согласно полученным данным, содержание 2,3-динор-тромбоксана B2 в СК группы КММВ было в 2,5 раза выше, чем в группе контроля.
20-гидрокси-простагландин E2 – метаболит простагландина E2. В литературе описана значимая роль простагландина E2 в возобновлении мейоза ооцитов и экспансии кумулюса. Изучено его положительное влияние на поглощение глюкозы развивающимся эмбрионом, качество бластоцисты, а также – антиоксидантное действие [47–49]. Согласно полученным данным, содержание 20-гидрокси-простагландина E2 в СК группы КММВ было в 2,5 раза выше, чем в группе контроля.
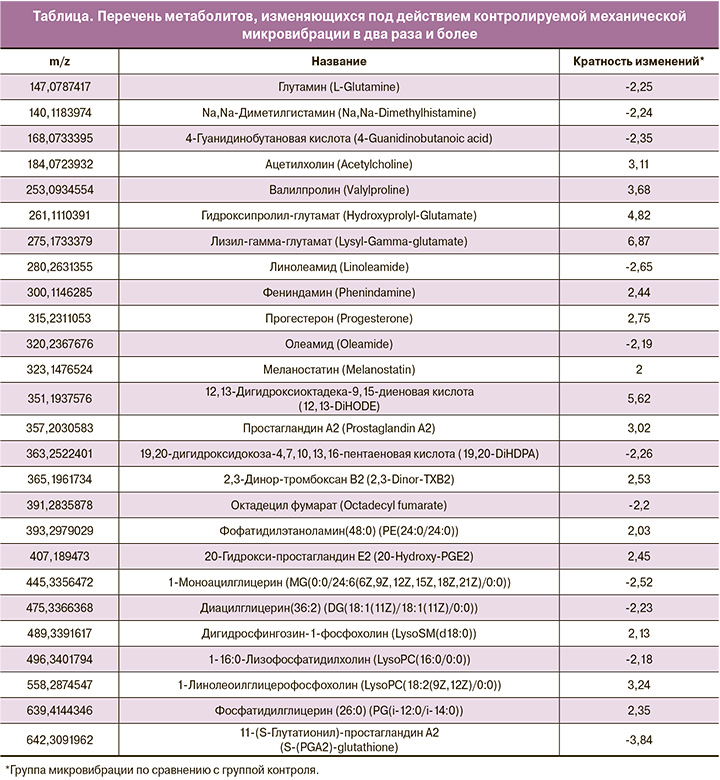
Проведенный анализ метаболических путей позволил выявить два наиболее значимых (рис. 2) – путь биосинтеза фосфолипидов, входящих в состав всех клеточных мембран, и путь метаболизма фенилацетата, отвечающий в первую очередь за выведение азотистых оснований при метаболизме аминокислот.
Обсуждение
Культивирование эмбрионов в условиях КММВ является новым подходом к оптимизации условий культивирования эмбрионов человека в программах ВРТ, направленным на приближение условий культивирования к естественным. Тем не менее влияние КММВ на преимплантационное развитие эмбриона человека и отдаленные исходы изучено недостаточно.
Наиболее благоприятным завершением программы ВРТ является селективный перенос одного эмбриона в полость матки, однако морфологической оценки может быть недостаточно для выбора эмбриона с максимальным имплантационным потенциалом. Метаболическое профилирование является многообещающим инструментом дополнительной оценки качества и имплантационного потенциала эмбриона человека в программах ВРТ [33]. В данной работе мы изучили влияние КММВ на профиль метаболитов СК эмбрионов человека, выявили 30 метаболитов различия, а именно: липиды и липидоподобные молекулы (17), органические кислоты и их производные (6), азотсодержащие органические соединения (2), бензеноиды (1).
Выявленные молекулы относились в основном к регуляторным молекулам (прогестерон, ацетилхолин, олеамид, простагландин A2 и его конъюгат с глутатионом, 2,3-динор-тромбоксан B2 и 20-гидрокси-простагландин E2), аминокислотам и их метаболитам (глутамин, гидроксипролил-глутамат, лизил-гамма-глутамат). Многие из них обладают доказанным действием на развитие эмбрионов человека и млекопитающих, роль других остается малоизученной.
Проведенный анализ метаболических путей свидетельствует о влиянии КММВ на биосинтез фосфолипидов и метаболизм фенилацетата. Фосфолипиды входят в состав всех клеточных мембран, поэтому активация их синтеза является крайне важной для постоянно дробящегося и развивающегося эмбриона. Метаболизм фенилацетата отвечает в первую очередь за выведение азотистых оснований при метаболизме аминокислот, являющихся основным источником энергии при культивировании эмбриона в лаборатории ВРТ.
Заключение
Выявлено значительное влияние КММВ на профиль метаболитов в СК эмбрионов человека 5-х суток развития. Дальнейшие исследования должны быть направлены на анализ влияния выявленных различий на наступление беременности, ее течение и перинатальные исходы.



