Криоконсервация эмбрионов значительно расширила клинические возможности и преимущества лечения бесплодия в циклах вспомогательных репродуктивных технологий (ВРТ).
В настоящее время криоконсервация является широко распространенным, безопасным, экономически целесообразным методом увеличения кумулятивной частоты наступления беременности [1, 2]. Частота переносов криоконсервированных эмбрионов по отношению к общему количеству циклов экстракорпорального оплодотворения (ЭКО) в разных странах варьирует от 2,5% до 50%, что может быть обусловлено степенью оснащения клиник, финансовой, моральной, этической стороной вопроса, а также особенностями законодательства [3, 4]. В стандартной практике проведения ЭКО в 60% случаях после переноса эмбриона остаются «лишние» эмбрионы, подходящие для криоконсервации. С другой стороны, при отмене переноса «свежих» эмбрионов в лечебном цикле по различным причинам целесообразно проведение криоконсервации и хранение эмбрионов с целью их отсроченного переноса [5–7].
Увеличивается число циклов «отсроченного» материнства, когда супружеские пары осуществляют витрификацию полученных эмбрионов для достижения беременности через определенный период времени. Растет число циклов ВРТ с проведением различных методов преимплантационного генетического тестирования (ПГТ). В связи с увеличением эффективности циклов ЭКО в течение последних десятилетий для категории пациенток с «хорошим» прогнозом эффективности ВРТ нет необходимости проводить повторные циклы суперовуляции, если при первом цикле ЭКО получено достаточное количество эмбрионов хорошего морфологического качества [3, 5, 7]. Все вышеперечисленное делает циклы переноса размороженных эмбрионов (РЭ) неотъемлемой частью современной репродуктивной медицины.
Эмбриологический этап в программах переноса РЭ в большинстве случаев унифицирован с помощью стандартных операционных процедур, выработанных в клинике ВРТ. Однако вспомогательные методы работы с эмбрионами человека, такие как лазерный или ферментативный хетчинг, культивирование в среде с гиалуроновой кислотой, использование различных сред для размораживания эмбрионов, не имеют четких клинических показаний к использованию.
Вопрос о целесообразности пролонгирования культивирования эмбрионов (более 144 ч после оплодотворения) также остается предметом дискуссии [2, 8]. По мнению многих авторов, эмбрионы, сформировавшие бластоцисту на 6-е сутки и позже, имеют гораздо более низкую частоту имплантации [4, 6, 8]. Однако часто у супружеских пар нет эмбрионов, соответствующих стадии бластоцисты на 5-е сутки культивирования, что вызывает необходимость дальнейшего изучения данной проблемы.
Чаще всего в клинической практике РЭ культивируются в течение 2 ч перед переносом. Однако существуют данные, что размораживание эмбриона вечером в день, предшествующий дню переноса эмбриона, может быть более эффективным методом в клинической практике [8].
Все вышеизложенное требует проведения дальнейших исследований применения вспомогательных эмбриологических методик в программах переноса РЭ.
Цель работы – определить клинические и эмбриологические факторы, влияющие на эффективность программ ВРТ с переносом РЭ.
Материалы и методы
В ретроспективное исследование случай-контроль были включены 288 супружеских пар, обратившихся для лечения бесплодия в период с 2017 г. по 2019 г. в отделение вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России (руководитель – проф. Калинина Е.А.), с отсутствием противопоказаний к проведению ЭКО, подписанным информированным согласием на участие в исследовании. Критериями включения явились: нормальный кариотип обоих супругов, отсутствие выраженной патозооспермии (100% тератозооспермия, абсолютная астенозооспермия, все виды азооспермии), наличие витрифицированных эмбрионов. Критериями исключения явились использование донорских гамет или суррогатного материнства, а также отмена переноса РЭ в данном цикле по любым причинам.
Пациенты были стратифицированы на две группы, в зависимости от наступления клинической беременности в изученном цикле РЭ: группа 1 (беременность +, n=92) и группа 2 (беременность -, n=196).
Все включенные в исследование супружеские пары были обследованы согласно приказу Минздрава России №107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [9].
Оплодотворение ооцитов в цикле, в котором осуществляли витрификацию эмбриона, проводили различными методами: инсеминация ооцитов in vitro («классическое» ЭКО, далее ЭКО как метод оплодотворения), интрацитоплазматическая инъекция сперматозоида в ооцит (ИКСИ), физиологическая интрацитоплазматическая инъекция сперматозоида в ооцит (ПИКСИ). В качестве культуральных сред для витрификации/размораживания эмбрионов использовали коммерческие культуральные среды Kitazato и Irvine, для размораживания эмбрионов также использовали коммерческие культуральные среды Z-REV. Размораживание эмбрионов проводили за 2–3 ч до переноса эмбрионов или вечером в день, предшествующий дню переноса. Качество эмбрионов оценивал эмбриолог с помощью метода световой микроскопии, согласно общепринятой классификации Гарднера [10]. У части пациенток был проведен перенос эмбриона после ПГТ на анеуплоидии (ПГТ-А). Показаниями для ПГТ-А были: поздний репродуктивный возраст, привычный выкидыш, неудачные циклы ВРТ в анамнезе. Вспомогательный хетчинг проводили с использованием лазерного микроманипулятора или путем полного удаления блестящей оболочки. В части циклов осуществляли перенос РЭ в культуральной среде, обогащенной гиалуроновой кислотой (Embryoglue).
Подготовка эндометрия для переноса криоконсервированных эмбрионов проводилась с использованием циклической гормональной терапии (эстрогены+гестагены) или в спонтанном овуляторном менструальном цикле. Мониторинг состояния эндометрия и фолликулогенеза осуществляли с помощью ультразвукового исследования в динамике. Перенос эмбрионов осуществляли на 7-е сутки после пика эндогенного ЛГ в спонтанном цикле или на 5–6-й день приема препаратов прогестерона в цикле с использованием циклической гормональной терапии. Для переноса эмбриона в полость матки использовали мягкие катетеры (COOK) или катетеры для «сложных» переносов эмбриона с металлическим проводником (TDT). Осложнением переноса считали наличие крови в катетере, а также необходимость использования пулевых щипцов для прохождения цервикального канала.
Ведение посттрансферного периода осуществлялось согласно принятым в клинической практике протоколам. Через 14 дней после переноса эмбриона в полость матки определялась концентрация β-субъединицы хорионического гонадотропина в сыворотке крови пациентки. При визуализации сердцебиения эмбриона через 5 недель после переноса эмбриона регистрировали клиническую беременность, после чего производили стратификацию пациенток.
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Для определения нормальности распределения использовали критерий Шапиро–Уилко. Данные с нормальным распределением представлены как среднее значение (стандартное отклонение).
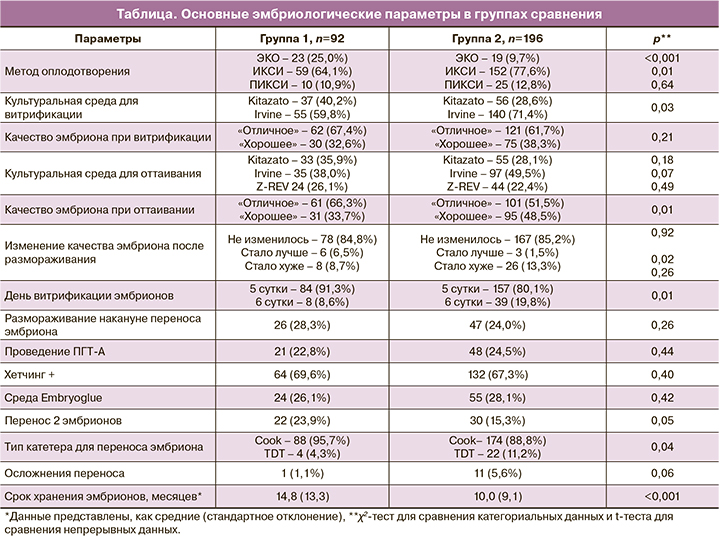
Определяли влияние различных методов работы с эмбрионами на частоту наступления клинической беременности, параметры указаны в таблице. При оценке массива данных не учитывали оператора протокола, не была произведена стратификация по производителю препарата и клиническим параметрам цикла овариальной стимуляции.
Объем выборки определялся количеством изученных факторов. Учитывая то, что максимальное число предикторов, включенных в модель, не должно быть больше, чем число исходов, деленное на значение от 5 до 20, для изучения 13 факторов риска необходимо включить минимум 65 человек в каждую группу.
Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, t-теста для сравнения средних величин. Мерой ассоциации для сравнения бинарных данных было отношение шансов (ОШ) с доверительным интервалом 95% (95% ДИ). Различия между статистическими величинами считали статистически значимыми при уровне р>0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России.
Результаты
В исследование были включены 288 пациенток, проходивших цикл переноса РЭ в ФГБУ НМИЦ АГП с января 2017 по март 2019 гг. Средний возраст пациенток составил 33,5 (4,6) года. Частота наступления клинической беременности составила 31,9% (n=92) соответственно, были сформированы 2 группы пациенток: группа 1 (беременность +, n=92) и группа 2 (беременность -, n=196).
Для выявления возможных конфаундеров была проведена оценка клинико-анамнестических пациенток в группах сравнения. Средний возраст и средний индекс массы тела пациенток не различались в группах сравнения (р>0,05). Между группами не было различий по менструальной функции, гинекологической и соматической заболеваемости, особенностям акушерского анамнеза. При оценке особенностей стимуляции суперовуляции в группах сравнения не отмечено различий в суммарной дозе гонадотропинов и длительности стимуляции. Число циклов ВРТ в анамнезе было погранично значимо выше в группе 2 (1,9 (1,3)) по сравнению с группой 1 (1,6 (0,9)); р=0,07. Основные параметры клинического этапа подготовки эндометрия (тип препарата для циклической гормональной терапии, доза препаратов, использование адъювантной терапии) были сравнимы в группах. Под адъювантной терапией понимали назначение антиагрегантов (ацетилсалициловая кислота 75–100 мг/сутки ежедневно). Средняя толщина эндометрия статистически значимо не различалась в группах сравнения (в группе 1 – 9,6 (0,9), в группе 2 – 9,8 (0,7); р>0,05).
Далее была проведена оценка эмбриологического этапа и особенностей процедура переноса эмбрионов (таблица). В группе 1 чаще производили оплодотворение методом ЭКО (25,0% и 9,7%; р=0,0031) и реже – методом ИКСИ (64,1% и 77,6%; р=0,01). Полученные различия можно объяснить тем, что метод «классического ЭКО» чаще применяется при нормозооспермии у партнера, а также при наличии благоприятного прогноза программ ВРТ.
У пациенток в группе 1 чаще использовали культуральную среду Kitazato (40,2% против 28,6%) и реже – культуральную среду Irvine (59,8% против 71,4%; р=0,03). При этом частота использования различных сред для оттаивания эмбрионов не различалась в группах сравнения.
Во всех случаях осуществлялись витрификация и размораживание эмбрионов хорошего морфологического качества. Тем не менее для осуществления статистического анализа мы условно разделили эмбрионы на «отличные» (6АА, 5АА, 4АА, 3АА по классификации Гарднера) и «хорошие» (3-6 АВ, 3-6ВА, 3-6 ВВ по классификации Гарднера). Интересно отметить, что качество эмбрионов при витрификации было сравнимо между группами, при этом качество эмбрионов при оттаивании различалось в группах: так, в группе 1 было 66,3% эмбрионов «отличного» качества, по сравнению с 51,5% – в группе 2 (р=0,01).
В большинстве случаев качество эмбрионов при витрификации и при размораживании не отличалось, однако в 9 случаях после размораживания наблюдали улучшение качества эмбриона, в 34 случаях – ухудшение качества эмбриона. У пациенток группы 1 чаще наблюдали улучшение качества эмбриона после размораживания (6,5% против 1,5%; р=0,02). Отношение шансов (ОШ) наступления клинической беременности при улучшении качества эмбриона после оттаивания составило 4,49 (95% ДИ 0,93–28,2).
Согласно полученным данным, улучшение морфологического качества эмбриона после размораживания можно считать благоприятным предиктором эффективности ВРТ. Напротив, ухудшение морфологического качества эмбрионов не влияет на эффективность ВРТ и не является основанием для отмены переноса РЭ/размораживания дополнительных носителей.
В группе 1 наблюдали меньшую долю эмбрионов, витрифицированных на 6-е сутки, по сравнению с группой 3 (8,6% против 19,8%; р=0,01). В 99 случаях размораживание эмбрионов осуществляли за 12 ч до переноса эмбриона, что не влияло на частоту наступления беременности (p>0,05).
Проведение ПГТ-А на эмбрионе, а также использование дополнительных эмбриологических методик (вспомогательный хетчинг, использование культуральной среды, обогащенной гиалуроновой кислотой) не увеличивали частоту наступления беременности в общей когорте пациенток (p>0,05). Частота переноса двух эмбрионов в полость матки была погранично значимо выше в группе 1 (23,9% против 15,3%; р=0,05).
В группе 2 для переноса эмбриона в полость матки чаще использовали катетер с металлическим проводником (11,2% против 4,3% в группе 1, р=0,0412), что можно объяснить негативным влиянием так называемых «сложных переносов» на эффективность ВРТ.
Интересно отметить, что средняя длительность хранения эмбрионов от дня витрификации до дня размораживания была выше в группе 1 (14,8 (13,3) месяца в группе 1 против 10,0 (9,1) в группе 2; р<0,01). Вероятно, длительность хранения эмбрионов связана с паритетом пациенток: так, пациентки, у которых наступила беременность после первого цикла ЭКО, хранят свои эмбрионы дольше по сравнению с пациентками, у которых беременность после ЭКО не наступила. Для подтверждения данной гипотезы провели анализ длительности хранения эмбрионов в зависимости от паритета: в подгруппе пациенток, имеющих беременности после ВРТ, длительность хранения эмбрионов была выше по сравнению с пациентками, у которых не было беременностей после ВРТ (15,3 (12,5) месяца против 7,5 (6,0) месяца; р<0,001). Результаты данного этапа представлены в таблице.
Обсуждение
Одной из современных тенденций циклов вспомогательной репродукции является повышение числа переносов РЭ, что диктует необходимость дальнейшего изучения данной проблемы. Большинство исследователей считают, что эффективность переноса РЭ в целом выше по сравнению с переносом в «свежем» менструальном цикле [5–7]. Различия в эффективности переноса нативных и криоконсервированных эмбрионов можно объяснить отсутствием негативного влияния суперфизиологических уровней стероидных гормонов на эндометрий, а также тем, что для витрификации отбираются только эмбрионы хорошего морфологического качества.
Согласно полученным результатам, оплодотворение ооцитов методом ЭКО положительно влияет на частоту наступления клинической беременности, что соотносится с данными литературы. Оплодотворение методом ЭКО проводится только у супружеских пар с «благоприятным прогнозом», т.е. при нормозооспермии или субфертильной сперме, без неэффективных циклов ВРТ в анамнезе, а необходимость использования ИКСИ может быть продиктована как наличием патозооспермии, так и планированием биопсии эмбриона для ПГТ-А.
Интересно, что на частоту наступления беременности оказывает влияние морфология эмбриона не на момент витрификации, а при размораживании. Аналогичные данные представлены в работе австрийских исследователей [11], в которой морфология эмбриона при витрификация не влияла на исходы ВРТ. Хотя витрификация эмбрионов на 6 сутки культивирования оказывала негативное влияние на частоту наступления клинической беременности в нашем исследовании, мы считаем целесообразным осуществлять витрификацию бластоцист «не отличного» морфологического качества и пролонгированное культивирование бластоцист, особенно при отсутствии других эмбрионов.
Вспомогательный хетчинг и перенос эмбриона в культуральной среде, обогащенной гиалуроновой кислотой, не оказывали эффекта на частоту наступления клинической беременности в общей категории пациенток. Относительно влияния вспомогательных эмбриологических методик на эффективность переноса РЭ существуют различные точки зрения [12–14]. Дальнейшие исследования будут направлены на поиск категорий пациенток, в которых использование данных методик повышает эффективность ВРТ.
Использование катетеров для «сложного» переноса эмбриона оказывало негативное влияние на эффективность ВРТ. Полученные данные не соотносятся с данными литературы [15]. Возможным объяснением может быть повышенная вероятность повреждения эндометрия при осложненных переносах эмбриона, при которых чаще используются катетеры с металлическим проводником.
Ограничениями настоящей работы являются отсутствие анализа влияния оператора протокола переноса РЭ, отсутствие учета данных о цикле стимуляции.
Заключение
Получены данные, свидетельствующие, что основными предикторами наступления беременности при переносе РЭ являются: качество эмбриона при оттаивании, витрификация эмбрионов на 5-е сутки культивирования, а также оплодотворение методом ЭКО.



