Рак молочной железы (РМЖ) продолжает занимать одну из ведущих позиций среди всех злокачественных опухолей женщин в России и в мире. Общее число пациенток, находившихся на учете в Российской Федерации в 2016 г. с диагнозом РМЖ, составило 642 720 (435,6 на 100 тысяч населения), за последние 10 лет заболеваемость злокачественными новообразованиями МЖ выросла более чем на 33,1% [1].
Эхография остается одним из наиболее распространенных и доступных методов лучевой визуализации МЖ. Чувствительность ультразвукового исследования (УЗИ) в дифференциальной диагностике доброкачественных и злокачественных образований молочных желез колеблется в пределах 95,0–98,4%, специфичность – 42–59% [2–5].
Использование новейших технологий и методик мультипараметрической эхографии, дуплексного (триплексного) исследования, мультипланарного сканирования, ультразвуковой эластографии, применение эхоконтрастного препарата (ЭКП) значительно расширяют возможности метода [6–9].
В рекомендациях по внепеченочному применению ультразвуковых контрастных препаратов 2017 г. отмечено, что ультразвуковое исследование с контрастированием (КУУЗИ) МЖ в настоящее время находится на этапе активного научного исследования и не может быть рекомендовано для рутинной клинической практики, поэтому происходит набор и анализ качественных и количественных данных, полученных при КУУЗИ МЖ [10, 11]. Изучение ангиогенеза в узловых образованиях МЖ является актуальным для диагностических целей и с целью оптимизации лечения. ЭКП улучшают возможности визуализации и фиксации сосудистого рисунка, оценки его характера, детализации фаз накопления и выведения [5, 8].
По данным метаанализа Q. Li и соавт. [8], добавление контрастирования в УЗИ МЖ в В-режиме статистически значимо повышает чувствительность дифференциальной диагностики опухолевой патологии МЖ с 0,86 до 0,94 (95% ДИ 0,82–0,89 против 95% ДИ 0,92–0,96), специфичность – с 0,80 до 0,86 (95% ДИ 0,76–0,84 против 95% ДИ 0,82–0,89). По данным Wubulihasimu M. и соавт. [9], чувствительность КУУЗИ в дифференциальной диагностике образований МЖ не отличалась от исследования в В-режиме (p=0,29), но специфичность КУУЗИ значительно превосходила B-режим (p<0,01).
В отечественной литературе не обнаружено публикаций, анализирующих результаты качественных и количественных характеристик КУУЗИ в диагностике опухолевых заболеваний МЖ.
Материалы и методы
В основу работы положены результаты исследования данных КУУЗИ 145 женщин с узловыми образованиями МЖ в возрасте 17–74 лет (средний возраст составил 45,8 года) в период с декабря 2017 г. по декабрь 2018 г.
Пациентки были разделены на 2 группы. В 1-ю группу были включены 82 пациентки с диагнозом РМЖ в возрасте 34–71 год (средний возраст 52,4 года). 0 стадия выявлена у 4 (4,8%) пациенток, I стадия – у 30 (36,6%), у 34 (41,5%) пациенток РМЖ выявлен на II стадии, в 13 (15,9%) случаях обнаружена III стадия и в 1 случае – IV стадия РМЖ (множественные метастазы в печень). В 12 случаях выявлена мультицентрическая (мультифокальная) форма РМЖ (2 и более узла). По гистологической структуре преобладал инвазивный рак неспецифического типа (протоково-дольковый) – 63,4%. 74 пациентки прооперированы в отделении патологии молочной железы ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, в 8 случаях комплексное лечение начиналось с лекарственной терапии. Всем пациенткам перед началом лечения выполнялась core-биопсия узлового образования с морфологическим и иммуногистохимическим исследованием биоптата.
Во 2-ю группу были включены 63 пациентки с доброкачественными новообразованиями МЖ. Возраст пациенток с узловой формой мастопатии составил от 17 до 69 лет (средний возраст 37,8 года). Фиброаденома верифицирована у 43 (68,2%) пациенток, у 18 (28,6%) – узловая форма фиброзно-кистозной мастопатии (ФКМ), в 2 (3,2%) случаях – абсцедирование лактационного мастита. Хирургическое лечение в объеме секторальной резекции МЖ выполнено 50 пациенткам, в 2 случаях абсцедирования лактационного мастита выполнено вскрытие и дренирование абсцесса, у 11 пациенток – только морфологическая верификация (ТАБ или core-биопсия образования), и они оставлены под динамическое наблюдение.
КУУЗИ проводили на сканерах DC-8 (Mindrаy, Китай) с использованием линейных мультичастотных датчиков, работающих в диапазоне частот 7,5–15,0 МГц, в специализированном режиме Cоntrast с низким механическим индексом (МИ<0,10). В качестве ЭКП использовался гексафторид серы Sonovue (Соновью, Bracco, Италия) – гос. регистрация №20-2-404006/Р/РЛП-У от 05.08.2013 г. МЗ РФ в объеме 2,4 мл.
Исследование проводилось в два этапа. На первом этапе всем 145 пациенткам было проведено мультипараметрическое УЗИ МЖ с применением серошкальной, цветокодированной эхографии, эластографии (компрессионной и сдвиговой волной). Проводились оценка и интерпретация обнаруженных в МЖ узловых образований и последующий выбор категории US BI-RADS по совокупности выявленных эхографических признаков (количество, расположение, качественные характеристики структуры, четкость контуров, васкуляризация, состояние окружающих тканей, состояние регионарных лимфатических узлов).
На втором этапе при соблюдении единых требований асептики для проведения малоинвазивных манипуляций, после получения письменного согласия пациентки на проведение процедуры, проводилась процедура КУУЗИ. Через периферический венозный катетер 20G внутривенно болюсно в кубитальную вену вводили ЭКП в объеме 2,4 мл с последующим введением 5 мл 0,9% раствора NaCl. Одновременно с введением ЭКП начинался отсчет времени, запись видеопетли (не менее 120 с) с ее архивированием в памяти УЗ-сканера.
На этапе постобработки выполнялся качественный и количественный анализ с помощью программного аппаратного обеспечения «Contrast QA». К анализу принимались сегменты кинопетли от момента поступления ЭКП в венозное русло до момента его полного вымывания (объект интереса находился в зоне сканирования в течение всего времени исследования, не менее 120 с).
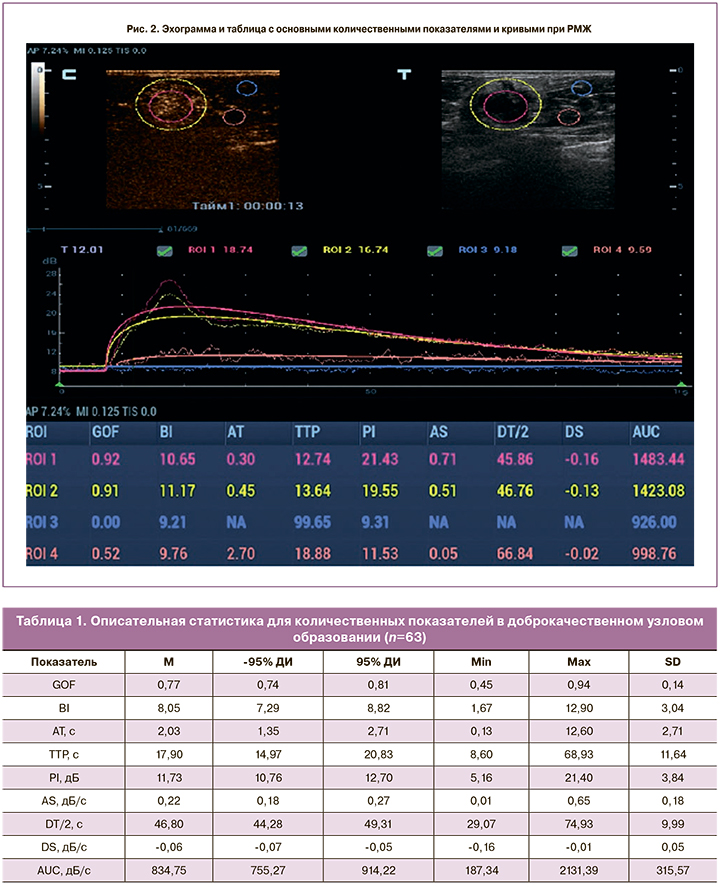
Количественная оценка параметров контрастного усиления узлового образования и паренхимы МЖ проводилась на основании соотношения времени и интенсивности накопления и распределения ЭКП. В узловом образовании выделялись зоны интереса диаметром 4–7 мм (ROI 1).
При оценке качественных характеристик КУУЗИ в 65,8% злокачественных и в 25% доброкачественных узловых образованиях размеры опухоли оказались больше, чем в В-режиме, поэтому для получения количественных характеристик контрастирования окружающих тканей вторая зона интереса (ROI 2 диаметром 4–7 мм) была в перитуморальной паренхиме на расстоянии 5–9 мм от края узлового образования. При соблюдении вышеописанных условий проведения исследования анализ полученных кривых производился автоматически и отображался на экране в виде таблиц (рис. 1–2).
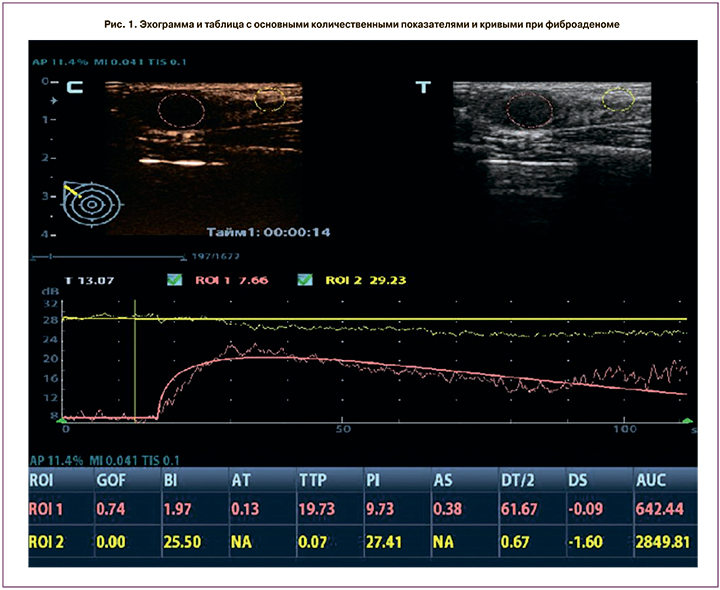
Нами оценивались следующие количественные характеристики:
- соответствие (Goodness of Fit, GOF): расчет степени соответствия кривой; диапазон 0–1, где 1 означает, что кривая точно соответствует исходным данным;
- интенсивность фона (Base Intensity, BI): фоновая интенсивность в отсутствие контрастного вещества;
- время появления контрастного усиления (Arrival Time, АТ, с) – момент времени, когда начинает расти интенсивность контрастного усиления;
- наклон при подъеме (Ascending Slope, AS, дБ/с) – скорость нарастания интенсивности контрастного усиления, наклон на участке между начальной точкой перфузии и максимумом;
- время максимума (Time to Peak, TTP, с) – момент времени, когда интенсивность контрастного усиления достигает максимального значения.
- максимум интенсивности (Peak Intensity, PI, дБ) – максимальная интенсивность контрастного усиления;
- время полувыведения (DT/2, с) – время, за которое интенсивность контрастного усиления снижается до половины максимального значения;
- скорость снижения контрастного усиления (Descending Slope, DS, дБ/с) – скорость снижения интенсивности контрастного усиления, наклон кривой при снижении интенсивности контрастного усиления;
- площадь под кривой (Area under the curve, AUC, дБ/с) – площадь под кривой «время–интенсивность».
Первым этапом анализа стало определение соответствия вида распределения количественных признаков закону нормального распределения. Для получения надежной оценки этого соответствия проверялись статистические гипотезы о том, извлечена ли выборка из генеральной совокупности, в которой изучаемый признак имеет стандартное нормальное (Лапласа–Гаусса) распределение. Для принятия решения о виде распределения применялся W-тест Шапиро–Уилка. После этого центральные тенденции и рассеяния количественных признаков, имеющих нормальное и приближенное к нему распределение, описывались средним арифметическим значением и cреднеквадратическим отклонением среднего арифметического значения. Для контроля за соответствием данных допустимым значениям признака выявлялись максимальные и минимальные значения этого признака. Мерой точности оценки среднего арифметического значения в генеральной совокупности на основании данных исследуемой выборки использовались его 95% доверительные интервалы (ДИ). Для ответа на вопросы о степени уверенности, что различия между генеральными совокупностями действительно существуют, использован подход проверки статистических гипотез. При этом метод сравнения определялся несколькими факторами, а именно – числом сопоставляемых групп, зависимостью или независимостью выборок, видом распределения признаков. Принимая во внимание результаты W-теста, проводилась проверка равенства математических ожиданий из двух нормальных совокупностей с одинаковой дисперсией на основе двух выборочных средних и двух выборочных дисперсий из двух независимых выборок, взятых из этих совокупностей (t-критерий Стьюдента). Статистически значимыми считались различия, если полученное значение p для данного критерия (теста) оказывалось ниже критического уровня значимости α=0,05. Технически статистическую обработку результатов исследования проводили с помощью программы Stata/MP версии 14,0 [7].
Результаты и обсуждение
Сводные данные количественных параметров в доброкачественных и злокачественных образованиях представлены в табл. 1–2; данные по количественным параметрам в перитуморальной паренхиме доброкачественных и злокачественных опухолей представлены в табл. 3–4.
С целью поиска различий по учитываемым количественным параметрам контрастного усиления в группах злокачественных и доброкачественных образований МЖ проведено их сравнение (результаты представлены в табл. 5.)
Статистически значимо различающихся параметров в узловом образовании оказалось 8, а именно:
GOF, BI, AS, TTP, PI, DT/2, DS, AUC. Данные количественных показателей в злокачественных узлах статистически значимо выше (GOF 0,84 (0,09), BI 9,30 (3,05), AS 0,40 (0,33) дБ/с, PI 14,72 (3,89) дБ, DS -0,11 (0,10) дБ/с, AUC 1019,88 (336,93) дБ/c) средних значений в доброкачественных узловых образованиях (GOF 0,77 (0,14), BI 8,05 (3,04), AS 0,22 (0,18) дБ/с, PI 11,73 (3,84) дБ, DS 0,59 (0,05) дБ/с, AUC 834,75 (315,57) дБ/c). В доброкачественных опухолях среднее значение показателя ТТР, равное 17,90 (11,64) с, статистически значимо выше среднего значения этого показателя в злокачественных новообразованиях равного 12,18 (6,04) с, при этом вероятность ошибки не превышала 0,001. Среднее значение показателя DT/2 в доброкачественных опухолях также статистически значимо выше, чем в злокачественных узловых образованиях (46,80 (9,99) с и 39,87 (11,23) с соответственно).

По времени прибытия ЭКП (показатель АТ) в доброкачественных и злокачественных узловых образованиях статистически значимых различий выявлено не было.
Максимум интенсивности (PI) достоверно выше в злокачественных опухолях вследствие более высокой скорости кровотока из-за выраженных артерио-венозных шунтов, что характерно для злокачественной неоваскуляризации. Высокие показатели площади под кривой «время-интенсивность» (AUC) могут быть объяснены более высокой концентрацией ЭКП в выраженной сосудистой сети злокачественных опухолей (по данным Du J. [12] микрососудистая плотность статистически значимо выше в злокачественных узловых образованиях).
Кривая «время-интенсивность» в злокачественных узловых образованиях характеризовалась более быстрым (коротким) промежутком TTP, более выраженным (высоким) показателем PI и AUC, более быстрым периодом полувыведения (DT/2).
При анализе количественных параметров в перитуморальной паренхиме (табл. 6) статистически значимо различимыми оказались 3 показателя: GOF, DT/2, DS.
Среднее значение показателя GOF и DS в перитуморальной паренхиме доброкачественных образований (0,68 (0,15) и -0,05 (0,04) дБ/c) статистически значимо выше средних значений этих показателей в злокачественных опухолях (0,58 (0,17) и -0,42 (0,72) дБ/c); среднее значение показателя DT/2, равное 54,18 (18,92) с, в перитуморальной паренхиме злокачественных образований статистически значимо выше, чем в перитуморальной паренхиме доброкачественных новообразований (42,63 (19,48) с), при этом вероятность ошибки не превышала 0,001.
Заключение
Выявленные количественные показатели возможно использовать в дифференциальной диагностике опухолей МЖ. При оценке количественных показателей выявлены статистически значимые различия по восьми параметрам в узловом образовании МЖ (GOF, BI, AS, TTP, PI, DT/2, DS, AUC) и по трем параметрам в перитуморальной паренхиме (GOF, DT/2, DS).
Количественные показатели КУУЗИ тесно коррелируют с плотностью микрососудов и отражают гемодинамические процессы и неоангиогенез в опухоли МЖ. ЭКП второго поколения, на примере «Соновью», размер частиц которых соотносим с размером эритроцитов (2–3 μm), делают возможными визуализацию и оценку микроциркуляции и перфузии, позволяя тем самым исследовать опухолевый ангиогенез in vivo.
Выявленные статистически значимые различия количественных показателей КУУЗИ позволяют констатировать факт, что существуют опорные точки для построения дифференциального ряда между доброкачественными и злокачественными новообразованиями МЖ; для уточнения учитываемых показателей требуется более детальное исследование выявленных закономерностей.



