Известно, что инфекционные заболевания, длительное применение антибактериальной терапии, гормональный дисбаланс, стрессы сопряжены с высокой вероятностью развития дисбиозов слизистой генитального тракта [1]. Одной из таких инфекций является туберкулез, а его длительная химиотерапия (ХТ) может вызывать нежелательные явления, в том числе, со стороны женской репродуктивной системы [2–4]. В последние десятилетия было получено достаточно много фактов о составе и функционировании вагинальной микробиоты у женщин репродуктивного возраста, благодаря широкому внедрению молекулярно-генетических методов исследования: секвенирования генома, полимеразной цепной реакции (ПЦР), ДНК-гибридизации. Эти методы позволили выйти за рамки ограничений «классического» бактериологического посева, многие годы являвшегося золотым стандартом в изучении микробиоты человека [5, 6]. Изучение состояния вагинальной микробиоты у женщин репродуктивного возраста при действии двух агрессивных факторов – активной туберкулезной инфекции и длительной ХТ – не проводилось. Применение инновационных диагностических тест-систем для количественной оценки вагинальной микробиоты у пациенток данной категории в настоящее время является актуальной задачей современной фтизиатрии и гинекологии.
Цель исследования – оценить состояние вагинальной микробиоты у пациенток с туберкулезом органов дыхания (ТОД) в процессе мониторинга ХТ.
Материалы и методы
На базе ФГБНУ «Центральный НИИ туберкулеза» проведено исследование «случай–контроль» 108 женщин репродуктивного возраста с использованием рекомендаций STROBE, где за «случай» (событие) принимали наличие ТОД и проводимой ХТ; контроль – отсутствие ТОД и ХТ. Были сформированы две группы: 1-я группа – 54 пациентки с ТОД и проводимой ХТ; 2-я группа – 54 женщины без ТОД и ХТ (рис. 1). Планируемый объем выборки рассчитывали с использованием нормограммы Альтмана.
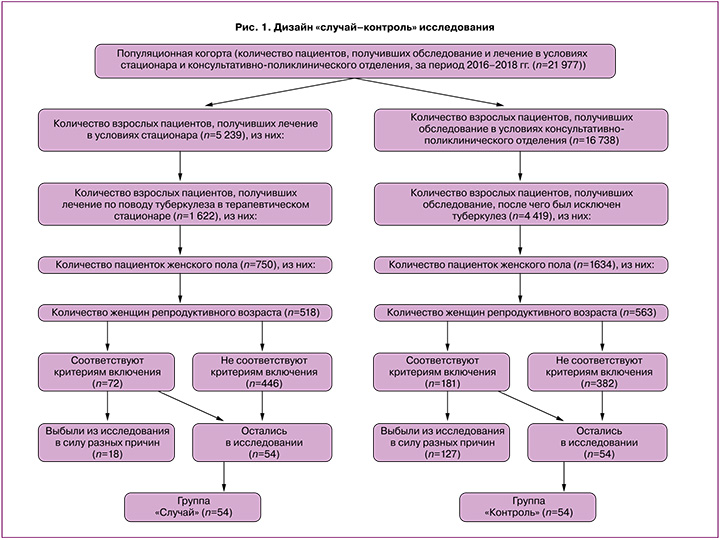
Критериями включения в основную группу явились: репродуктивный возраст, впервые выявленный ТОД, подбор и применение интенсивной фазы ХТ в условиях стационара, отсутствие тяжелых соматических заболеваний; отсутствие заболеваний, передающихся половым путем (ЗППП), и патологических состояний шейки матки, добровольное информированное согласие на участие в исследовании. Критериями включения в контрольную группу явились: репродуктивный возраст, отсутствие ТОД и тяжелых соматических заболеваний; отсутствие ЗППП и патологических состояний шейки матки, добровольное информированное согласие на участие в исследовании. Исследование одобрено Комитетом по этике научных исследований ФГБНУ «ЦНИИТ» (протокол №11 от 21.05.2017). Проведено стандартное исследование, принятое в клиниках фтизиатрического и акушерско-гинекологического профиля; специализированное исследование вагинальной микробиоты с помощью тест-системы «Фемофлор» с ПЦР-детекцией результатов в режиме реального времени и количественной характеристикой 28 условно-патогенных микроорганизмов. Вагинальную микробиоту в основной группе изучали во временных точках – до ХТ, через 60 и 150 дней ХТ; в контрольной группе – однократно. Вагинальный микробиоценоз оценивали с помощью классификации Ворошилиной E.C. и соавт. (2018) [1, 5]. Микроскопические характеристики вагинального биотопа оценивали с помощью классификации Киры Е.Ф., 2019 г. [7].
Статистический анализ
Статистический анализ данных проводили с помощью скриптов на языке программирования R версии 3.5 в среде R Studio. Описательную статистику для качественных признаков приводили в форме абсолютных и относительных частот, для количественных признаков – в форме медианы и верхнего и нижнего квартилей. Сравнение количественных параметров в независимых выборках проводили с помощью критерия Манна–Уитни; качественных признаков – с помощью точного критерия Фишера. Критическим уровнем значимости считали p=0,05. Для сравнения значения параметров в связанных выборках (до и через 60, 150 дней ХТ) использовали критерий Фридмана с критическим уровнем значимости 0,05, при анализе парных различий применяли критерий Вилкоксона с критическим уровнем значимости 0,025 с учетом поправки Бонферрони.
Результаты и их обсуждение
В обеих исследуемых группах превалировали женщины активного репродуктивного возраста – 44 (81%) и 42 (78%); с медианой возраста 29,5 [26,3;36,8] и 32,0 [26,5;33,0] года. Оценка гинекологического анамнеза в обеих группах установила начало менархе с 13 [12;14] и 13 [12;13] лет, со средней длительностью цикла – 28 [22,3;28] и 29 [28;30] дней, продолжительностью менструального кровотечения – 5 [5;5,8] и 5 [5;6] дней, преимущественно регулярным характером менструаций – 46 (85%) и 48 (89%). Возраст начала половой жизни среди обследованных пациенток составил 18 [16,3;19,3] и 19 [18;20] лет. В 1-й и 2-й группах имели беременность в анамнезе – 31 (57%) и 48 (89%) женщин (р≤0,001), с исходом чаще в роды – 27 (87%) и 47 (98%), реже заканчивались медицинским абортом – 10 (32%) и 9 (19%), самопроизвольным выкидышем – 8 (26%) и 13 (27%). Отягощенный гинекологический анамнез регистрировали у 30 (56%) и 17 (31%) пациенток (р=0,019), в структуре патологии преобладали: хронический сальпингит – 15 (50%) и 7 (41%), миома матки – 6 (20%) и 4 (26%), киста яичника – 6 (20%) и 6 (35%), эндометриоз – 4 (13%) и 6 (35%).
Среди пациенток с ТОД, по сравнению с женщинами без ТОД, отмечали социальную неустроенность (отсутствие постоянной работы, необеспеченность финансовыми и жилищными условиями) – 39 (72%) и 25 (46%) (р=0,011). Отягощенность соматического анамнеза регистрировали у 28 (52%) пациенток 1-й группы и 15 (28%) женщин 2-й группы (р=0,018).
Тяжесть ТОД определяли с помощью важных показателей – деструкции легочной ткани – 23 (43%) и бактериовыделения – 36 (67%) (р≤0,01). Среди бактериовыделителей определена высокая частота устойчивости возбудителя к противотуберкулезным препаратам – 25 (69%) (р≤0,02); у 17 (47%) пациенток определена множественная лекарственная устойчивость, у 8 (22%) – широкая лекарственная устойчивость. По поводу ТОД пациенткам 1-й группы назначали различные режимы ХТ: I режим – 14 (26%), II режим – 1 (2%), III режим – 0 (0%), IV режим – 18 (33%), V режим – 7 (13%) и индивидуальный режим – 14 (26%).
Проведено исследование вагинальной микробиоты (таблица).

Как видно из таблицы, у пациенток с ТОД до начала ХТ вагинальный микробиоценоз характеризовался превалированием Lactobacillus spp. – 6 [5,7;6,6]. Среди микроорганизмов, формирующих условно-патогенную микрофлору (УПМ), отмечали низкие значения Enterobacteriaceae – 2,2 [2;2,9], Staphylococcus spp. – 2,1 [1,7;2,5], Sneathia spp.+Leptotrichia spp.+Fusobacterium spp. – 1,2 [0;2,5], Megasphaera spp.+Veillonella spp.+Dialister spp. – 2 [0;2,7], Lachnobacterium spp.+Clostridium spp. – 2 [1,8;2,5], Mobiluncus spp.+Corynebacterium spp. – 2,6 [2,1;2,9], Peptostreptococcus spp. – 2 [0;2,8], а также отсутствие Gardnerella vaginalis – 0 [0;2], Atopobium vaginae – 0 [0;1,4], Mycорlasma hominis – 0 [0;0]; Mycорlasma genitalium – 0 [0;0]; Ureaplasma (urealyticum+parvum) – 0 [0;1,8] и Candida spp. – 0 [0;2,9]. По мере увеличения сроков лечения (через 60 и 150 дней ХТ) отмечали статистически значимое снижение Lactobacillus spp. – 0 [0;4] и 0 [0;3] (р≤0,0001), постепенное повышение большинства ассоциантов УПМ. Согласно критериям используемой классификации вагинального микробиоценоза [1, 5], состояние микробиоты среди пациенток 1-й группы оценивали как – до ХТ – абсолютный нормоценоз с последующим переходом в умеренный дисбиоз через 60 и 150 дней противотуберкулезной терапии. Изучение вагинальной микробиоты у всех женщин контрольной группы показало наличие абсолютного нормоценоза – 54 (100%), содержание Lactobacillus spp. составило 6 [5,2;6,9].
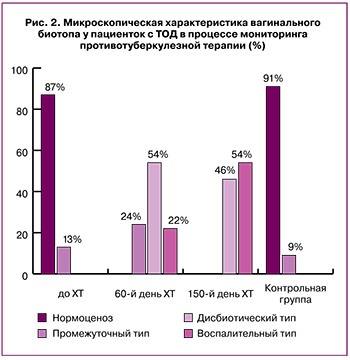 Исследование микроскопической характеристики вагинального биотопа в 1-й группе выявило до начала ХТ нормоценоз и промежуточный тип мазка у 47 (87%) и 7 (13%) пациенток с ТОД. Через 60 дней ХТ нормоценоз не регистрировали – 0 (0%) (р≤0,0001), промежуточный тип составил 13 (24%) (р=0,02), дисбиотический тип – 29 (54%) (р≤0,0001), воспалительный тип – 12 (22%) (р=0,02). Через 150 дней ХТ нормоценоз по-прежнему не выявляли – 0 (0%) (р≤0,0001), отсутствовал промежуточный тип – 0 (0%) (р≤0,0001), дисбиотический и воспалительный типы составили 25 (46%) (р≤0,0001) и 29 (54%). Изучение результатов микроскопии вагинального мазка у женщин контрольной группы показало наличие нормоценоза и промежуточного типа у 60 (91%) и 6 (9%) соответственно, отсутствие дисбиотического и воспалительного типов – 0 (0%) (рис. 2).
Исследование микроскопической характеристики вагинального биотопа в 1-й группе выявило до начала ХТ нормоценоз и промежуточный тип мазка у 47 (87%) и 7 (13%) пациенток с ТОД. Через 60 дней ХТ нормоценоз не регистрировали – 0 (0%) (р≤0,0001), промежуточный тип составил 13 (24%) (р=0,02), дисбиотический тип – 29 (54%) (р≤0,0001), воспалительный тип – 12 (22%) (р=0,02). Через 150 дней ХТ нормоценоз по-прежнему не выявляли – 0 (0%) (р≤0,0001), отсутствовал промежуточный тип – 0 (0%) (р≤0,0001), дисбиотический и воспалительный типы составили 25 (46%) (р≤0,0001) и 29 (54%). Изучение результатов микроскопии вагинального мазка у женщин контрольной группы показало наличие нормоценоза и промежуточного типа у 60 (91%) и 6 (9%) соответственно, отсутствие дисбиотического и воспалительного типов – 0 (0%) (рис. 2).
Известно, что противотуберкулезные препараты, подавляя жизнедеятельность микобактерий туберкулеза, оказывают неблагоприятное действие как на макроорганизм в целом, так и на отдельные микроэкосистемы. Развитие нежелательных реакций на применение противотуберкулезных препаратов, как правило, зависит от ряда причин: вида препарата, формы его применения, дозы и длительности лечения, сочетания с другими лекарственными средствами, функционального состояния ряда внутренних органов и систем, характера индивидуальной реактивности, отягощенности аллергического анамнеза [8].
Заключение
Проведенное исследование показало, что у женщин репродуктивного возраста при наличии двух действующих агрессивных факторов – ТОД и проводимой ХТ – нарушается состояние вагинального биотопа – постепенно уменьшается доля Lactobacillus spp. и повышается количество большинства ассоциантов УПМ, что приводит к формированию аэробно-анаэробного дисбиоза. Мы не обнаружили статистически значимой взаимосвязи между развитием вагинального дисбиоза и клинической формой ТОД, тяжестью течения специфического процесса и выбранным режимом ХТ. По-видимому, вагинальная микробиота, равно как и любой другой биотоп человеческого организма, регулируется индивидуальными механизмами генетической и иммунологической защиты. Поэтому необходимо продолжать дальнейшие исследования в этом направлении.



