Материнский микробиом признан ключевой детерминантой ряда важных показателей здоровья матери и ребенка, и вместе с другими перинатальными факторами представляет собой базовый аспект фетального программирования [1].
Микробиота кишечника играет плюрипотентную и не до конца изученную роль в норме и при различных патологиях, включая, но не ограничиваясь, иммуномодулирующей функцией (КАЛТ – кишечно-ассоциированная лимфоидная ткань) с формированием колонизационной резистентности [2]. Богатый и разнообразный видовой состав кишечной микробиоты (КМ) ассоциирован с высокой резистентностью против патогенной флоры. В исследовании, проведенном в Норвегии, у матерей, родивших преждевременно, отмечалось более низкое количество Bifidobacterium и Streptococcus. Анализ КМ матери с использованием метагеномного подхода также показал связь скудной КМ со спонтанными преждевременными родами (сПР) [3]. С увеличением срока беременности возрастает видовое разнообразие и общая бактериальная масса мекония, что может быть ассоциировано с увеличением длительности материнско-плодового обмена [4].
Согласно современным представлениям, колонизация кишечника новорожденного начинается уже в антенатальном периоде и имеет принципиальное значение в развитии иммунной системы и метаболизма в целом [5]. Господствовавшая ранее догма о стерильности мекония и потенциально возможном исключительно интра- и постнатальном «заселении» кишечника в настоящее время подвергнута сомнению, как и «парадигма стерильной матки» [6, 7].
Большая часть микроорганизмов из огромного видового разнообразия КМ представлена некультивируемыми формами бактерий, которые не удается «вырастить» на питательных средах, выделить в чистую культуру и изучить их свойства [8]. Для систематизации некультивируемых бактерий применяется термин «филотип», характеризующий некультивируемые микроорганизмы, которые известны только по секвенированной последовательности малой субъединицы 16S рибосомальной РНК (16S рРНК) [9]. В метагеномных исследованиях сообществ микроорганизмов, присутствующих в образце (субстрате), наиболее широкое применение получил данный подход, основанный на сравнении нуклеотидных последовательностей гена, ответственного за синтез 16S рРНК [10]. Однако в последние 2–3 года для определения состава микробных сообществ исследователи стали использовать полную последовательность гена 16S рРНК. Это связано, в первую очередь, со способностью платформ NGS (массивное параллельное/высокопроизводительное секвенирование) осуществлять более длинные чтения, при этом этап клонирования исключается; секвенируются непосредственно амплифицированные фрагменты одновременно из десятков образцов биологического материала [11, 12]. Последовательность гена 16S pРНК и его гипервариабельных регионов уже определена у значительного числа бактерий и доступна в базах данных Greengenes, Ribosomal Database Project (RDP), SILVA [12–14].
Цель исследования: изучить профиль КМ родильниц и новорожденных с использованием метода высокопроизводительного секвенирования (NGS) при сПР и своевременных родах (СР).
Материалы и методы
В ходе проспективного исследования обследованы 30 пар мать-новорожденный. Женщины и новорожденные были разделены на две группы в зависимости от срока беременности при родоразрешении. I группу составили 15 пар мать-новорожденный с сПР в 32,8 (2,08) недель, II группу – 15 пар мать-новорожденный со СР, наступившими в 39,5 (0,98) недель.
Всем пациенткам, включенным в исследование, проводился анализ анамнестических и клинико-лабораторных данных: соматический и акушерско-гинекологический анамнез, оценка течения беременности, стандартная панель лабораторных параметров периферической крови, оценка микробного композиционного состава отделяемого нижнего генитального тракта; методы функциональной и фетометрической оценки состояния плода. По завершении беременности были проанализированы методы родоразрешения и перинатальные исходы. У новорожденных проводилась оценка состояния по шкале Апгар после родов, течения раннего и позднего неонатального периодов, анализировались клинико-лабораторные и инструментальные данные.
Критериями включения в группы сравнения и контроля были одноплодная, спонтанно наступившая беременность; для сПР – срок гестации 280–346 недель; а также наличие добровольного информированного согласия пациентки на участие в исследовании и включение специальных методов для научных целей при выполнении стандартных клинических тестов у новорожденного. С целью минимизации влияния конфаундеров в обе группы при проведении исследования не были включены пациентки с тяжелой акушерской (за исключением наличия сПР, поздних выкидышей и привычного невынашивания в анамнезе) и экстрагенитальной патологией; носительницы Streptococcus agalactiae (стрептококк группы B) по результатам культуральной идентификации.
Критериями невключения пациентов являлись: многоплодная беременность, предлежание/врастание плаценты, диагностированные хронические воспалительные заболевания кишечника.
Перед исследованием пациентки подписали добровольное информированное согласие; работа была одобрена комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Изучение видового состава КМ проведено методом NGS с использованием вариабельных регионов V3-V4. Амплификацию выбранного региона проводили с использованием опубликованных праймеров 357F и 806R, выделение ДНК из образцов с использованием набора реагентов ДНК «МЧ-Рапид v2», а амплификацию последовательности гена 16S РНК – с использованием детектирующего амплификатора ДТ-прайм («ДНК-технология», Россия). Оценку качества полученных ампликонов производили в 2%-ном агарозном геле. Качество и концентрацию библиотек ДНК для NGS-секвенирования проверяли с использования прибора Bioanalyzer. Секвенировали на приборе MiSeq (Illumina, USA) на ячейках v2 согласно протоколу производителя. Анализ данных проводили с использованием программного пакета QIMME.
Статистический анализ
Статистический анализ полученных данных проводили с использованием программам GraphPad Prism 8.3 и IBM SPSS Statistics 22. Описание количественных данных, имеющих нормальное распределение, представлено, как среднее арифметическое и стандартное отклонение; при распределении, отличном от нормального, данные представлены в виде медианы и квартилей. Для определения нормальности распределения использовали обобщенные тесты Д'Агостино–Пирсона и Андерсона–Дарлинга, а также критерий Колмогорова–Смирнова и критерий равенства дисперсий Левена (Levene's test). В работе были применены следующие методы обработки данных: критерий Фишера, сравнительный анализ переменных с помощью параметрического t-критерия Стьюдента для несвязанных совокупностей, при отсутствии нормального распределения данных применялись методы непараметрической статистики – U-критерий Манна–Уитни, тест Вилкоксона. Статистически значимыми различиями для всех видов анализа считались различия при p<0,05.
Результаты
В исследование было включено 30 пар мать-новорожденный. Согласно гестационному сроку на момент родов, пары были разделены на две группы (сПР и СР), сопоставимые по возрасту, массо-ростовым показателям и индексу массы тела (ИМТ). Клиническая характеристика пациенток представлена в таблице.
Анализ клинико-анамнестических показателей, представленных в таблице, демонстрирует типичные факторы риска, характерные для сПР. У пациенток с сПР значимо чаще были отмечены предшествующие ранее выкидыши и сПР в анамнезе. Такие факторы, как курение, а также наличие СПКЯ, эндометриоза, миомы матки, гестационного сахарного диабета, преэклампсии и различной экстрагенитальной патологии в обеих группах значимо не различались (р>0,05). Заболевания органов желудочно-кишечного тракта: хронический гастрит и дуоденит, язвенные поражения слизистой желудочно-кишечного тракта, дискинезия желчевыводящих путей и воспалительные заболевания кишечника были статистически значимо чаще отмечены в группе пациенток сПР. Для оценки особенностей питания и характера стула нами проводилось анкетирование пациенток обеих групп. Не найдено значимых различий в особенностях диеты (на выбор предлагалось 5 вариантов): разнообразное питание, в том числе вредные продукты (фастфуд, чипсы и т.д.) (5/15 (33,3%) и 8/15 (53,3%) соответственно, р=0,46); разнообразное правильное питание (10/15 (66,7%) и 5/15 (33,3%) соответственно, р=0,14); исключение углеводов (0/15 и 1/15 (6,7%) соответственно, р>0,99); исключение белков и жиров (не выбрано ни одним респондентом). Нарушения стула по типу гипотонии (констипация) встречались статистически значимо чаще в группе сПР (9/15 (60%) и 2/15 (13,3%), соответственно; р=0,02, ОР 2,59; 95% ДИ 1,29–5,52). Курение (3/15 (20%) и 2/15 (13,3%), соответственно; р>0,99), а также наличие домашних животных (8/15 (53,3%) и 5/15 (33,3%), соответственно; р=0,46) были равномерно представлены в обеих группах.
При анализе течения беременности у пациенток из группы сПР статически значимо чаще был отмечен эпизод угрожающих ПР в III триместре беременности (11/15 (73,3%) и 0/15 (0%), соответственно; р<0,01, ОР 2,67; 95% ДИ 2,13–4,44), а также истмико-цервикальная недостаточность, потребовавшая коррекции (серкляж и/или пессарий; 9/15 (60%) и 1/15 (6,7%), соответственно; р<0,01, ОР 3,00; 95% ДИ 1,54–6,31). Анализ, проведенных кусов антибактериальной терапии за время беременности показал статистически значимую разницу между группами во II триместре (9/15 (60%) и 1/15 (6,7%), соответственно; р<0,01, ОР 3,00; 95% ДИ 1,54–6,31). Основными показаниями для назначения антибактериальной терапии были респираторные заболевания и обильный рост патогенов во влагалище. Вместе с тем при анализе данного показателя в I (2/15 (13,3%) и 0/15 (0%), соответственно; р>0,05) и III (2/15 (13,3%) и 1/15 (6,7%), соответственно; р>0,05) триместрах значимых различий не отмечено.
При сравнительном анализе особенностей родоразрешения, вне зависимости от гестационного срока, преобладающим методом в обеих группах были роды через естественные родовые пути (10/15 (66,7%) и 11/15 (73,3%), соответственно; р>0,05). Частота преждевременного излития околоплодных вод была выше в группе сПР (5/15 (33,3%) и 1/15 (6,7%), соответственно), но не имела статистической значимости (р>0,05).
Для новорожденных, кроме характерных логически обоснованных гестационным возрастом различий, таких, как оценка по Апгар при рождении (7,0 [6; 8] и 8 [8; 8], р<0,01 – на 1-й минуте; 8,0 [7; 8] и 9 [9; 9], р<0,001 – на 5-й минуте) и антропометрических данных (средняя масса тела 2078 (575,0) и 3431 (340,8) г, р<0,001), была отмечена более высокая и статистически значимая распространенность инфекций, специфичных для перинатального периода (10/15 (66,7%) и 0/15 (0%), соответственно; р<0,001, ОР 4,00; 95% ДИ 3,59–6,85). Оценка степени тяжести дыхательных нарушений по шкале Сильвермана у недоношенных новорожденных составила 2,0 [2; 3]. Кроме того, для недоношенных новорожденных была характерна более высокая частота осложнений, обусловленных морфофункциональной незрелостью: респираторный дистресс синдром новорожденного – 10/15 (66,7%), транзиторное тахипноэ – 3/15 (20%), врожденная пневмония – 6/15 (40%), ретинопатия – 2/15 (13,3%).
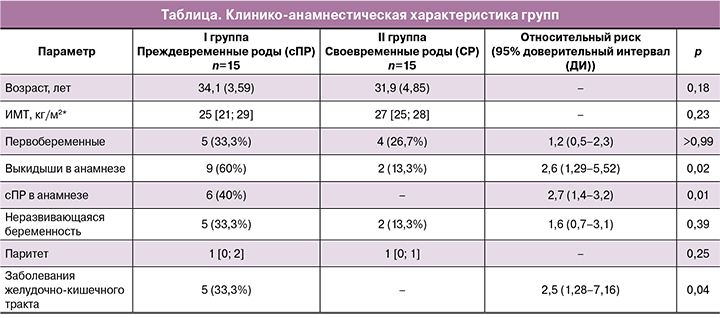
Особенности состава КМ (наиболее представленные виды – более 1%) всех пациентов, включенных в исследование (30 пар мать-новорожденный), отражены на рисунке 1 в виде графика со столбчатыми диаграммами.
Исследования на животных показали возможность вертикальной внутриутробной трансмиссии микробов плоду, что не исключает существование подобных механизмов у людей [5]. В нашем исследовании первородный кал также не был стерильным, среди новорожденных доминирующим микроорганизмами были представители рода Propionibacterium, или пропионовокислые бактерии, которые являются нормальными комменсалами желудочно-кишечного тракта человека. У родильниц ведущими представителями КМ обеих групп были микроорганизмы родов Bifidobacterium (тип Actinobacteria) и представители семейства Lachnospiraceae (спорообразующих бактерий порядка Clostridiales), которые являются наиболее распространенными таксонами микрофлоры кишечника.
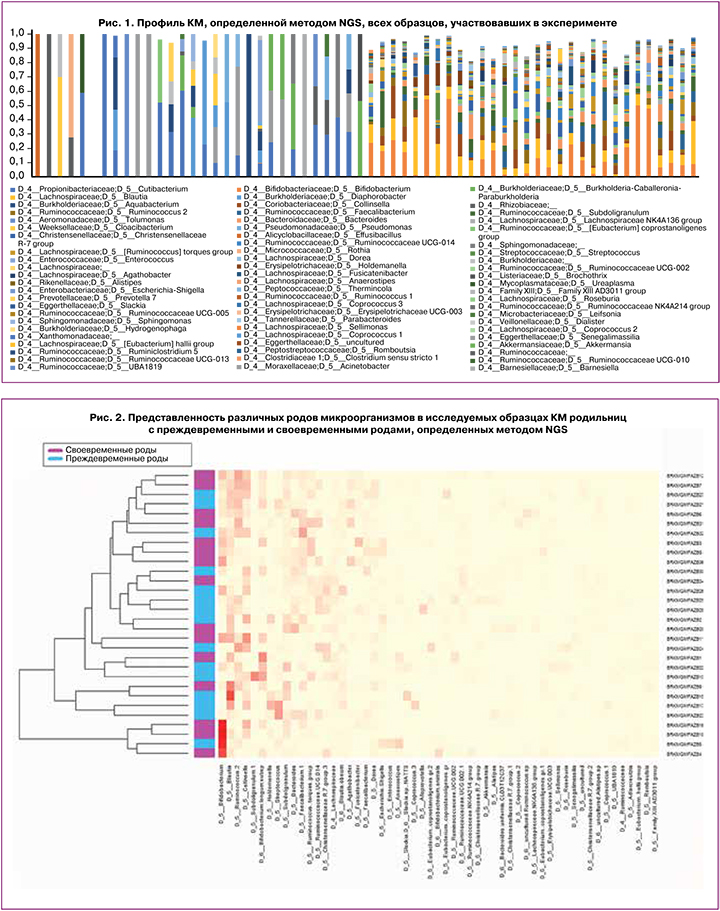
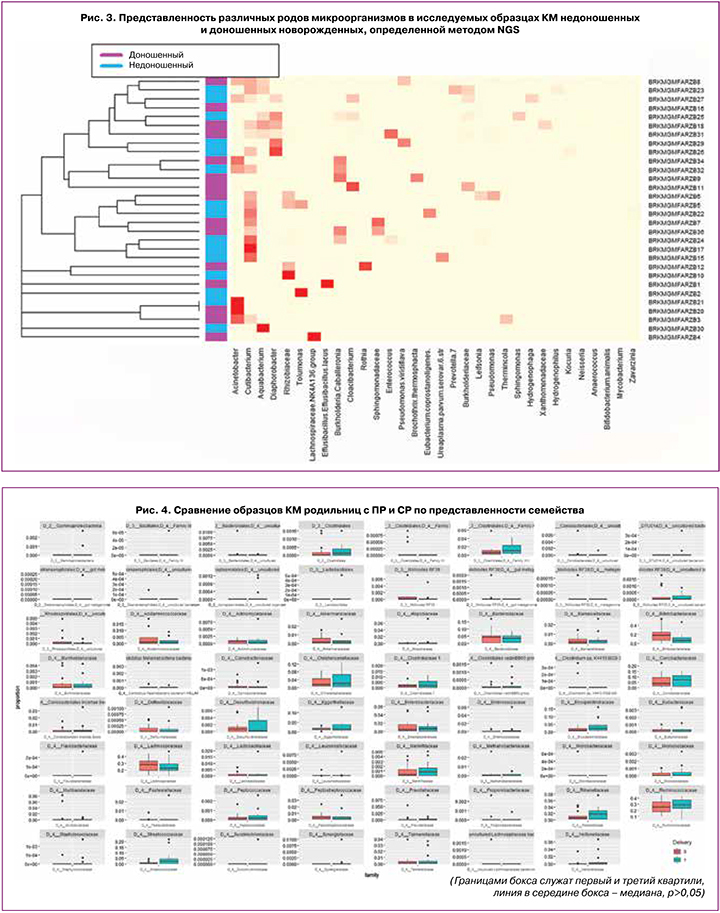
Согласно распространенной гипотезе об участии КМ в формировании больших акушерских синдромов и влиянии на перинатальные исходы [15], участники исследования были разделены на две группы в зависимости от срока беременности на момент родов. Данные секвенирования КМ родильниц с сПР и СР отражены на рисунке 2, доношенных и недоношенных новорожденных – на рисунке 3. Приведены наиболее представленные (встречаемость выше 5,0%) рода бактерий по результатам секвенирования фрагмента последовательности 16S рибосомальной РНК.
Согласно полученным результатам, ведущими представителями КМ обеих групп родильниц были микроорганизмы рода Bifidobacterium (тип Actinobacteria), грамположительные анаэробы, отвечающие за здоровье толстого кишечника человека [16]. Следует отметить, что при одинаковом таксономическом разнообразии для пациенток с сПР было характерно некоторое «обеднение» практически всех представителей нормальной микробиоты.
В меконии новорожденных в наибольшем количестве были отмечены виды Acinetobacter и Cutibacterium (представители семейства Propionibacteriaceae). Acinetobacter – сапрофитный микроорганизм, который обнаруживают у здоровых людей на коже, в кишечнике и в урогенитальном тракте. Долгое время представители Acinetobacter spp. считались малопатогенными, однако позднее было доказано, что при определенных условиях их вирулентность может значительно повышаться и приводить к развитию тяжелых инфекционных процессов, в том числе менингита и сепcиса [17].
Несмотря на многочисленные литературные сведения, подтверждающие связь дисбактериоза с сПР [3, 18, 19], при статистическом сравнении медиан групп родильниц и новорожденных с сПР и СР значимых различий между ними выявлено не было. Отсутствие статистически значимых различий при использовании теста Вилкоксона наблюдается и при использовании метода сравнения групп по представленности семейства у родильниц (р>0,05, отношение медиан от 1,74 до 6,4; рис. 4), что может быть связано с малыми размерами исследуемых выборок.
Обсуждение
Человеческий организм содержит триллионы клеток, большая часть из которых имеет ксенобиотическое происхождение и является микроорганизмами. Проект «Микробиом человека» («The Human Microbiome Project») показал обширность микробного мира, которая долгое время недооценивалась, а также подтвердил множество причинно-следственных связей между микробиотой различных органов и систем и, физиологическими и патологическими состояниями [20]. Метагеномный подход, основанный на использовании высокопроизводительного секвенирования, в настоящее время считается наиболее точным и детальным методом оценки микробиоты, позволяющим идентифицировать ранее неизвестные микроорганизмы с их потенциальной клинической значимостью [11]. Тем не менее, данный метод имеет ряд недостатков и ограничений, в первую очередь, время- и трудозатратность, а также стоимость.
В нашем исследовании не было получено статистически значимых различий в профилях КМ матерей и новорожденных с сПР и СР, что несомненно, не показывает отсутствие патогенетической связи, которая неоднократно была продемонстрирована в англоязычных публикациях [3, 18], и доказана нами в ранее проведенном исследовании, но с использованием культурального метода [19]. Отсутствие статистической значимости, вероятнее всего, обусловлено малочисленностью выборки, что требует продолжения исследований.
Важным результатом нашего исследования следует считать полученные данные, которые доказывают нестерильность мекония и подтверждают теорию о внутриутробной микробной колонизации плода посредством материнско-плодовой трансмиссии [7, 21]. Точный механизм передачи бактерий от матери к плоду неизвестен, однако именно желудочно-кишечный тракт матери на данный момент считают наиболее вероятным источником [22]. Понимание гестационных сроков и механизмов, вовлеченных в первую колонизацию кишечника человека, имеет фундаментальное значение для всестороннего анализа влияния КМ на развитие ребенка в раннем возрасте [5, 21].
Заключение
Микробиота кишечника играет многофункциональную роль, и не ограничивается поддержанием гомеостаза желудочно-кишечного тракта. Во время беременности вместе с другими факторами она оказывает влияние на формирование микробиома новорожденного. Нестерильность мекония, его антенатальная колонизация посредством материнско-плодовой трансмиссии с формированием уникальной микробиоты, должна расцениваться, как новый важный фактор перинатального программирования. За последние два десятилетия секвенирование возглавило революцию в исследованиях микробиома человека. Высокая чувствительность и филогенетическое разрешение метода NGS, а также получаемые в ходе экспериментов новые сведения требуют продолжения его валидирования на больших выборках перед внедрением в клиническую практику.



