Эндометриоз – хроническое системное заболевание, которое характеризуется присутствием функциональной, подобной эндометрию эпителиальной и стромальной ткани вне матки и обычно ассоциируется с воспалительным процессом; часто приводит к хронической тазовой боли, дисменорее, диспареунии и бесплодию; существенно влияет на качество жизни женщин и имеет значительные социально-экономические последствия [1, 2]. Эндометриоз распространен у 5–10% женщин репродуктивного возраста, не имеет патогномоничных признаков и симптомов и представляет серьезную проблему из-за трудностей постановки точного диагноза. Из-за того, что у 45–50% больных эндометриозом отмечается бессимптомное течение заболевания, начало лечения задерживается в среднем на 8–10 лет, это способствует прогрессированию болезни, развитию тяжелых форм и осложнений [1, 3].
В зависимости от подтипов и локализации очагов эндометриоза различают поверхностный перитонеальный эндометриоз, эндометриоидную кисту яичника (эндометриому), глубокий эндометриоз, эндометриоз кишечника, мочевого пузыря, экстра-абдоминальный, ятрогенный эндометриоз, перитонеальный спаечный процесс [4, 5]. Эндометриома – наиболее часто встречающаяся форма эндометриоза у женщин репродуктивного возраста; ее частота среди женщин с установленным диагнозом эндометриоза составляет до 55% [6].
На сегодняшний день золотым стандартом диагностики эндометриоза остается лапароскопическая идентификация эндометриоидных очагов с подтверждением гистологическим исследованием, хотя эта инвазивная процедура имеет ряд ограничений [7]. Диагностические возможности неинвазивных методов, таких как ультразвуковое исследование и магнитно-резонансная томография, являются ограниченными на ранних стадиях эндометриоза. Известные сегодня биомаркеры для неинвазивной диагностики эндометриоза, такие как CA 125, CA 19-9, интерлейкин-6, эндометриальные антитела, ассоциируются с эндометриозом; однако эти тесты не обладают достаточной чувствительностью и точностью обнаружения ранних стадий заболевания [2, 8].
К ключевым факторам этиопатогенеза эндометриоза относятся воспалительный иммунный ответ и дисрегуляция иммунного надзора, способствующая росту эктопических очагов эндометрия [2, 9, 10]. Эндометриоз имеет сходство с аутоиммунными заболеваниями, связанное с наличием аутоантител, высокого уровня цитокинов, терапевтического ответа на иммуномодуляторы, клеточно-опосредованных нарушений и другой сопутствующей аутоиммунной патологии [11]. Такие аутоиммунные заболевания, как системная красная волчанка, фибромиалгия, синдром Шегрена и воспалительные заболевания кишечника, как сообщается, более распространены у пациенток с эндометриозом, чем в общей популяции [12]. Эндометриоз ассоциируется с целым рядом аутоиммунных заболеваний [13]. Дисрегуляция иммунной системы, наблюдающаяся при аутоиммунных заболеваниях и приводящая к изменениям клеточно-опосредованного и гуморального иммунитета, способствует развитию эндометриоза. Кроме того, сопутствующий аутоиммунитет обуславливает более тяжелое течение эндометриоза [14].
В ряде исследований у больных эндометриозом продемонстрировано снижение активности клеток, препятствующих имплантации эндометрия, таких как естественные киллерные клетки, CD4+/CD8+ Т-лимфоциты или B-лимфоциты, и увеличение количества иммуносупрессорных клеток, таких как регуляторные Т-лимфоциты, Th2 (Т-хелперные) клетки и MDSCs (супрессорные клетки миелоидного происхождения), что может способствовать имплантации клеток эндометрия и прогрессированию эндометриоза [10, 12]. Многочисленные исследования предполагают участие в патогенезе эндометриоза В-клеток, продуцирующих аутоантитела, такие как антиэндометриальные, антифосфолипидные (аФЛ), антиядерные (АНА) и анти-ДНК, типичные для других аутоиммунных заболеваний [11, 15]. Однако роль аутоантител и B-клеток в развитии заболевания недостаточно изучена. Характерные для эндометриоза эндокринные нарушения с повышенной продукцией стероидных гормонов могут способствовать развитию аутоиммунных процессов [16].
Аутоантитела к молекулам, играющим важную роль в патофизиологии эндометриоза, в частности к специфическим эндометриальным антигенам (тропомиозину, тропомодулину), гликолитическому ферменту α-енолазе, стероидным гормонам, рассматриваются в качестве перспективных маркеров для неинвазивной диагностики эндометриоза [17, 18]. Более глубокое понимание иммунных аспектов эндометриоза может быть полезно для поиска новых стратегий лечения.
Цель исследования: изучить профиль сывороточных аутоантител у женщин c эндометриоидными кистами яичников и глубоким инфильтративным эндометриозом.
Материалы и методы
Исследуемые группы составили женщины от 20 до 40 лет с эндометриоидными кистами яичников II–IV стадии (группа 1, n=53) и глубоким инфильтративным эндометриозом III–IV стадии без вовлечения яичников (группа 2, n=21). В группу сравнения были включены женщины без эндометриоза (группа 3, n=27). Диагноз эндометриоза был поставлен согласно классификации Американского Общества Репродуктивной медицины на основе лапароскопической идентификации очагов эндометриоза с подтверждением гистологическим исследованием полученного материала. Кровь для определения аутоиммунных маркеров была взята у женщин в пролиферативную фазу менструального цикла.
В исследование не включались пациентки с онкологическими и аутоиммунными заболеваниями, с противопоказаниями для оперативного лечения. Критериями исключения служили острые воспалительные заболевания органов малого таза, инфекционные заболевания, предшествующая гормональная и противовоспалительная терапия в течение последних 3 месяцев до исследования.
Иммунологические методы исследования включали определение аФЛ классов M и G к кардиолипину (КЛ) и β2-гликопротеину-I (β2-ГП-I), АНА класса G с использованием иммуноферментных наборов ORGENTEC Diagnostika (Германия). Определение антител к гормонам (хорионическому гонадотропину человека (ХГЧ), прогестерону (ПГ) и эстрадиолу (Э)) проводили с помощью модификаций непрямого твердофазного иммуноферментного анализа (ИФА), описанных ранее [19, 20]. Антитела к тропомиозину 3 (ТПМ), тропомодулину 3 (ТМОД) и α-енолазе 1 (ЕНО) определяли с применением модифицированных вариантов ИФА с использованием соответствующих рекомбинантных протеинов фирмы Abcam (Великобритания), иммобилизованных на микропланшетах Nunc MaxiSorp (Thermo Scientific Nunc, Дания) в концентрации 2–5 мкг/мл [18, 21]. Образцы сыворотки крови исследовали в разведении 1:100. Оптическую плотность (ОП) измеряли на фотометре MULTISKAN EX (Thermo Electron (Shanghai) Instrument Co., Китай) при длине волны 450 нм. Результат считали положительным, если средняя ОП исследуемого образца превышала среднюю ОП контрольных образцов более чем на два стандартных отклонения (2δ).
Статистический анализ
Полученные данные анализировали с применением пакетов прикладных статистических программ Microsoft Office Excel 2010, MedCalc v. 12. Для оценки нормальности распределения значений в выборках использовали W-тест Шапиро–Уилка и тест Колмогорова–Смирнова. При отклонении от нормального распределения количественные данные представляли медианными значениями (Me) с размахом (min; max), количественные данные анализировали с помощью методов непараметрической статистики. Для сравнения данных в двух группах использовали U-тест Манна–Уитни, в трех группах – тест Краскела–Уоллиса с введением поправки Бонферрони для множественного сравнения. Для представления качественных данных приводили абсолютные (n) и относительные величины (%), различия между ними оценивали с помощью теста χ2. Взаимосвязь между переменными выявляли путем расчета коэффициента корреляции Спирмена. Для оценки связи между фактором риска и болезнью определяли показатель относительного риска (ОР) с 95% доверительным интервалом (95% ДИ). Различия считали статистически значимыми при уровне значимости P<0,05.
Результаты
Проведенный анализ клинико-анамнестических данных трех групп показал, что все три группы сравнимы по возрасту пациенток (табл. 1). Между тремя группами выявлены статистически значимые различия по частоте обнаружения эндометриоидных кист яичников, эндометриоза кишечника, тазовой брюшины/связок, аденомиоза и спаечного процесса в малом тазу; причем эта патология выявлялась значимо чаще в группах 1 и 2, чем в группе 3. При этом в группе 1 у всех пациентов были диагностированы эндометриоидные кисты яичников, а в группе 2 у всех пациенток – эндометриоз тазовой брюшины/связок. Кроме этого, у пациенток в группе 2 чаще выявлялись эндометриоз кишечника и аденомиоз, чем в группе 1 (P<0,001; P=0,02). У пациенток групп 1 и 2 часто наблюдался спаечный процесс в малом тазу, реже выявлялся эндометриоз мочевого пузыря. Исследуемые группы не различались по частоте первичного и вторичного бесплодия, миомы матки, хронического эндометрита, хронического сальпингоофорита, полипов и гиперплазии эндометрия.
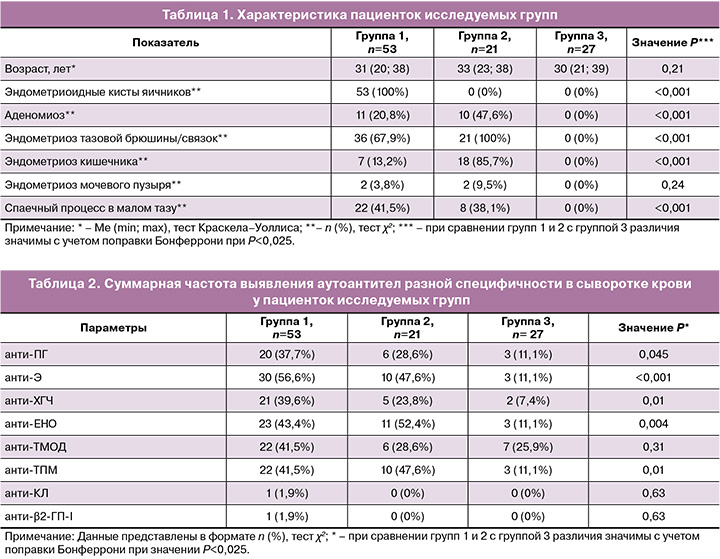
Результаты определения профиля аутоантител показали, что у пациенток с эндометриозом статистически значимо чаще обнаруживались антитела к гормонам (Э, ПГ, ХГЧ), эндометриальным антигенам (ТМОД, ТПМ) и ЕНО, чем аФЛ и АНА (P<0,001 в группе 1; P<0,05 в группе 2). АНА не были обнаружены во всех исследованных группах. Показано, что три группы различались по частоте обнаружения антител к Э, ХГЧ, ЕНО и ТПМ (P<0,025). Эти аутоантитела при эндометриозе выявлялись значимо чаще, чем в группе сравнения у женщин без эндометриоза (табл. 2). При этом значимых различий между группами 1 и 2 по частоте выявления антител не было обнаружено. Однако риск обнаружения антител к ПГ, Э, ХГЧ, ЕНО, ТПМ, за исключением антител к ТМОД, у пациенток с эндометриоидными кистами яичников был в 3,4–5,4 раза выше по значениям показателя относительного риска (ОР), чем у женщин без эндометриоза (P<0,05). В то же время у пациенток с глубоким инфильтративным эндометриозом без поражения яичников отмечался высокий риск обнаружения только антител к Э, ЕНО и ТПМ, который был в 4,3–4,7 раза выше, чем в группе сравнения (P<0,05).
При определении частоты выявления антител классов M и G в исследуемых группах и группе сравнения были найдены различия в частоте обнаружения IgM- и IgG-антител к Э и IgM-антител к ПГ (P≤0,025) (табл. 3). При попарном сравнении групп 1 и 2 значимых различий в частоте детекции аутоантител не было выявлено (P>0,05). Однако при сравнении групп 1 и 2 с группой 3 у пациенток в группе 1 была показана значимо более высокая частота выявления антител классов M и G к Э, IgM-антител к ПГ (P<0,01), а в группе 2 – значимо более высокая частота обнаружения IgM-антител к Э и IgG-антител к ТПМ, чем в контрольной группе (P<0,025). При этом по значениям показателя ОР при эндометриоидных кистах яичников отмечался высокий риск обнаружения IgM- и IgG-антител к Э (ОР=10,7; 95% ДИ [1,5; 75,3]; P=0,02; ОР=3,6; 95% ДИ [1,2; 10,9]; P=0,03) и IgM-антител к ПГ (ОР=8,7; 95% ДИ [1,2; 61,7], P=0,03). При глубоком инфильтративном эндометриозе без поражения яичников наблюдался высокий риск обнаружения IgM-антител к Э (ОР=10,3; 95% ДИ [1,4; 75,9]; P=0,02) и IgG-антител к ТПМ (ОР=7,7; 95% ДИ [1,0; 59,26]; P=0,049) по сравнению с группой без эндометриоза. Высокие показатели ОР (>1,0) свидетельствовали о наличии прямой связи между данными аутоантителами и исследованными формами эндометриоза.
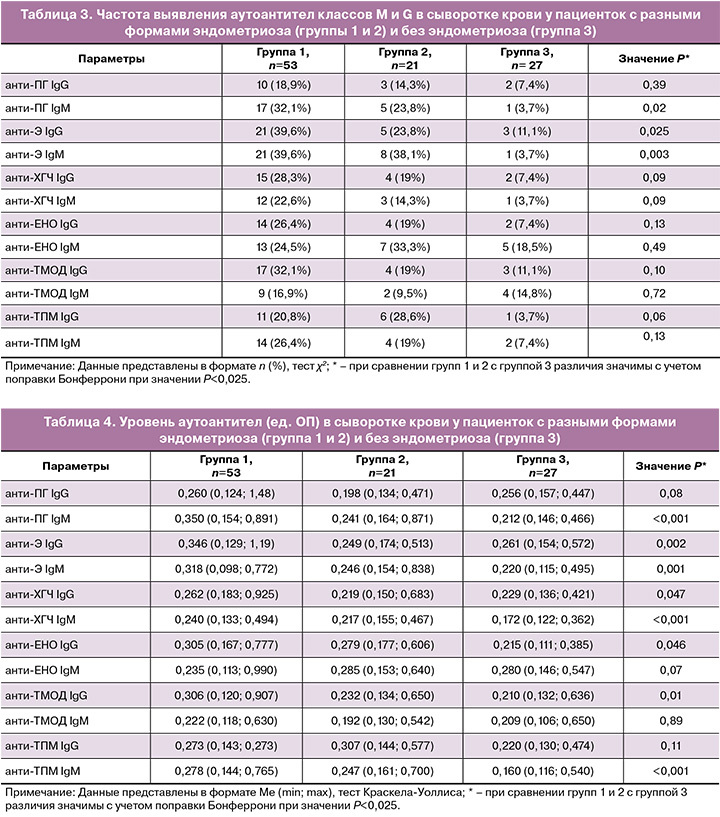
При сравнении сывороточных уровней антител в группах 1 и 2 с группой 3 было выявлено значимое различие в уровнях IgM-антител к ПГ, Э, ХГЧ и ТПМ, а также IgG-антител к Э и ТМОД (P<0,025) (табл. 4). У пациенток с эндометриоидными кистами яичников отмечались более высокие уровни IgM-антител к ПГ, Э, ХГЧ и ТПМ, а также IgG-антител к Э, ХГЧ, ЕНО и ТМОД, чем у женщин без эндометриоза (P<0,025). У пациенток с глубоким инфильтративным эндометриозом без поражения яичников наблюдалось повышение уровней IgM-антител к ТПМ и ХГЧ по сравнению с группой без эндометриоза (значения P<0,001; 0,01). При сравнении групп пациенток с разными формами эндометриоза в группе 1 отмечались более высокие уровни IgG-антител к Э и ТМОД, чем в группе 2 (значения P<0,01; 0,02).
У пациенток с эндометриоидными кистами яичников между уровнями антител классов M и G к Э и ПГ, а также между уровнями IgM-антител к ТПМ и ТМОД была выявлена сильная прямая корреляционная связь (значения r соответственно 0,92; 0,75 и 0,85; P<0,001). В остальных случаях между уровнями IgG-антител разной специфичности корреляционная связь не наблюдалась, а между уровнями IgM-антител отмечалась прямая корреляционная связь со значениями r<0,7, более выраженная между антителами к гормонам, а также между антиэндометриальными антителами и антителами к ЕНО.
При глубоком инфильтративном эндометриозе наблюдалась прямая корреляционная связь между IgG-антителами к ТПМ и ТМОД (r=0,5; P=0,04), а также между IgG-антителами к Э и ЕНО (r=0,52; P=0,02) или ТМОД (r=0,54; P=0,01). Следует отметить, что прямая корреляционная связь выявлялась также между IgM-антителами к гормонам, ТПМ и ТМОД (r>0,7; P<0,001).
Обсуждение
В настоящее исследование были включены пациентки с разными формами эндометриоза, включающими эндометриоидные кисты яичников и глубокий инфильтративный эндометриоз. У всех пациенток в группе 1 были диагностированы эндометриоидные кисты яичников, которые наиболее часто выявлялись в сочетании с эндометриозом тазовой брюшины/связок, реже с эндометриозом кишечника, аденомиозом и эндометриозом мочевого пузыря. В группе 2 у всех пациенток был диагностирован глубокий инфильтративный эндометриоз; при этом эндометриоз кишечника и аденомиоз имели место значимо чаще в группе 2, чем в группе 1. У пациенток обеих групп с высокой частотой наблюдался ассоциированный с эндометриозом спаечный процесс в малом тазу.
Следует отметить, что патофизиология эндометриоза до конца не изучена; при этом существует множество теорий патогенеза эндометриоза. Нет единого мнения о том, имеют ли разные формы эндометриоза общий патогенез, и может ли один тип эндометриоза вызывать другой. Считается, что причина глубокого эндометриоза, скорее, эмбриологическая; следовательно, иммунная система имеет меньшее значение в его развитии [10]. Тогда как поверхностный перитонеальный эндометриоз и эндометриомы яичников обычно рассматриваются как последствия имплантации клеток эндометрия, перенесенных в брюшную полость по маточным трубам в результате ретроградной менструации. При этом нарушение иммунного ответа и дисрегуляция иммунного надзора являются критическими факторами, приводящими к развитию эндометриоза и возможных последствий, включая бесплодие.
Результаты настоящего исследования продемонстрировали высокую частоту выявления и широкий спектр аутоантител при эндометриозе, особенно при эндометриоидных кистах яичников, включающий антитела к эндометриальным антигенам (ТМОД, ТПМ), стероидным и гонадотропным гормонам (Э, ПГ, ХГЧ) и ферменту ЕНО. Следует отметить, что эти антитела были найдены у пациенток с эндометриозом значимо чаще, чем аФЛ и АНА и по сравнению с женщинами без эндометриоза.
Полученные результаты согласуются с данными систематического обзора (2017), согласно которому, в большинстве из 22 исследований, изучавших роль В-лимфоцитов при эндометриозе, были выявлены повышенное присутствие и/или активация В-клеток, а также избыточная продукция антител и провоспалительных цитокинов у пациенток с эндометриозом [15]. Наличие антиэндометриальных антител ранее было показано как в сыворотке крови, так и в перитонеальной жидкости [22]. Считается, что аутоантитела могут способствовать развитию эндометриоза, стимулируя иммунную систему и поддерживая воспаление. Однако их роль в развитии заболевания, а также связь с клиническими симптомами, локализацией и тяжестью заболевания пока недостаточно исследована.
При сравнении трех групп значимые различия были найдены в частоте обнаружения антител (M, G) к Э, ХГЧ, ЕНО и ТПМ, которые выявлялись чаще при эндометриозе. Хотя группы 1 и 2 по частоте выявления антител значимо не различались, у пациенток с эндометриоидными кистами яичников наблюдался высокий риск обнаружения антител к ПГ, Э, ХГЧ, ЕНО, ТПМ, тогда как у пациенток без поражения яичников – только антител к Э, ЕНО и ТПМ по сравнению с женщинами без эндометриоза. В группе 1 значимо чаще выявлялись антитела (M, G) к Э и IgM-антитела к ПГ, а в группе 2 – IgM-антитела к Э и IgG-антитела к ТПМ. При этом в группе 1 отмечался высокий риск обнаружения антител к Э и ПГ и прослеживалась выраженная прямая связь антител к стероидным гормонам с эндометриоидными кистами яичников, а при глубоком инфильтративном эндометриозе наблюдался высокий риск обнаружения не только антител к Э, но также антител к ТПМ.
Повышенному образованию антител к стероидным гормонам у больных эндометриозом может способствовать избыточная продукция эстрогенов в яичниках, эктопических очагах эндометрия, периферической жировой ткани, а также повышенная продукция ПГ стромальными клетками в эндометриоидных гетеротопиях [23]. Известно, что эндометриоз является эстрогензависимым заболеванием, при котором локальный биосинтез эстрадиола в очагах эндометриоидного поражения в сочетании с выраженным воспалением в брюшной полости создают аномальное иммунно-эндокринное микроокружение, способствующее росту и выживанию клеток в эктопических очагах [9].
Кроме того, при эндометриозе выявлена аномальная передача сигналов ПГ в эндометрии, что играет важную роль в нарушении децидуализации и развитии эктопических очагов поражения [24]. Как известно, действие ПГ имеет решающее значение для уменьшения воспаления в эндометрии, а аномальная передача сигналов ПГ приводит к провоспалительному фенотипу. Следствием нарушения действия ПГ при эндометриозе может быть резистентность к ПГ, которая является ключевым эндометриальным фактором в патогенезе ассоциированного с эндометриозом бесплодия, а также приводит к неэффективности гормональной терапии у части больных. Выявленная в настоящем исследовании высокая позитивность пациенток на антитела к ПГ (37,7% в группе 1 и 28,6% в группе 2) позволяет предположить, что антитела к ПГ могут вносить свой вклад в патофизиологию эндометриоза, в развитие резистентности эндометрия к ПГ и, как следствие, неэффективности гормональной терапии у серопозитивных пациенток.
Полученные результаты демонстрируют повышение сывороточного уровня широкого спектра аутоантител разной специфичности у пациенток с эндометриоидными кистами яичников, а именно IgM-антител к ПГ, Э, ХГЧ и ТПМ, а также IgG-антител к Э, ХГЧ, ЕНО и ТМОД, по сравнению с женщинами без эндометриоза. Тогда как у пациенток с глубоким эндометриозом без поражения яичников наблюдалось значимое повышение уровня только IgM-антител к ТПМ и ХГЧ. В группе 1 отмечались значимо более высокие уровни IgG-антител к Э и ТМОД, чем в группе 2.
Аутоантитела могут вовлекаться в патофизиологию эндометриоза. Связываясь с антигенами на поверхности клеток или образуя иммунные комплексы с растворимыми антигенами, аутоантитела могут усиливать воспаление и тканевое повреждение посредством рекрутирования нейтрофилов и других миелоидных и лимфоидных клеток в очаги поражения, активации комплемента по классическому пути через взаимодействие C1q компонента с Fc доменами антител в иммунных комплексах, а также изменения функции и активации иммунных клеток, в том числе эффекторных, несущих на поверхности Fcγ-рецепторы, таких как моноциты, нейтрофилы, макрофаги, дендритные клетки и натуральные киллеры, и повышения продукции провоспалительных цитокинов. Повышенный цитокиновый фон в эктопических очагах эндометриоза, обусловленный воспалением, в свою очередь, стимулирует выработку аутоантител B-лимфоцитами.
Особо следует отметить обнаружение при эндометриозе антител к эндометриальным антигенам (ТПМ, ТМОД) и ЕНО, которые участвуют в важных механизмах патогенеза эндометриоза, связанных с подвижностью и миграцией клеток, инвазией и адгезией на эктопических участках, цитоскелетной динамикой, переходом к стационарной морфологии, апоптозом и некрозом [25, 26]. Гликолитический фермент ЕНО содействует инвазии клеток эндометрия в эктопических очагах путем обеспечения активации плазмина и деградации внеклеточного матрикса [27].
По-видимому, образованию антител к этим молекулам способствует их повышенная экспрессия в эндометриоидных клетках. Эта гипотеза подтверждается результатами исследования белков – лизатов эндометриальной ткани, полученной из поверхностных и глубоких очагов эндометриоза, продемонстрировавшими разную экспрессию многочисленных белков, участвующих в имплантации клеток за пределами эндометрия и вовлеченных в прогрессирование заболевания [28]. В частности, были показаны повышенная экспрессия ТПМ в эктопической ткани эндометрия по сравнению с эутопической и ее увеличение в секреторной фазе цикла, а также повышенная экспрессия ТПМ в очагах глубокого эндометриоза, по-видимому, обусловленная более высоким содержанием в них гладкомышечных клеток. Можно предположить, что этим объясняется наблюдаемое нами значительное повышение уровня антител к ТПМ у пациенток с глубоким эндометриозом.
Результаты исследования согласуются с данными, полученными другими исследователями, о возможности использования антител к ЕНО в качестве диагностического маркера эндометриоза [29] и более высокой эффективности определения антител к эпитопам ТМОД и ТПМ для диагностики эндометриоза на ранних стадиях (I–II) по сравнению с CA 125 и CA 19-9 [17].
Заключение
Таким образом, при эндометриозе с высокой частотой выявлялись сывороточные аутоантитела к эндометриальным антигенам, ЕНО, стероидным и гонадотропным гормонам, по сравнению с женщинами без эндометриоза. При этом повышения частоты аФЛ и АНА не отмечалось. Профиль антител различался при разных формах эндометриоза. При эндометриоидных кистах яичников наблюдался более широкий спектр антител, включающий антитела к гормонам, ТПМ, ТМОД и ЕНО, тогда как при глубоком эндометриозе преобладали антитела к ТПМ. Антитела к стероидным гормонам в большей степени ассоциировались с эндометриомами. Антитела к ПГ могут способствовать развитию резистентности эндометрия к ПГ. Аутоантитела могут вовлекаться в патофизиологию эндометриоза и служить диагностическими маркерами эндометриоза.



