Глубокий инфильтративный эндометриоз (ГИЭ) – наиболее тяжелая форма эндометриоза. К инфильтративному эндометриозу принято относить поражение мышечных структур влагалища, мочевого пузыря или толстой кишки с глубиной инвазии более 5 мм. В настоящее время хирургический метод является общепринятым в лечении ГИЭ с последующим проведением противорецидивной гормональной терапии.
Несмотря на повсеместное внедрение и совершенствование техники эндоскопической хирургии, частота осложнений при хирургическом лечении ГИЭ остается высокой, закономерно увеличивается при расширении объема оперативного вмешательства, и, по данным литературы, составляет от 3% до 10% [1]. Тяжелые осложнения приводит к снижению эффективности оперативного вмешательства, в связи с чем, многие исследователи придерживаются мнения о рациональности минимального воздействия на очаги ГИЭ нерепродуктивных органов. По нашему мнению, любое паллиативное вмешательство приводит к быстрому рецидиву с усугублением болевого синдрома и необходимости повторной операции, всегда более сложной и травматичной. Оптимальным, на наш взгляд, является тактика максимального иссечения очагов эндометриоза с привлечением мультидисциплинарных хирургических бригад, а резервом снижения послеоперационных осложнений может стать внедрение протоколов ускоренного выздоровления после операции.
Протоколы ускоренного выздоровления
Термин «протоколы ускоренного выздоровления после операции» (ПУВ) в англоязычной литературе имеет ряд равнозначных синонимов: Enhanced Recovery After Surgery (ERAS), Fast-Track Surgery (FTS), Enhanced Recovery Pathway (ERP) или Multimodal Surgical Care. Все они характеризуют совокупность мультидисциплинарных и мультимодальных мероприятий, проводимых в периоперационном периоде, призванных ускорить восстановление, снизить частоту осложнений, свести к минимуму пребывание в стационаре без увеличения числа повторных госпитализаций, а также сократить экономические затраты без ущерба для безопасности пациентов.
Основоположником концепции ускоренного восстановления после операции считается датский колоректальный хирург, профессор Henrik Kellet (1997 г.), который провел патофизиологический анализ развития послеоперационных осложнений (ПО) и сформулировал основные положения концепции. H. Kellet подчеркнул, что ключевым патогенетическим фактором развития ПО является периоперационный стресс (ПС), приводящий к эндокринным и метаболическим нарушениям, активации каскадных систем (продукция провоспалительных цитокинов, метаболитов арахидоновой кислоты, активация системы комплемента, образование свободных радикалов и др.) Данные изменения носят адаптационный, приспособительный характер, однако при чрезмерной или длительной активации могут привести к нарушению гомеостаза, органной дисфункции, инсулинорезистентности и иммуносупрессии, что является патогенетической основой развития ПО. Объектом воздействия ПУВ являются различные компоненты ПС, коррекция которых, может значительно улучшить хирургические исходы.
Реализация программы ПУВ происходит в три этапа (рисунок): предоперационный, интраоперационный и послеоперационный. Предоперационный и послеоперационный этапы включают амбулаторный и стационарный периоды. Основными участниками реализации программы ПУВ являются хирург (лечащий врач), анестезиолог-реаниматолог и средний медицинский персонал. Кроме того, ПУВ подразумевают активное вовлечение самого пациента в процесс реабилитации.
Предоперационный этап
Основной задачей предоперационного этапа является обследование и подготовка больных к оперативному вмешательству. Согласно концепции ПУВ подготовка пациентов должна осуществляться совместно с анестезиологом-реаниматологом и другими профильными специалистами в случае наличия сопутствующей патологии с позиции преабилитации. Преабилитация в настоящее время определяется, как программа лечебно-оздоровительных мероприятий, призванная увеличить функциональные возможности для подготовки организма к предстоящему стрессу [2].
Основными компонентами предоперационного амбулаторного этапа, в отношении которых имеется наибольшее число доказательных данных, является предоперационная оптимизация (выявление и компенсация сопутствующей патологии, лечение анемии, отказ от курения и употребления алкоголя, компенсация нутритивной недостаточности), обучение и информирование пациента (таблица 1).

Применение про-, пре- и симбиотиков в периоперационном периоде в настоящее время не включено ни в одно клиническое руководство по ускоренному восстановлению после операции. Однако, согласно последним литературным данным, их использование целесообразно у пациентов, которым планируется оперативное вмешательство на толстой кишке.
Так, в недавнем рандомизированном контролируемом исследовании (РКИ), выполненном авторами из Японии, было продемонстрировано значительное снижение воспалительного ответа у пациентов после резекции толстой кишки, получавших препарат, содержащий Bifidobacterium longum BB536 в течение 7–14 дней до и 14 дней после операции, по сравнению с группой контроля. Данный подход, по мнению авторов, может привести к снижению ПО [6].
В 2016 г опубликованы данные рандомизированного двойного слепого плацебо контролируемого исследования, в котором изучали эффективность применения комбинированного препарата, содержащего 30 млн колониеобразующих единиц кислото- и желчеустойчивых бифидо- и лактобактерий в течение 7 дней до резекции толстой кишки. Результаты исследования продемонстрировали значительно более быстрое восстановление функции толстой кишки в послеоперационном периоде у пациентов основной группы (медиана 108,5 ч (80–250 ч)), по сравнению с группой контроля (медиана 156,5 ч (94–220 ч), p=0.022), а также сокращение длительности пребывания в стационаре до 6,5 дней (4–30 дней), по сравнению с группой плацебо (медиана 13 дней (5–25 дней), p=0.012) [7].
В 2017 году были опубликованы данные мета-анализа, в котором авторы изучали влияние применения про-, пре- и симбиотиков в периоперационном периоде на частоту развития инфекционных осложнений у взрослых хирургических больных. Результаты исследования продемонстрировали, что применение симбиотиков, по сравнению с пробиотиками и пребиотиками наиболее значимо снижает частоту раневой инфекции, пневмонии, сепсиса, сокращает длительность госпитализации и использование антибактериальных препаратов[8].
Также, в рамках преабилитации рассматривается применение дозированных физических нагрузок до операции с целью повышения адаптивных возможностей пациента.
По данным Кохрейновкого обзора 2015 года, включающего семь РКИ, у пациентов, выполнявших аэробные физически упражнения в предоперационном периоде, отмечено снижение длительности госпитализации и частоты послеоперационных осложнений [9].
В исследовании, выполненном Канадскими авторами в 2016 году, была проведена оценка эффективности применения трехкомпонентной программы преабилитации, включавшей физические упражнения, нутритивную поддержку и обучение релаксационным техникам среди пожилых пациентов с колоректальным раком. Пациенты основной группы проходили данную программу в качестве преабилитации в течение 4-х недель до операции. Группу контроля составили пациенты, проходившие аналогичную программу в послеоперационном периоде. На момент госпитализации пациенты основной группы продемонстрировали значительно лучшую переносимость физических нагрузок по данным теста 6-ти минутной ходьбы и расширение физической активности по данным опросника Community Health Activities Model Program for Seniors (CHAMPS). Своим исследованием авторы продемонстрировали эффективность и возможность реализации на практике тримодальной программы преабилитации пожилых хирургических больных с колоректальным раком [10].
В 2017 г опубликованы данные слепого рандомизированного контролируемого исследования, включающего 144 пациента, которым планировалось оперативное вмешательство на толстой кишке. В исследовании пациенты были случайным образом разделены на две группы в зависимости от концепции предоперационной подготовки. Пациентам основной группы предлагали индивидуальную программу физических упражнений, разработанную с учетом сопутствующей патологии, социальных и психологических особенностей, призванную повысить физическую активность пациента. Результаты исследования продемонстрировали увеличение аэробной емкости легких [DET 135 (218)% ; P<0,001), снижение числа послеоперационных осложнений на 51% (относительный риск 0,5; 95% доверительный интервал 0,3–0,8; P=0,001) и частоты развития осложнений [1,4 (1,6) и 0,5 (1,0) (P=0,001)] при сравнении с группой контроля [11].
Авторы систематического обзора, опубликованного в 2018 г, продемонстрировали эффективность применения физических упражнений на догоспитальном этапе у хирургических пациентов. Однако, авторы подчеркивают, что ограниченное число доказательных и качественных данных, свидетельствующих об эффективности комплексной преабилитации, не позволяет рекомендовать данный подход в качестве оптимального метода подготовки пациентов к хирургическому вмешательству [12].
Стационарный предоперационный этап
Согласно концепции ПУВ, пациента госпитализируют в день операции или накануне, поскольку все основные подготовительные мероприятия осуществлены амбулаторно. Основные компоненты ПУВ представлены в таблице 2.

Несмотря на высокий уровень доказательных данных об эффективности отказа от механической подготовки кишечника, в литературе обсуждаются альтернативные варианты подготовки толстой кишки.
Мета-анализ, включающий 7 РКИ 1769 пациенток, продемонстрировал эффективность комбинации механической подготовки кишечника в сочетании с пероральным приемом антибактериальных препаратов [14].
Однако ретроспективное исследование 40446 пациентов, проведенное канадскими учеными в период 2012–2014 гг, не подтвердило эти данные. Авторы пришли к заключению, что пероральный прием антибактериальных препаратов приводит к значительному снижению инфекционных осложнений, риска несостоятельности анастомоза и частоты развития послеоперационного пареза кишечника, а комбинация перорального приема антибактериальных препаратов и механической подготовки кишечника не дает преимуществ перед изолированным приемом пероральных форм антибактериальных препаратов [15].
По нашему мнению, альтернативным способом подготовки кишечника к оперативному вмешательству является безшлаковая диета в течение 2–5 дней до операции с переходом на жидкое питание за сутки до операции.
Интраоперационный этап
Основной задачей интраоперационного этапа является минимизация хирургического стресса, создание условий для ускоренного восстановления. Его элементы представлены в таблице 3.
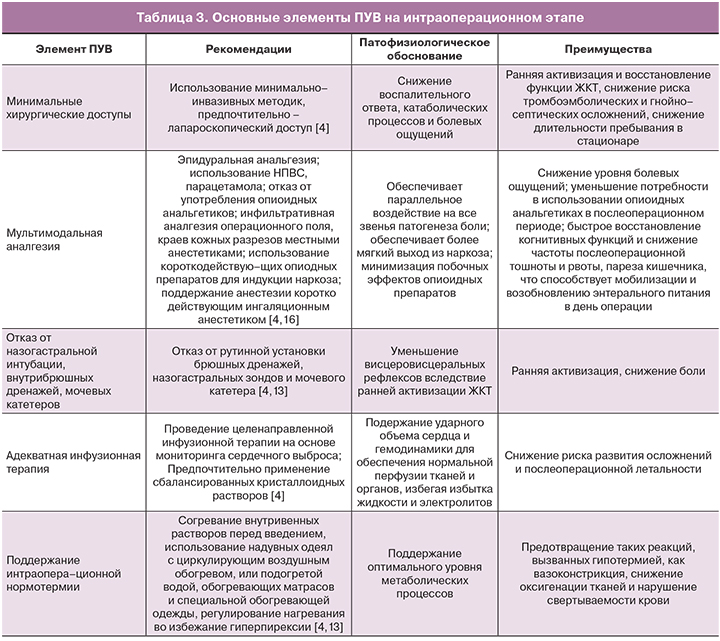
Таким образом, приведенные данные подтверждают преимущества всех элементов интраоперационного этапа ПУВ.
Послеоперационный стационарный этап
Результаты трех крупных мета-анализов показали, что применение жевательной резинки является недорогим, безопасным и эффективным методом для профилактики кишечной непроходимости в колоректальной хирургии и гинекологии. Однако многие врачи скептически относятся к данному методу [17, 18].
Критерии выписки
Пациент может быть выписан при условии восстановления энтерального питания, возможности самообслуживания, восстановления функции мочевыделительной системы и желудочно-кишечного тракта, отсутствия признаков осложнений, возможности пациента выполнять назначения врача в домашних условиях, доступной амбулаторной помощи и желании пациента [19, 20].

Опыт применения ПУВ при ГИЭ
Большинство доказательных данных, демонстрирующих клиническую и экономическую эффективность применения ПУВ, относится к колоректальной хирургии.
Однако в литературе имеется ограниченное число публикаций о результатах применения ПУВ при ГИЭ. В исследовании, выполненном W. Kondo и соавт. в 2014 г, в которое была включена 161 пациентка с ГИЭ толстой кишки, было продемонстрировано, что применение элементов ПУВ при лапароскопическом лечении ГИЭ толстой кишки приводит к значительному сокращению времени общей длительности госпитализации и количеству часов, проведенных в стационаре после операции, а также к снижению числа реадмиссий и повторных операций, как в случае выполнения органосохраняющей операции (шейвинг прямой кишки, скининг слизистой оболочки, дисковидная резекция прямой кишки), так и в случае сегментарной резекции толстой кишки [21]. В 2017 г были опубликованы данные проспективного двойного слепого РКИ, выполненного в Италии, в которое были включено 227 пациенток с ГИЭ толстой кишки, разделенных на две группы – группа ускоренного восстановления и группа традиционного периоперационного ведения. Результаты исследования показали, что применение ПУВ после лапароскопической операции при ГИЭ органов малого таза и толстой кишки не увеличивает риск осложнений и обеспечивает снижение медицинских расходов [22].
Заключение
Таким образом, анализ литературных данных показал, что ПУВ научно обоснованы и эффективны. Внедрение ПУВ после операции в клиническую практику может служить резервом снижения экономических затрат и повышения эффективности хирургического лечения у пациенток с ГИЭ (снижение частоты осложнений, длительности госпитализации, числа повторных операций и реадмиссий, лекарственной нагрузки и дискомфорта пациента).



