Инфекционная патология влагалища и шейки матки продолжает оставаться основной причиной обращения пациенток к гинекологу. При обследовании пациенток на наличие инфекций органов репродукции в России все чаще применяются молекулярно-биологические методы, в частности, полимеразная цепная реакция (ПЦР). Однако на сегодняшний день не существует нормативных документов, указывающих на предпочтительный локус для получения биологического материала. Традиционным считается исследование цервикального или комбинированного материала.
В России чаще всего обследуют пациенток на основные инфекции, передаваемые половым путем (ИППП) (Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis, Mycoplasma genitalium); условно-патогенные генитальные микоплазмы (Ureaplasma parvum, Ureaplasma urealyticum, Mycoplasma hominis); бактериальный вагиноз (БВ); вульвовагинальный кандидоз (ВВК); аэробный вагинит (АВ).
И БВ, и АВ, и ВВК – вагинальные инфекции, и исследование цервикального биоматериала на наличие БВ-ассоциированных микроорганизмов, аэробов и грибов Candida spp. нецелесообразно. Trichomonas vaginalis имеет тропность к вагинальному эпителию; Mycoplasma genitalium, Ureaplasma parvum, Ureaplasma urealyticum, Mycoplasma hominis не имеют определенной тропности; Chlamydia trachomatis, как и Neisseria gonorrhoeae, проявляют тропность к цилиндрическому эпителию, выстилающему канал шейки матки [1–3].
Необходимо учитывать, что процедура получения цервикального соскоба может быть достаточно травматичной. В то же время как в европейских [4], так и в американских [5] руководствах появились указания на достаточную информативность исследования вагинального мазка при обследовании на хламидийную инфекцию. Связано это с тем, что цервикальные патогены попадают во влагалище с током слизи или со слущенными клетками цилиндрического эпителия, и современные высокочувствительные методы способны детектировать их ДНК в вагинальном биоматериале.
Исследования, проведенные ранее, показали, что тестирование вагинального биоматериала достаточно эффективно при комплексном обследовании беременных пациенток [6]; вопрос о небеременных пациентках остался открытым.
Целью данного исследования стала оценка информативности исследования биологического материала из шейки матки и влагалища для диагностики вульвовагинальных и цервикальных инфекций у пациенток гинекологического профиля.
Материал и методы исследования
В исследование были включены 206 пациенток в возрасте от 20 до 51 года (средний возраст 29±6,4 года), предъявляющих жалобы на наличие вагинальных выделений, зуда, жжения, дискомфорта в области половых органов, обратившиеся в Научно-консультативный клинико-диагностический центр ФБУН ЦНИИ эпидемиологии Роспотребнадзора с июля 2013 года по ноябрь 2013 года.
Все пациентки подписывали информированное согласие на участие в исследовании. Во время осмотра от каждой пациентки получали биологический материал из цервикального канала и влагалища для проведения лабораторных исследований методом ПЦР в реальном времени. Вагинальный материал получали ватным зондом-тампоном из заднебокового свода влагалища; цервикальный материал – универсальным зондом из цервикального канала после удаления слизи ватным тампоном. Каждый зонд после получения биоматериала помещали в пробирку с «Транспортной средой с муколитиком» (производства ФБУН ЦНИИ эпидемиологии, Москва), обламывали в области насечки и оставляли в пробирках со средой. Транспортировку и хранение материала осуществляли в соответствии с инструкцией производителя транспортной среды.
Полученный материал исследовали на наличие ДНК возбудителей ИППП («АмплиСенс N.gonorrhoeae/C.trachomatis/M.genitalium/T.vaginalis-мультипрайм-FL») и генитальных микоплазм («АмплиСенс флороценоз/микоплазмы-FL») с применением ПЦР в реальном времени с количественной оценкой возбудителя.
Результаты исследования и обсуждение
Необходимость исследования биоматериала из шейки матки с целью выявления цервикальных патогенов остается предметом дискуссий. С одной стороны, получение материала из цервикального канала при обследовании с целью выявления возбудителей ИППП стало привычным для многих врачей в связи с тропностью некоторых возбудителей (C. trachomatis, N. gonorrhoeae) к цилиндрическому эпителию [1, 3, 7, 8]. С другой стороны, в литературе нет данных, свидетельствующих о большей информативности исследования цервикальных образцов по сравнению с вагинальными. В то же время в российских нормативных документах (в частности, приказ МЗ РФ № 808н) нет указания на локус получения биоматериала при обследовании на ИППП. Учитывая, что получение материала из цервикального канала – процедура достаточно дискомфортная и травматичная для пациентки, было принято решение оценить возможность исследования только вагинальных образцов с целью выявления возбудителей ИППП и генитальных микоплазм. В данной работе проведена сравнительная оценка информативности исследования материала, полученного из цервикального канала и влагалища небеременных пациенток. Сравнение информативности исследование биоматериала из цервикального канала и влагалища беременных пациенток было проведено нами ранее [6].
Среди всех обследованных пациенток С. trachomatis выявили у 5 (2,4%) пациенток в цервикальном канале и у 6 (2,9%) – в материале из влагалища. T. vaginalis обнаружили в 3 (1,5%) случаях в цервикальном образце и в 4 (1,9%) – в вагинальном. M. genitalium выявили у 4 (1,9%) пациенток, N. gonorrhoreae – у 1(0,5%) пациентки; оба микроорганизма определяли как в цервикальном канале, так и в вагинальном отделяемом.
Несмотря на то что как C. trachomatis, так и N. gonorrhoeae тропны к цилиндрическому эпителию [1, 3, 7, 8], оказывается, что информативность исследования вагинального мазка не уступает таковой для цервикального соскоба. Это связано с анатомо-физиологической целостностью органов репродуктивного тракта женщины: эпителий цервикального канала с током слизи попадает во влагалище пациенток, в результате чего становится возможным обнаружение цервикальных патогенов в вагинальном отделяемом (при использовании таких высокочувствительных методов, как ПЦР в реальном времени). В большинстве ранее проведенных исследований также было показано, что исследование методом ПЦР вагинального биоматериала более информативно, чем исследование цервикального биоматериала, для выявления ДНК C. trachomatis и N. gonorrhoeae [9, 10–13]. В то же время в одном из исследований была показана большая диагностическая чувствительность при исследовании цервикального биоматериала [14], однако в данном исследовании авторы применяли транскрипционно-опосредованную амплификацию, в ходе которой определяется РНК (а не ДНК, как в случае ПЦР) возбудителя, благодаря чему обнаруживаются только живые возбудители. Эта находка еще раз подтверждает, что нормальным локусом (в котором обеспечивается адекватная жизнедеятельность C. trachomatis и N. gonorrhoeae) является именно цервикальный канал. Вероятно, в будущем станет возможным рекомендовать получение материала для исследования методом ПЦР из влагалища, а для исследования методом транскрипционно-опосредованной амплификации – из цервикального канала. Однако это предположение требует дальнейшего подтверждения.
Для M. genitalium тропность недостаточно изучена, поэтому выбор локуса получения материала для дальнейшего исследования методом ПЦР неоднозначен. Ранее в работе Wroblewski и соавт. исследование вагинального мазка обеспечивало более высокую диагностическую чувствительность (по сравнению с цервикальным соскобом и первой порцией мочи) для выявления M. genitalium [15]. Некоторые исследователи уже исследуют только вагинальный биоматериал с целью выявления ДНК M. genitalium, не подвергая сомнению информативность этого типа биоматериала [16]. Интересно отметить, что в исследовании Shipitsyna и соавт. большей информативностью обладало исследование первой порции мочи, полученной от пациенток женского пола [17].
Этот тип биоматериала в России применяется нечасто для выявления ДНК возбудителей ИППП у женщин, однако, возможно, именно для M. genitalium он станет предпочтительным. При сравнении же вагинального и цервикального биоматериала в нашей работе оба обладали одинаковой информативностью.
T. vaginalis имеет тропность к вагинальному эпителию [18], поэтому большинство авторов исследует только вагинальный биоматериал для выявления ДНК этого возбудителя [19]. В сравнительных исследованиях, проведенных ранее, также однозначно показано, что исследование вагинального биоматериала более информативно [13, 14, 20].
Таким образом, как в данном, так и в проведенных ранее исследованиях показано, что исследование биоматериала, полученного из влагалища, не только не уступает по информативности исследованию цервикального материала при обследовании на ИППП, но и является более информативным.
Распространенность ИППП в исследуемой группе невысока. В связи с этим информативность исследования двух типов биологического материала оценивалась также для условно-патогенных генитальных микоплазм, которые значительно чаще обнаруживаются в урогенитальном тракте пациенток.
U. parvum была выявлена у 85 (41,3%) пациенток в цервикальном канале и у 96 (46,6%) – в вагинальном отделяемом. У 2 (1%) пациенток U. parvum была обнаружена только в цервикальном канале (концентрации: 2×103 ГЭ/мл, 1×106 ГЭ/мл) и у 13 (6,3%) – только во влагалище (концентрации от 101 до 106 ГЭ/мл).
U. urealyticum обнаруживали у 16 (7,8%) пациенток как в цервикальных, так и в вагинальных образцах.
M. hominis выявляли у 15 (7,3%) пациенток, из них у 10 женщин ДНК обнаруживали в обоих локусах, у 2 – только в цервикальном образце (концентрация <102 ГЭ/мл) и у 3 – только в вагинальном (в 2 концентрация <102 ГЭ/мл и в 1 – 1×104 ГЭ/мл).
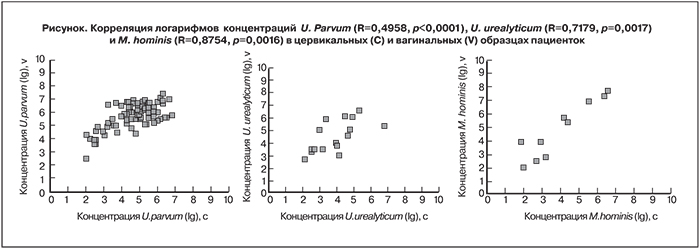
При сравнении количественных показателей была показана достоверная корреляция значений, полученных в цервикальных и вагинальных образцах для U. parvum, U. urealyticum, M. hominis (рисунок).
Как в нашей стране, так и во всем мире отсутствуют строгие рекомендации по выбору локуса для получения материала с целью выявления условно-патогенных генитальных микоплазм [6, 21]. Это связано с отсутствием выраженной тропности к определенному виду эпителия у данных микроорганизмов. Полученные результаты не только свидетельствуют о большей частоте выявления микоплазм во влагалище пациенток, но и показывают, что при количественном определении генитальных микоплазм концентрация ДНК генитальных микоплазм в вагинальных и цервикальных образцах демонстрирует достоверную корреляцию.
Публикаций о сравнении информативности исследования вагинального и цервикального биоматериала с целью выявления генитальных микоплазм у небеременных пациенток нами не найдено. Ранее проведенное нами сравнение этих типов биоматериала для выявления генитальных микоплазм у беременных пациенток также подтверждает бóльшую информативность исследования вагинального биоматериала [8].
Подводя итог, следует отметить, что для всех инфекций, изучаемых в данной работе, исследование вагинального биоматериала не только не уступало исследованию материала из цервикального канала, но и было более информативным (в том числе для выявления возбудителей ИППП). Кроме того, получение биоматериала из влагалища менее травматично, поэтому необходимость получения цервикального материала при обследовании как беременных, так и не беременных пациенток подвергается сомнению. Отдельно стоит отметить, что исследование вагинального биоматериала открывает более широкие возможности для скрининга, так как возможно самостоятельное получение данного вида материала пациенткой.
Заключение
Результаты проведенного исследования демонстрируют, что вагинальный биоматериал более информативен, чем цервикальный при обследовании пациенток на генитальные инфекции методом ПЦР. Учитывая, что получение цервикального материала – инвазивная процедура, предпочтение стоит отдавать вагинальному мазку.



