В последнее время в акушерской практике большое внимание уделяется проблеме ведения беременности у пациенток с тромбофилией, т.к. не вызывает сомнений, что эта категория больных имеет повышенный риск развития тяжелой акушерской и перинатальной патологии.
Рецидивирующие тромбозы в различные участки сосудистого русла, включая маточно-плацентарный кровоток, тяжелые гестозы, HELLP-синдром, отслойку плаценты могут не только осложнять течение беременности и родов, но и ухудшать состояние здоровья женщины в последующие периоды жизни [2, 3, 5, 6, 8, 9, 15, 16, 18].
До недавнего времени приоритетное место среди причин осложнений беременности, ассоциированных с тромбозами, занимал антифосфолипидный синдром (АФС). Однако в последние годы, благодаря использованию технологии полимеразной цепной реакции (ПЦР) появилась возможность диагностики ряда генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозам (мутация фактора V Лейдена, мутация протромбина и пр.), что позволило объяснить ранее необъяснимые случаи формирования тяжелых гестационных осложнений [1, 8, 15].
С учетом особенностей физиологической адаптации системы гемостаза к беременности абсолютное большинство генетических и приобретенных форм тромбофилии клинически манифестирует именно во время периода гестации [1, 3, 5, 6, 16, 17].
По данным мировой литературы, беременность, являясь фактором риска тромбозов, увеличивает опасность тромбоэмболических осложнений в 10 раз по сравнению с той же возрастной группой вне беременности [1, 3, 8, 9, 16, 18]. Несмотря на большой интерес к проблеме диагностики тромбофилий и профилактики тромбозов, в акушерской практике до настоящего времени не разработана единая унифицированная тактика ведения этого контингента больных.
В связи с этим целью нашего исследования явился подбор оптимального комплекса лечебно-диагностических мероприятий пациенткам с тромбофилией, с учетом характера гемостазиологических нарушений и приоритетной роли синдрома эндогенной интоксикации (СЭИ) в патогенезе тромбогенных осложнений гестации.
Материал и методы исследования
В исследовании участвовала 671 пациентка с диагностированной тромбофилией различного генеза и сопряженными гемостазиологическими нарушениями, определяемыми с помощью интегрального показателя коагуляции (ИПК). Способ набора материала – продольное когортное проспективное исследование. Исследование генетических полиморфизмов, ассоциированных с риском развития тромбофилии, проводилось методом ПЦР в режиме реального времени с использованием детектирующего амплификатора ДТ-96 с автоматическим программным обеспечением (ООО «НПО ДНК- Технология»).
Вычисление ИПК проводилось при помощи решающего правила прогноза риска тромбозов с учетом рейтинга информативности параметров гемостазиограммы при тромбофилии любого генеза (патент №2429478 от 20.09.2011). ИПК позволяет не только прогнозировать тромбогенные осложнения гестации у пациенток с дефектами гемостаза, но и контролировать эффективность лечебных мероприятий. При ИПК <1 риск тромбозов оценивается как низкий, при ИПК ≥1 – риск тромбозов высокий (чувствительность 86%, специфичность 76%, эффективность 81%) [11]. Тромбофилия была представлена в 14,5% случаев мутацией в гене метилен тетрагидрофолатредуктазы (MTHFR-C677), в 11,6% – мутацией в гене фибриногена (FGB-455), в 9,3% – мутацией в гене ингибитора активатора плазминогена (PAI-1), в 1,2% – мутацией Лейдена (F5), в 5,5% – мутацией в гене протромбина (F2-20210), в 4,6% – мутацией в гене рецептора мембраны тромбоцитов (ITGB3). АФС выявлялся в 26,4% случаев, сочетанные формы тромбофилии (генетические и АФС) диагностированы у 27% пациенток.
Из 671 пациентки 117 человек получали лечение, начиная с прегравидарного этапа, 554 – только при беременности по мере обращения. Было проведено рандомизированное контролируемое исследование, направленное на изучение эффективности комплексной терапии тромбофилии с применением различных групп противотромботических препаратов и эфферентных методов, с учетом приоритетной роли СЭИ в формировании тромбогенных осложнений гестации при различных формах тромбофилии [10]. В качестве противотромботической терапии применялись 3 группы препаратов: низкомолекулярные гепарины (НМГ) – клексан 40 мг/сут или фраксипарин 30 мг/сут; сочетание НМГ с
дезагрегантами – препаратами ацетилсалициловой кислоты (тромбоасс 50 мг/сут); гепариноиды
(сулодексид 1000 ЛЕ/сут). Используемые препараты, как известно, имеют разные точки приложения при воздействии на систему гемостаза [10, 14, 17].
Деление пациенток на подгруппы лечения производили по принципу контролируемой рандомизации в зависимости от варианта медикаментозной (М) противотромботической терапии: 1М подгруппа (n=223) – терапия НМГ, 2М подгруппа (n=235) – терапия НМГ в сочетании с дезагрегантами, 3М подгруппа (n=213) – терапия гепариноидами.
При условии формирования у пациенток субкомпенсированных форм плацентарной недостаточности (ПН) на фоне медикаментозной терапии (n=157), в комплекс лечения включались методы эфферентной терапии (ЭТ) – плазмаферез (ПА) и карбогемосорбция (КГС) [4, 7]. В зависимости от варианта ЭТ эти пациентки были разделены на 2 подгруппы при помощи простой рандомизации методом конвертов: подгруппа ПА (n=81) и подгруппа КГС (n=76). Процедуру КГС мы проводили в автоматическом режиме аппаратом для гемосорбции «ГемосПФ» «БИОТЕХ-М», Россия, в качестве сорбента использовался ВНИИТУ-1 (углеродный гемосорбент). Курс лечения состоял из 2 процедур. ПА проводился в непрерывно-поточном режиме с использованием аппарата «Haemonetics PCS2» фирмы «Haemonetics» (США). За один сеанс удалялось 500–700 мл плазмы. Плазмовозмещение осуществлялось растворами гидроксиэтилированного крахмала 6% (рефортан, волювен) в сочетании с раствором Рингера. Соотношение удаляемой плазмы и плазмозаменителей составляло 1/1,5. Курс лечения вне беременности состоял из трех процедур, которые проводили через день, при беременности ПА применяли 1 раз в триместр. Эффективность и переносимость терапии оценивали по динамике клинико-лабораторных проявлений тромбофилии: состояния системы гемостаза (ИПК) и характера кровообращения в системе матьплацента-плод, которые контролировали до начала терапии и через 2–3 нед лечения. Структуру и тяжесть гестационных осложнений оценивали на
протяжении беременности.
Результаты исследования и их обсуждение
Сравнение результатов лечения противотромботическими препаратами различных групп показало, что как на прегравидарном этапе, так и во время беременности монотерапия гепариноидами является наиболее предпочтительной за счет комплексного воздействия на все звенья системы гемостаза, и позволяет существенно снизить удельный вес тяжелых осложнений гестации, ассоциированных с тромбозами.
Стабилизация гемостаза (ИПК<1) на фоне лечения НМГ на этапе подготовки к беременности в течение месяца терапии была достигнута в 24,3% случаев, на фоне терапии НМГ в сочетании с дезагрегантами у 42,1% больных, на фоне терапии гепариноидами при той же продолжительности лечения в 61,9% случаев.
Во время беременности референтные значения ИПК (<1) на фоне терапии НМГ были констатированы в 46,5% случаев, при использовании НМГ в сочетании с дезагрегантами в 70,1%, при лечении гепариноидами в 87%.
При изучении частоты осложнений гестации на фоне различной противотромботической
терапии наименьшее количество их также зарегистрировано при использовании гепариноидов
(рис. 1).
Рисунок 1. Частота развития осложнений гестации на фоне различной противотромботической терапии у пациенток с тромбофилией.
По нашим данным, на фоне терапии гепариноидами ПН не развилась в 45,7% случаев, формирование тяжелых форм ПН отмечалось лишь у 13% пациенток, развитие гестоза – у 7,5%. При монотерапии НМГ отсутствие ПН отмечено только у 19,8% пациенток, тяжелые формы ПН были зарегистрированы более чем в половине случаев (53,5%), гестоз – в 35%.
При терапии НМГ в сочетании с дезагрегантами так же, как и по результатам исследования системы гемостаза, получены промежуточные результаты: без ПН беременность протекала у 37,6% пациенток, тяжелые формы были диагностированы в 29,9%, гестоз развился в 15,7% случаев.
Таким образом, сравнение результатов различных вариантов противотромботической терапии у пациенток с тромбофилией показывает, что НМГ у этой категории больных не оказывают патогенетического воздействия на состояние коагуляции и не могут использоваться в качестве монотерапии, т.к. недостаточно эффективно профилактируют тромбогенные осложнения гестации. Препаратами выбора, по нашим данным, являются гепариноиды, т.к. оказывая патогенетическое воздействие на все звенья системы гемостаза, позволяют существенно снизить удельный вес тяжелых осложнений гестации (патент на изобретение № 2367446 от 20.09.2009, медицинская технология № 2010/246 от 25.06.2010).
У пациенток с тромбофилией может рассматриваться также сочетанная терапия НМГ с дезагрегантами (препаратами ацетилсалициловой кислоты), особенно во время беременности, с учетом воздействия на первичное и коагуляционное звенья гемостаза, однако эффективность этого варианта лечения в 1,5 раза уступает терапии гепариноидами (сулодексид).
Сохраняющиеся гиперкоагуляционные нарушения на уровне высокого риска тромбозов (ИПК >1) и формирование субкомпенсированных форм ПН являлись основанием для применения методов ЭТ с учетом ведущей роли СЭИ в патогенезе тромбофилии. На прегравидарном этапе мы применяли только ПА в силу отсутствия технических возможностей для проведения КГС, при беременности применялись оба мето да ЭТ.
Анализ результатов лечения с применением ПА на прегравидарном этапе, отметил снижение ИПК менее 1 в 88% случаев, что свидетельствует о выраженном улучшении гемостатического потенциала.
При сравнении эффективности терапии КГС и ПА при беременности получены неравнозначные результаты: после курса КГС удалось добиться референтных значений ИПК в 55% случаев, тогда, как после ПА лишь в 33,7%. Следствием этого явилась и неоднородность влияния ПА и КГС на состояние кровообращения в системе мать-плацента-плод, оцененного методом допплерометрии: после проведения КГС произошла нормализация кровотоков в маточно-плацентарном и плодово-плацентарном русле в 76,4% случаев, тогда, как после применения ПА только в 61,6% (p<0,05; отношение шансов – OШ=1,9<4,5<10,7; относительный риск – ОР =1,15<1,37<1,63).
Таким образом, на основании проведенных исследований можно сделать заключение, что методы эфферентной терапии должны включаться в комплекс лечения пациенток с тромбофилией, с учетом их патогенетического воздействия на СЭИ, играющего ключевую роль в развитии тромбогенных осложнений гестации. Однако предпочтительным у этого контингента больных, особенно во время беременности, является метод КГС, т.к. он обеспечивает более эффективную детоксикацию, что приводит к снижению общего коагуляционного потенциала и в свою очередь улучшает кровообращение в маточно-плацентарно-плодовом русле. Кроме того, при проведении КГС не требуется выведения плазмы крови и последующего плазмовозмещения, что немаловажно во время беременности, осложненной тромбофилией.
При анализе исходов беременности на фоне различных комбинаций медикаментозной и ЭТ обращало на себя внимание, что оптимальным сочетанием комплексной терапии тромбофилии является комбинация гепариноидов и КГС, позволяющая не только существенно снижать удельный вес гестационных осложнений, но и увеличивать срок гестации на момент родоразрешения (см. таблицу).
Таким образом, проведенные исследования и полученные результаты позволили нам обосновать схемы ведения пациенток с тромбофилией как на прегравидарном этапе, так и во время беременности [10, 12, 13].
Таблица. Исходы беременности у пациенток с тромбофилией после применения различных методов
медикаментозной и эфферентной терапии (n=157).
После установления диагноза и получения представлений об исходном состоянии гемокоагуляции, пациенткам должна проводиться адекватная противотромботическая терапия, предпочтительно с прегравидарного этапа, направленная на стабилизацию во всех звеньях системы гемостаза и коррекцию СЭИ (рис. 2).
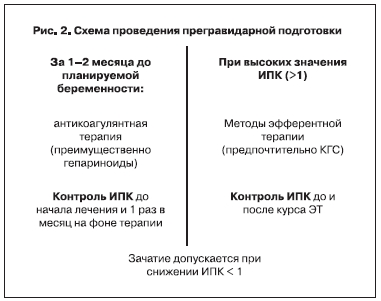
При беременности необходимо продолжать противотромботическую терапию под контролем общего свертывающего потенциала крови и состояния кровообращения в системе мать-плацента-плод.
Доза и комбинация препаратов подбирается индивидуально, в зависимости от изменений в системе гемостаза (рис. 3).
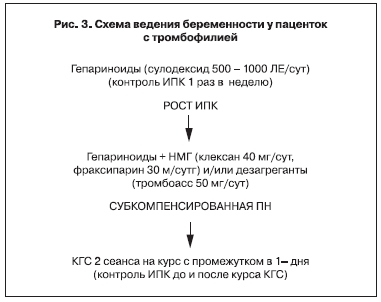
При сохранении протромботической направленности системы гемостаза и формировании субкомпенсированных форм ПН в комплекс лечения необходимо включать эфферентные методы,
с учетом их патогенетического воздействия на СЭИ. При беременности предпочтительна КГС.
Применение разработанных схем на практике привело к увеличению доли доношенных детей у этой категории больных в 2,3 раза, причем более чем в половине случаев (59,1%) дети рождались в удовлетворительном состоянии (8/9 и 7/8 баллов
по Апгар).
Выводы
Пациенткам с гемокоагуляционными нарушениями, обусловленными различными формами тромбофилии, показана комплексная терапия, направленная на стабилизацию гемостаза и коррекцию СЭИ, являющегося пусковым фактором развития тяжелых перинатальных осложнений. Препаратами выбора для проведения антикоагулянтной терапии у этой категории больных являются гепариноиды, т.к. оказывая комплексное воздействие на все звенья системы гемостаза, превосходят по эффективности как низкомолекулярные гепарины (в 1,7 раза), так и сочетанное применение НМГ и
дезагрегантов (в 1,5 раза).
Из методов ЭТ, оказывающих прямое детоксикационное воздействие, предпочтительным является метод КГС, эффективность которого превосходит эффективность ПА в 1,6 раза. Проведение комплексной терапии тромбофилии с применением гепариноидов и экстракорпоральной детоксикации позволяет существенно увеличить удельный вес срочных родов и минимизировать формирование патологических синдромов раннего неонатального периода.



