В структуре причин смертности женщин репродуктивного возраста злокачественные новообразования занимают второе место. Во время беременности онкологические заболевания диагностируются в 1 случае из 1000 пациенток и чаще всего представлены раком шейки матки, раком молочной и щитовидной желез [1].
Частота рака шейки матки составляет 1,8–10,9 случаев на 100 000 родов и не имеет тенденции к снижению. Распространенность дисплазии шейки матки возрастает ежегодно как в популяции молодых пациенток (до 34 лет), так и среди женщин старшего возраста [2].
Согласно заключению международного консенсуса, беременность не является значимым фактором, способствующим прогрессии заболевания и ухудшению прогноза для пациентки. По данным ряда ретроспективных исследований не выявлено разницы в продолжительности жизни у женщин с ассоциированным с беременностью раком шейки матки и заболеванием, выявленным вне гестации [3]. Высказано предположение, что индуцированная беременностью физиологическая элонгация шейки матки способствует уменьшению глубины стромальной инвазии и замедляет метастазирование в лимфатические узлы [4].
Дисплазия и рак шейки матки являются вирус-ассоциированными заболеваниями. Среди этиопатогенетических факторов, участвующих в развитии данного заболевания выделяют не только онкогенные вирусы папилломы человека (ВПЧ), но также иммунологические факторы [3].
Известно, что «входными воротами» инфекции, вызванной вирусом папилломы человека, являются кожа и слизистые оболочки. Вирионы контактируют в первую очередь с рецепторами врожденного иммунитета, которые локализуются на эпителиоцитах и кератиноцитах. В последние годы активно изучается роль Toll-подобных рецепторов (TLRs) [5]. Среди них выделяют TLR2, которые распознают поверхностные структуры вирионов и TLR9 – эндосомальные рецепторы, которые способны уловить ДНК ВПЧ. Взаимодействие TLRs с вирусными лигандами приводит к активации целого каскада сигнальных молекул, следствием чего является активация ряда транскрипционных факторов и выработки провоспалительных цитокинов (TNFa). Именно активация TLR-опосредованных реакций является одним из ключевых моментов запуска врожденного иммунитета в ответ на вирусную инфекцию [6].
Еще одним фактором врожденного иммунитета, обеспечивающим противовирусную защиту слизистых оболочек являются противомикробные пептиды. Особый интерес представляет HBD-1 (бета дефенсин человека 1), который экспрессируется на постоянном уровне кератиноцитами и эпителиальными клетками. Дефицит в выработке этого пептида напрямую связан с развитием инфекционных процессов. В случае сбалансированной работы врожденного иммунитета (распознающих рецепторов, провоспалительного звена, прямой противомикробной защиты) происходит активация адаптивного иммунитета, в результате чего достигается элиминация вируса из организма. При недостаточности факторов врожденного иммунитета происходит хронизация и персистирование инфекции [6, 7].
Цель работы: разработка новых подходов к терапии дисплазии шейки матки у беременных путем коррекции экспрессии факторов врожденного иммунитета.
Материал и методы исследования
Проспективное исследование включило 41 пациентку: основная группа – 30 беременных с дисплазией шейки матки, группа сравнения – 11 пациенток без цитологических изменений и ВПЧ.
Критериями включения в работу были:
Дисплазия шейки матки по результатам мазка на онко-цитологию.
Отсутствие инфекций, передающихся половым путем и воспалительных процессов во влагалище.
Информированное согласие женщин.
Отсутствие повышенной чувствительности к белкам свиного происхождения.
Дизайн проведенного исследования представлен на рис. 1.
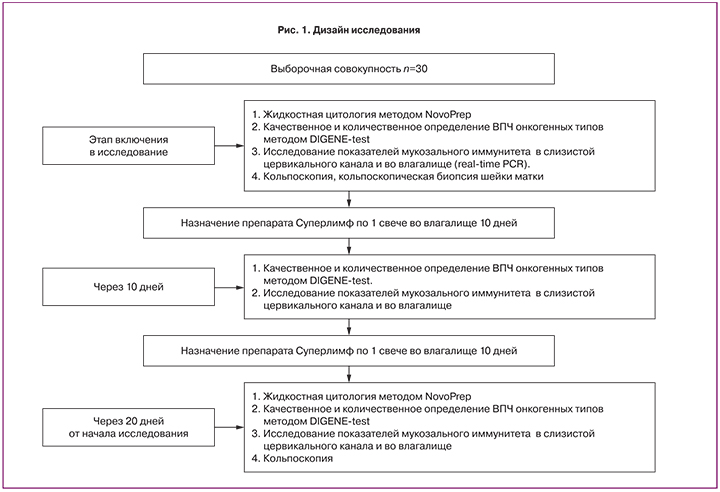
После включения в исследования беременным назначался Суперлимф по 1 свече (25 ЕД) во влагалище в течение 20 дней. Препарат представляет собой естественный комплекс природных противомикробных пептидов и цитокинов – универсальных стимуляторов иммунной системы с активностью фактора, угнетающего миграцию макрофагов, интерлейкина-1, интерлейкина-6, фактора некроза опухоли, трансформирующего фактора роста, секретируемых лейкоцитами периферической крови свиньи (препарат разработан на кафедре иммунологии МБФ РНИМУ).
Суперлимф является иммуномодулятором и обладает противовирусным и противомикробным действием, стимулирует функциональную активность клеток фагоцитарного ряда (моноцитов и нейтрофилов): активирует фагоцитоз, выработку цитокинов (ИЛ-1, TNFа), индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных паразитов, регулирует миграцию клеток в очаг воспаления и увеличивает активность естественных киллеров. Также обладает антиоксидантной активностью, снижает развитие воспалительных реакций, стимулирует регенерацию и эпителизацию раневых дефектов. Согласно официальной инструкции Суперлимф не имеет противопоказаний к применению во время беременности.
Цитологическое исследование проводилось дважды: на момент включения и через 20 дней, и выполнялось методом жидкостной цитологии NovoPrep. Всего выполнено 60 исследований.
Качественное и количественное определение вируса папилломы человека онкогенного типа осуществлялось методом DIGENE-test. Забор материала выполнялся цитощеткой из цервикального канала при включении в исследование, через 10 и 20 дней от начала терапии. Всего проведено 90 проб.
Исследование показателей врожденного иммунитета включало определение экспрессии генов TLR-9, TLR-2, HBD1 и фактора некроза опухоли (TNFa) в эпителиальных клетках цервикального канала и заднего свода влагалища, определяемых методом ПЦР в режиме реального времени. Забор материала из цервикального канала производился цитощеткой (тип D1), из заднего свода влагалища – стерильным гинекологическим зондом (тип А). Исследование экспрессии факторов врожденного иммунитета проводилось на кафедре иммунологии МБФ РНИМУ им. Н.И. Пирогова (зав. кафедрой проф. Ганковская Л.В.). Всего выполнено 180 исследований. Системы для определения факторов иммунитета проводились по стандартной апробированной методике [8, 9].
Для обработки результатов использовался непараметрический метод оценки по критерию Манна-Уитни. Все графики и расчеты выполнялись с использованием программ GraphPad Prism 6 и Microsoft Office Excel. Достоверными считались результаты при P≤0,05.
Результаты исследования и обсуждение
Возраст пациенток основной группы составил от 20 до 41 года (31,6±1,7), в группе сравнения (n=11) от 18 до 45 лет (31,9±2,2). В основной группе преобладали повторнобеременные повторнородящие (n=20, 66,67%), у 75% было 2–3 беременности в анамнезе, у 25% – 4 и более беременностей. 10 пациенток (50%) указали на наличие артифициальных абортов в прошлом. 63,64% пациенток группы сравнения были первобеременными, 36,36% – повторнобеременными повторнородящими. У 2-х женщин в анамнезе был артифициальный аборт.
На момент включения в исследование в основной группе 5 пациенток находились в I триместре (9–12 недель, 16,67%), 11 во втором (20–28 недель, 36,67%) и 14 в III триместре (29–38 недель, 46,67%) беременности.
В группе сравнения 6 женщин были в сроке гестации от 19 до 28 недель (54,55%) и 5 пациенток в сроке от 28 до 35 недель (44,45%). Среди беременных основной группы у 13 (43,33%) была диагностирована дисплазия шейки матки легкой степени (LSIL, биопсия не проводилась), из них в 2-х случаях (15,38%) нельзя было исключить ASC-H. В связи с этим была проведена прицельная биопсия шейки матки и гистологический диагноз совпал с цитологическим – CIN1 (LSIL).
У 17 (56,67%) пациенток выявлена тяжелая дисплазия (HSIL) и была проведена прицельная кольпоскопическая биопсия шейки матки. У 14 беременных гистологический диагноз соответствовал тяжелой дисплазии шейки матки (CIN 2–3 или HSIL). В 3-х случаях (17,65%) диагностирован рак шейки матки: у двоих беременных – карцинома in situ (после курса терапии произведена ножевая конизация шейки матки); у одной пациентки в сроке 34 недели – плоскоклеточный неороговевающий рак с микроинвазией 0,08 см (стадия T1A1aN0M0). По заключению междисциплинарного онкосовета было принято решение о проведении планового кесарева сечения в сроке 38–39 недель с последующей ампутацией шейки матки через 3 недели после родов.
В таблице приведены данные цитологического и гистологического исследований пациенток основной группы, полученные на момент включения в работу.

В 100% случаев у беременных с дисплазией шейки матки обнаруживался вирус папилломы человека (ВПЧ) онкогенного типа. Наиболее часто выявлялся ВПЧ группы А9 (16, 31, 33, 35, 52, 58 типы) – у 20 пациенток (66,67%). ВПЧ группы А5/А6 (51 и 56 типы) был у 11 (36,67%) женщин, а группы А7 (18, 39, 45, 59, 68 типы) у 4-х (13,33%) беременных. В большинстве случаев женщины были инфицированы ВПЧ одной группы, только у 4-х (13,33%) выявлено сочетание представителей различных групп вируса.
Количественная оценка вирусной нагрузки показала, что до начала терапии титр вирусов группы А9 составлял 5,2±1,2 Lg ДНК на 105 клеток для. Через 10 дней терапии препаратом Суперлимф цифры снижались до 4.5 ±0.8 Lg ДНК на 105 клеток, а через 20 дней терапии – до 4,3±0,2 Lg ДНК на 105 клеток.
Для вирусов группы А5/А9 не было выявлено изменений вирусной нагрузки: до начала терапии средние показатели были 3,3±1,1 Lg ДНК на 105 клеток, через 10 дней – 3,4±0,9 Lg ДНК на 105 клеток, через 20 дней – 3,3±0,4 Lg ДНК на 105 клеток.
Для вирусов группы А7 отмечена положительная динамика со значительным снижением количества вирусных частиц: до начала терапии 4,9±1,9 Lg ДНК на 105 клеток, через 10 дней – 4,4±1,3 Lg ДНК на 105 клеток, через 20 дней – 2,7±0,9 Lg ДНК на 105 клеток.
Таким образом, проведенный количественный анализ динамики вирусной нагрузки на фоне терапии препаратом Суперлимф выявил его положительное влияние в виде снижения количества вирусов папилломы человека группы А9 (16, 31, 33, 35, 52, 58 типы) в 1,2 раза и вирусов группы А7 (18, 39, 45, 59, 68 типы) в 1,8 раз. Не было выявлено изменений в титре вирусов 51 и 56 типов. У 3 пациенток на фоне проводимой терапии отмечено увеличение вирусной нагрузки для группы А5/А6 с 4,7 до 6,4 Lg ДНК на 105 клеток.
После окончания курса терапии проводился повторный забор материала для цитологического исследования, из 30 образцов ни в одном не было отмечено прогрессирования дисплазии. В 8 случаях (29,63%) зафиксированы положительные изменения результатов: регресс с HSIL до ASCUS в 1 случае; с HSIL до LSIL в 2 случаях; с ASC-H до LSIL в 1 случае; с ASC-H до ASCUS в 1 случае; с LSIL до NILM в 2 случаях и регресс с HSIL до LSIL в 1 случае. У 2 двух пациенток цитологический диагноз дисплазии шейки матки был снят.
Поскольку спектр штаммов ВПЧ и вирусная нагрузка у пациенток с дисплазией шейки матки были различные, то возникла необходимость исследования иммунных факторов, которые могли бы повлиять на течение инфекционного процесса. В настоящем исследовании внимание было сконцентрировано на врожденном иммунитете, механизмы которого развиваются в ответ на вирусную инфекцию на уровне слизистых оболочек. Были выделены четыре фактора, которые могут дать информацию о состоянии защитных механизмов: TLR2 (может распознавать поверхностные структуры ВПЧ), TLR9 (распознает ВПЧ), TNFa (один из ключевых провоспалительных цитокинов), HBD-1 (дефенсин, обеспечивающий защиту от вирусов на уровне слизистых оболочек). Материалом для исследования были эпителиальные клетки, взятые со слизистых оболочек различных локализаций – из цервикального канала и из влагалища.
В результате наших исследований было выявлено, что в норме экспрессия TLR2 была значительно выше (в 6 раз) в эпителиальных клетках цервикального канала, чем в клетках влагалища. При этом экспрессия гена TLR9 отличалась в обратную сторону. Во влагалище уровень экспрессии исследуемого гена превышал аналогичный показатель в 2,9 в клетках цервикального канала. Это можно объяснить тем, что клетки цервикального канала постоянно контактируют с патогеном (как бактериальными, так и вирусными), нужен контроль со стороны врожденного иммунитета, который осуществляется опосредованно через TLR2. TLR9 – более значимый фактор в плане определения вирусной инфекции, поэтому его наличие и количество крайне нужны уже во влагалище. Экспрессия гена TNFa также активируется на патогены, которые локализуются в клетках влагалища. Продукция бета дефенсина 1 генетически опосредована и конститутивна, поэтому показатель экспрессии достоверно не отличается в эпителиальных клетках различной локализации.
При исследовании факторов врожденного иммунитета были выявлены следующие закономерности. Фактор некроза опухоли у пациенток с LSIL до начала терапии превышал показатели номы в 3 раза в цервикальном канале и в 1,4 раза во влагалище. На фоне проводимой терапии через 10 и 20 дней было выявлено увеличение экспрессии гена TNFa в цервикальном канале от исходного в 1,6 раз и в 27 раз соответственно. В эпителиальных клетках влагалища через 10 дней терапии отмечено незначительное снижение экспрессии гена, с последующим его увеличением почти в 3 раза на 20-й день (рис. 1).
У беременных с HSIL экспрессия гена фактора некроза опухоли в эпителии цервикального канала до лечения в 2,9 раз превышала показатели нормы и продолжала возрастать на фоне проводимой терапии в 1,7 и в 1,9 раз от исходного. Во влагалище до терапии уровень гена был снижен в 1,4 раза по сравнению с нормой, но на фоне применения препарата Суперлимф возрастал в 6,7 раз к 20-му дню.
До начала терапии у пациенток с LSIL в цервикальном канале экспрессия гена TLR-9 превышала норму в 3,8 раза, а во влагалище соответствовала показателям группы сравнения. У беременных с HSIL исходный уровень экспрессии гена в цервикальном канале соответствовал норме, а во влагалище был в 3 раза ниже. Индукция экспрессии генов TLR-9 в цервикальном канале была отмечена только для пациенток с HSIL и проявлялась ее 3-х кратным увеличением на 10 сутки с сохранением уровня на 20-й день терапии (рис. 2).

В клетках свода влагалища у пациенток с LSIL на фоне применения препарата Суперлимф экспрессия TLR-9 увеличивалась в 3 раза. У беременных с HSIL до начала терапии экспрессия гена TLR-9 была снижена в 2 раза по сравнению с нормой, а на фоне проводимой терапии отмечено ее скачкообразное увеличение к 10-му дню со стабилизацией на уровне показателей пациенток с LSIL к 20-му дню.
У беременных с LSIL до начала лечения TLR-2 в цервикальном канале и во влагалище превышал норму в 2 и в 8 раз соответственно, а через 20 дней терапии практически соответствовал показателям нормы. У пациенток с HSIL исходные уровни гена в цервикальном канале были ниже нормы, но возрастали в 2 раза к 20-му дню лечения. Во влагалище увеличение экспрессии гена TLR-2 к 10-му дню происходило в 3,8 раза, а к 20-му дню – в 41 раз от исходного и в 152 раза превышало показатели нормы (рис. 3).

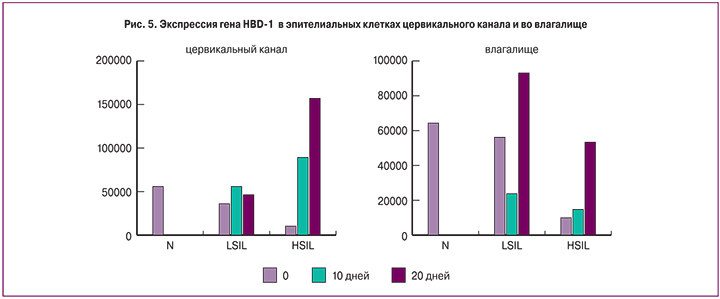
До проведения терапии уровень экспрессии гена HBD-1 у пациенток основной группы был в три и более раз ниже нормальных значений как в клетках цервикального канала, так и во влагалище (вне зависимости от тяжести дисплазии). После проведения терапии в цервикальном канале продукция дефенсина постепенно увеличивалась, достигая нормальных значений к 20-му дню (рис. 4).
В клетках свода влагалища экспрессия дефенсина до начала терапии была значительно снижена, нормализация до показателей группы сравнения отмечена у беременных с LSIL к 20-му дню. У пациенток с HSIL к 10-му дню лечения уровень экспрессии возрастал незначительно, но к 20-му дню практически достигал нормы.
При сопоставлении уровня вирусной нагрузки с показателями врожденного иммунитета, нами было выявлено, что у пациенток с ВПЧ (группа А9), у которых вирусная нагрузка не менялась в течение всего времени проведения терапии экспрессия TNFa в цервикальном канале была повышена в 2 раза (по сравнению с группой сравнения) и оставалась стабильной. У женщин, у которых вирусная нагрузка (ВПЧ группы А9) снижалась, уровень TNFa возрастал в 2 раза.
Была установлена корреляция между уровнем экспрессии рецептора TLR-9, распознающего вирусную ДНК и уровнем вирусной нагрузки.
Функцией TLR-2 является распознавание белков оболочки вируса. Его экспрессия возрастала в 5,5 раза у беременных с дисплазией шейки матки и ВПЧ группы А9, приводя к значительному снижению вирусной нагрузки. Во влагалище у большинства пациенток была выявлена аналогичная зависимость, проявляющаяся снижением вирусной нагрузки на фоне увеличения экспрессии гена TLR-2.
У нескольких беременных с ВПЧ группы А9, титр вирусной нагрузки оставался стабильным на фоне резкого увеличения экспрессия рецепторов TLR-2.
Возможно, 20-ти дневного курса лечения в их случае не было достаточно для получения снижения вирусной нагрузки.
HBD-1 является противомикробным пептидом, который секретируется клетками эпителия слизистой оболочки и обладает прямым противовирусным, противобактериальным и противогрибковым действием. Было обнаружено, что у пациенток со стабильной экспрессией гена HBD-1 в цервикальном канале не происходило изменения и вирусной нагрузки. В клетках свода влагалища применение препарата Суперлимф привело к активации гена HBD-1, при этом увеличение его экспрессии в 2 раза не сопровождалось снижением вирусной нагрузки, а увеличение в 7 и более раз – приводило к значительному снижению титра ВПЧ группы А9.
Заключение
Нами было подтверждено, что в 100% случаев при дисплазии шейки матки обнаруживается вирус папилломы человека онкогенного типа, преимущественно группы А9 (16, 31, 33, 35, 52, 58 типы) и в титре, превышающим 3,5 Lg ДНК на 105 клеток. Экспрессия факторов врожденного иммунитета у беременных с дисплазией шейки матки отличаются от показателей нормы и отражала напряженность факторов противовирусной защиты, как в эпителии цервикального канала, так и во влагалище. Для большинства изучаемых показателей выявлено значительное превышение исходного уровня экспрессии генов. На фоне проведения терапии препаратом Суперлимф во всех образцах (в цервикальном канале и во влагалище) вне зависимости от тяжести дисплазии отмечалось увеличение экспрессии генов, отвечающих за распознавание вирусной ДНК и за выработку цитокинов. На фоне проводимой терапии и увеличения экспрессии генов факторов местного иммунитета отмечено снижение вирусной нагрузки и улучшение результатов цитологического исследования.
Выявлено постепенное снижение вирусной нагрузки у 90% пациенток: снижение в 1,2 раза для ВПЧ группы А9 (16, 31, 33, 35, 52, 58 типы) и в 1,8 раз для ВПЧ группы А7 (18, 39, 45, 59, 68 типы). После окончания терапии в 29,63% случаев отмечена положительная динамика результатов жидкостной цитологии, с ее полной нормализацией у 7,4% беременных. У женщин с дисплазией шейки матки на фоне проведения терапии в эпителии цервикального канала отмечалось 2-х кратное увеличение экспрессии гена фактора некроза опухоли, в 10 и более раз возросло количество противомикробного гена НBD-1 и экспрессии генов распознающего рецептора TLR9 и TLR2, что и привело к снижению титра ВПЧ. В эпителии влагалища на фоне лечения экспрессия гена HBD-1 возрастала вне зависимости от титра вируса. Наблюдалось выраженное увеличение экспрессии гена TNFa по сравнению с таковым в цервикальном канале и не зависело от динамики вирусной нагрузки.
Таким образом, в большинстве случаев изменение вирусной нагрузки, наблюдаемое при использовании препарата Суперлимф, коррелировало с активацией показателей врожденного иммунитета как в слизистой цервикального канала, так и во влагалище. Возможно, компоненты препарата Суперлимф активирует экспрессию генов распознающих рецепторов врожденного иммунитета (TLR2 и TLR9) и эффекторных молекул c противовирусным действием (TNFa и противомикробного пептида HBD-1).
Следствием активации механизмов врожденного иммунитета является снижение вирусной нагрузки, особенно выраженное для вирусов папилломы человека группы А9.



