Онкологическое заболевание диагностируется в одном случае из тысячи у беременных женщин, что составляет от 0,07% до 0,1% всех случаев злокачественных заболеваний [1, 2]. Самыми распространенными заболеваниями, диагностируемыми во время гестации, являются рак молочной железы, рак шейки матки, лимфома Ходжкина, меланома и лейкемии [2]. Эти же типы рака являются самыми распространенными среди молодых женщин репродуктивного возраста [3].
Золотым стандартом ведения пациенток с выявленным онкологическим заболеванием во время беременности является следующий приоритет действий: 1. сохранение и улучшение жизни матери; 2. лечение онкологического заболевания; 3. защита плода и новорожденного от пагубного влияния терапии онкологического заболевания; 4. сохранение репродуктивной системы матери [2]. Несмотря на то что сохранение фертильности является последним пунктом лечения данной группы пациенток, этим аспектом не стоит пренебрегать. Пациентки с онкологическим заболеванием во время беременности должны быть проконсультированы о возможных методах сохранения детородной функции.
В настоящее время способы сохранения фертильности включают криоконсервацию ооцитов и/или эмбрионов после стимуляции суперовуляции яичников, криоконсервацию ооцитов и/или эмбрионов после дозревания яйцеклеток в условиях in vitro (IVM), криоконсервацию овариальной ткани или комбинацию этих методов [4].
В мировой практике известны всего несколько клинических случаев сохранения фертильности у пациенток во время беременности или сразу после родов. В 1997 г. был описан случай донации незрелых ооцит-кумулюсных комплексов (ОКК), аспирированных во время кесарева сечения, бесплодной паре, в которой женщина страдала преждевременной недостаточностью яичника [5]. Семь незрелых яйцеклеток были получены в ходе операции, из которых 2 успешно дозрели через 48 ч IVM. 2 эмбриона на стадии двух бластомеров были перенесены в полость матки реципиента, что привело к развитию нормальной беременности [5].
Также известен случай аспирации маленьких фолликулов из ткани яичника во время кесарева сечения из правого яичника, выделения незрелых ОКК из левого яичника после овариэктомии и криоконсервации яичниковой ткани у пациентки с рабдомиосаркомой на 37 неделе гестации [6]. Такой комплексный подход к сохранению фертильности привел к криоконсервации 14 фрагментов овариальной ткани и 12 зрелых ооцитов [6].
Кроме того, доложен случай криоконсервации овариальной ткани после удаления половины яичника во время кесарева сечения, совмещенный со стимуляцией суперовуляции через неделю после родов пациентке с лимфомой Ходжкина на 40 неделе гестации [7]. Во время трансвагинальной пункции фолликулов было получено 4 яйцеклетки, из которых только 2 оказались зрелыми. Одна яйцеклетка оплодотворилась и была криоконсервирована [7].
Наше исследование включает 3 клинических наблюдения и дополняет существующие знания о возможности дозревания яйцеклеток, полученных из ткани яичника после его удаления, у пациенток с диагностированным во время беременности онкологическим заболеванием. В двух случаях у пациенток с раком молочной железы овариэктомия была произведена во время кесарева сечения на 32–36 неделях гестации и в одном случае – во время радикальной пангистерэктомии с прерыванием беременности на сроке 10 недель. Во всех трех случаях были выделены незрелые яйцеклетки, которые дозрели в условиях in vitro и были криоконсервированы. В дальнейшем эти ооциты могут быть использованы в программах ЭКО.
Материалы и методы
Овариэктомия и криоконсервация ткани яичника
В ходе лапаротомической операции или операции кесарева сечения производилась двусторонняя овариэктомия. Оба яичника транспортировали в лабораторию вспомогательных репродуктивных технологий (ВРТ) в предварительно нагретом (37°С) 0,9% растворе NaCl в течение 15 минут. После аспирации видимых антральных фолликулов при помощи 21 G иглы кортикальный слой яичника (толщиной около 1 мм) отделяли от мозгового на подогреваемой поверхности (37°С) в ламинарном боксе. Кортикальную ткань нарезали на фрагменты (0,5×0,5 см) и эквилибрировали в течение 30 минут на льду в растворе для криоконсервации, содержащем этиленгликоль и сахарозу, а затем помещали в криопробирки (Nunc, Thermo Fischer Scientific, Copenhagen, Denmark) по 4 фрагмента в каждую пробирку. Образцы замораживали с использованием медленного протокола криоконсервации [8] в программируемом замораживателе (Kryo 10; series 10/20, Planer Biomed, Sunbury on Thames, UK).
Сбор и дозревание ооцитов
Сбор и дозревание ооцитов производились по описанной нами ранее методике [9].
Денудация и криоконсервация ооцитов
Все ооциты были денудированы с помощью раствора гиалуронидазы (SynVitro Hyadase, Origio, CooperSurgical) путем бережного пипетирования для удаления клеток кумулюса. После денудации оценивались морфологические особенности зрелых ооцитов с применением инвертированного микроскопа (Ti-U eclipse, Nikon).
Все зрелые ооциты были криоконсервированы методом витрификации согласно протоколу производителя (Kitazato vitrification kit, Kitazato).
Результаты
Описание клинических наблюдений
Наблюдение 1. Пациентка З., 38 лет, находящаяся на сроке беременности 18 недель, самостоятельно обнаружила покраснение левой молочной железы над областью рубца после хирургического удаления фиброаденомы в 36 лет. По результатам гистологического исследования, проведенной пункционной CORE-биопсии в РОНЦ им. Н.Н. Блохина, выставлен диагноз – рак левой молочной железы T3N3M0. Проведен 1 курс паллиативной химиотерапии. В начале II триместра беременности отмечено повышение показателей печеночных ферментов до 220 МЕ/л, в связи с чем было решено отменить последующие курсы химиотерапии.
По результатам осмотра врача-онколога, учитывая гепатотоксичность цитостатической терапии, с учетом распространения опухоли, было показано досрочное родоразрешение при сроке беременности 32–33 недели.
Данная беременность у пациентки вторая, в анамнезе проведена операция вакуум-аспирации плодного яйца после неразвивающейся беременности на сроке 7 недель. Наследственность не отягощена, однако ранее перенесены вирусные гепатиты А и В. Менархе случилось в 15 лет и продолжалось регулярными менструациями.
В феврале 2019 г. в условиях Центра на сроке беременности 32 недели 2 дня пациентке путем операции кесарева сечения произведены родоразрешение и двусторонняя аднексэктомия, в результате чего родился живой недоношенный мальчик массой 1857 г и длиной 42 см, с оценкой по шкале Апгар 7/8 баллов.
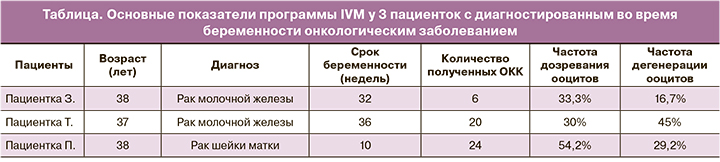
Корковый слой яичников был криоконсервирован. Из двух яичников было получено 6 ОКК. После 48 ч дозревания 2 ооцита достигли стадии MII и 1 – стадии MI, 2 ооцита остановились на стадии GV и 1 ооцит дегенерировал (см. таблицу). Все зрелые ооциты имели нормальную морфологию. После дополнительных 24 ч культивирования ни один ооцит не достиг стадии MII. Частота дозревания ооцитов для данной пациентки составила 33,3% (2/6). Зрелые ооциты были витрифицированы.
Наблюдение 2. Пациентка Т., 37 лет, находящаяся на 28-й неделе беременности, самостоятельно обнаружила в левой молочной железе 2 образования, после чего обратилась в частный медицинский центр. По данным ультразвукового исследования (УЗИ) патологии не было выявлено, в связи с этим выставлен диагноз – лактостаз и даны рекомендации по расцеживанию молочной железы. Пациентка следовала рекомендациям в течение двух дней, после чего в области уплотнений левой молочной железы образовалась гематома с ярким гиперемированным венчиком. В том же медицинском центре выставлен диагноз – абсцесс и рекомендовано хирургическое лечение. Пациентка обратилась в РОНЦ им. Н.Н. Блохина с результатами УЗИ, где ей была проведена пункционная CORE-биопсия, после которой, по результатам гистологического и иммуногистохимического исследований выявлен рак молочной железы T3N2M0 ретропозитивного подтипа В. По итогам консилиума в РОНЦ им. Н.Н. Блохина рекомендованы раннее родоразрешение на сроке 35–36 недель, выключение функции яичников, подавление лактации и проведение неоадъювантной паллиативной химиотерапии.
Данная беременность у женщины шестая, в анамнезе 1 оперативные роды, 1 неразвивающаяся беременность на сроке 8 недель и 3 самопроизвольных выкидыша на сроках 8, 21 и 12 недель беременности, 2 из которых сопровождались множественными пороками развития плода. Настоящая беременность осложнена врожденным пороком развития центральной нервной системы плода в виде вентрикуломегалии слева. Менархе случилось в возрасте 13 лет и продолжалось регулярными менструациями.
В феврале 2019 г. в условиях Центра, на сроке беременности 36 недель 2 дня пациентке произведено родоразрешение путем операции кесарева сечения, в результате которого родилась живая недоношенная девочка массой 2610 г и длиной 47 см, с оценкой по шкале Апгар 8/9 баллов, а также двусторонняя аднексэктомия.
Из двух яичников было получено 20 ОКК. После 48 ч культивирования в среде дозревания 6 ооцитов достигли стадии MII и 1 – стадии MI, 3 ооцита остановились на стадии GV, 9 ооцитов дегенерировали и 1 ооцит был фрагментирован (см. таблицу). Все зрелые ооциты имели расширенное перивителлиновое пространство и один ооцит имел фрагментированное полярное тельце. После дополнительных 24 ч культивирования ни один ооцит не достиг стадии MII. Частота дозревания ооцитов для данной пациентки составила 30% (6/20). Все зрелые ооциты были витрифицированы. Корковый слой яичника был криоконсервирован.
Наблюдение 3. Пациентка П., 38 лет, обратилась в женскую консультацию на сроке беременности 9 недель с жалобами на контактные кровянистые выделения из половых путей. При влагалищном исследовании обнаружена опухоль шейки матки до 5 см в диаметре, переходящая на левый свод влагалища. По данным гистологического и иммуногистохимического исследований диагностирована мелкоклеточная нейроэндокринная опухоль шейки матки, после чего пациентка обратилась в Центр.
Из перенесенных ранее заболеваний – хронический гастрит в стадии ремиссии; семейный анамнез не отягощен. В возрасте 32 лет произведена холецистэктомия лапароскопическим доступом. Пациентка курит в течение 15 лет и употребляет по 1 пачке сигарет в день.
Менархе случилось в возрасте 16 лет и продолжалось регулярными и безболезненными менструациями. В анамнезе у пациентки 3 беременности, 2 из которых завершились своевременными самопроизвольными родами, 1 – неразвивающейся беременностью малого срока; настоящая беременность 4-я.
Учитывая наличие гистологически верифицированного мелкоклеточного рака шейки матки, диагностированного на фоне I триместра беременности, невозможность проведения неоадъювантной химиотерапии, высокий риск прогрессирования, консилиумом Центра было принято решение о проведении на первом этапе радикального хирургического лечения с прерыванием беременности на сроке 10 недель. В июне 2019 г. в условиях Центра была проведена нижнесрединная лапаротомия, расширенная гистерэктомия с маточными трубами Piver III (тип С-2) – операция Вертгейма, интраоперационно было принято решение о проведении двусторонней овариэктомии. По результатам гистологического исследования подтверждена низкодифференцированная нейроэндокринная карцинома шейки матки (NEC G3, мелкоклеточный нейроэндокринный рак, Ki-67=100%) с инвазией на всю толщину стенки шейки, без инвазии в параметрии, с распространением на верхнюю треть влагалища (3 см), с лимфоваскулярной инвазией, а также обнаружены макрометастазы нейроэндокринного рака в левом яичнике. Овариальная ткань правого яичника была криоконсервирована.
Из двух яичников было получено 24 ОКК. После 48 ч культивирования в среде дозревания 10 ооцитов достигли стадии MII, 7 ооцитов остановились на стадии GV и 7 ооцитов дегенерировали. Все зрелые ооциты имели нормальную морфологию. После дополнительных 24 ч культивирования еще 3 ооцита достигли стадии MII (см. таблицу). Один из них был аномально большого размера, 1 был аномальной формы и содержал вакуоль в цитоплазме и 1 имел фрагментированное полярное тельце. Частота дозревания ооцитов для данной пациентки составила 54,2% (13/24). 12 ооцитов стадии MII (за исключением гигантского) были витрифицированы.
Обсуждение
В нашем исследовании мы продемонстрировали потенцию незрелых ооцитов, полученных из ткани яичника после его удаления у беременных женщин с онкологическими заболеваниями, к дозреванию в условиях in vitro. В настоящее время известно лишь несколько работ, описывающих выделение и дозревание незрелых ОКК во время беременности на животной модели или в виде отдельных клинических случаев [5, 6].
Большой интерес представляет то, что ооциты сохраняют способность к дозреванию даже на поздних сроках гестации. Ранее было показано, что фаза менструального цикла не влияет на количество полученных ооцитов в программах IVM, процент дозревших и оплодотворившихся яйцеклеток и количество замороженных эмбрионов [10]. В норме у небеременной женщины можно выделить 2–3 волны развития фолликулов в течение цикла [11]. Во время беременности наблюдается уникальный гормональный фон c низким уровнем концентрации гонадотропинов и отсутствием цикличных эндокринных изменений, который неблагоприятен для фолликулогенеза [12]. Кроме того, во время беременности супрессирована овуляция, а антральные фолликулы, достигнув размера 4–5 мм, дегенерируют [13, 14]. Во время беременности фолликулогенез происходит неравномерно, и наблюдается несколько всплесков роста фолликулов, которые сменяются их атрезией. Во время первых 7 недель беременности признаков фолликулогенеза не наблюдается. Он возобновляется на 10 неделе, когда вновь появляются антральные фолликулы. С 20 недели гестации фолликулогенез почти не идет, и большинство антральных фолликулов в яичниках атретичны. Начиная с 33 недели, рост фолликулов возобновляется, и в яичнике появляются граафовы пузырьки, которые в геометрической прогрессии увеличиваются в количестве и достигают максимума к 40 неделе [13]. К концу беременности в яичнике можно наблюдать 15–20 антральных фолликулов до 6 мм в диаметре [13, 15].
В нашем исследовании 30–54% яйцеклеток сохранили компетенцию к завершению мейоза. Интересно, что наибольшая способность к дозреванию in vitro наблюдалась у пациентки в I триместре беременности (54,2%), в то время как у пациенток в III триместре такая способность была снижена (30–33%).
Предыдущие исследования описывают, что большая часть антральных фолликулов в яичнике во время беременности дегенеративные [13, 15], и лишь 7% фолликулов жизнеспособны [15]. В нашем исследовании процент дегенеративных ооцитов варьировал от 16,7% до 45%, и большая часть ооцитов были жизнеспособны.
Незрелые ОКК могут быть получены путем аспирации во время кесарева сечения или из мозгового слоя яичника после его удаления. В нашем исследовании ОКК были выделены путем извлечения антральных фолликулов из яичника ex vivo. Мы полагаем, что данный способ получения ОКК является наиболее эффективным, так как он позволяет выделить даже маленькие фолликулы 0,5–2 мм в диаметре, находящиеся в глубине яичника и недоступные для аспирации. Так, было показано, что из мозгового слоя яичника ex vivo можно выделить в 2 раза больше ОКК, чем применяя технологию аспирации [6].
Ограничением нашего исследования является то, что оно состоит из отдельных клинических наблюдений. Для того чтобы выявить эффективность технологии ex vivo IVM у пациенток, у которых было выявлено онкологическое заболевание во время беременности, требуются более широкие исследования на большей группе пациенток.
Тем не менее, наше исследование дает обнадеживающие результаты. Технология ex vivo IVM может быть использована для сохранения фертильности пациенток, у которых рак был диагностирован во время беременности. Яичник может быть удален во время планового кесарева сечения. После овариэктомии корковый слой яичника может быть криоконсервирован, а из мозгового слоя могут быть выделены незрелые яйцеклетки, способные к созреванию в условиях in vitro.
Несколькими авторами было предложено использование данного подхода для получения донорских [16] или собственных [6] яйцеклеток для использования в программах ЭКО. Такой подход позволит избежать дополнительного хирургического вмешательства, снизит риски, ассоциированные со стимуляцией суперовуляции яичников и снизит стоимость лечения.
Заключение
Таким образом, незрелые ОКК могут быть успешно выделены из мозгового слоя яичника после его удаления во время кесарева сечения. Технология ex vivo IVM является перспективным методом сохранения фертильности пациенток, у которых онкологическое заболевание было диагностировано во время беременности. Дозревшие in vitro яйцеклетки могут быть витрифицированы или использованы для проведения программы ЭКО.



