Преждевременные роды (ПР), являющиеся составляющей больших акушерских синдромов, остаются главной причиной перинатальной заболеваемости и младенческой смертности, а их частота не имеет тенденции к снижению [1-3].
Известно, что ПР представляют собой раннюю идиопатическую активацию нормального процесса родов, основой которой является воспалительная децидуальная активация, которая проявляется развитием окислительного стресса, усилением процессов апоптоза на клеточном и субклеточном уровнях [4, 5], что, в свою очередь, сопровождается дисбалансом в продукции активных форм кислорода (АФК) и факторов антиоксидантной защиты [5, 6]. В работе S.M. Yellon et al. [4] показано, что воспаление, вызванное инфекцией, и другие факторы риска спонтанных ПР и преждевременного разрыва плодных оболочек могут вызвать окислительно-восстановительный дисбаланс, увеличивая высвобождение свободных радикалов и разрушая антиоксидантную защиту [7-9]. Окислительный стресс может инициировать внутриклеточные сигнальные каскады, которые увеличивают продукцию провоспалительных медиаторов.
Следует отметить, что модификации, вызванные дисбалансом АФК и антиоксидантного статуса (АОС), приводят к появлению новых функциональных групп, таких как гидроксильные или карбонильные группы, что приводит к фрагментации белка, образованию перекрестных связей белок- белок, нарушению третичной структуры и потере функциональной активности [10-12]. Кроме того, АФК обладают общебиологическим токсическим действием, приводя к прямому перекисному окислению мембран, белков, структурных ферментов, а также нуклеиновых кислот [13-15].
В связи с вышеизложенным, представляет интерес определение уровня АФК и антиоксидантов для совершенствования ранней диагностики и прогнозирования ПР.
Цель исследования: определить содержание про- и антиоксидантов в капиллярной крови беременных женщин при ПР и при физиологической беременности на аналогичных ПР сроках.
Материалы и методы
В исследование включены 47 беременных, разделенных на 2 группы: группу 1 (основную) составила 31 женщина с ПР; группу 2 (контроля) — 16 пациенток без отягощенного акушерского анамнеза, родоразрешенных на доношенном сроке беременности. В группе контроля материал для исследования был набран на аналогичных ПР сроках.
Исследование было проведено на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, одобрено локальным этическим комитетом; все беременные подписали добровольное информированное согласие.
Критериями включения явились: одноплодная беременность на сроке от 220 до 366 недель с интактными плодными оболочками и наличие клинических признаков ПР. Для определения срока беременности использовались общепринятые методы и результаты ультразвукового скрининга в I триместре.
Критериями исключения были: многоплодная беременность, резус-сенсибилизация, тяжелая экстраге- нитальная патология, задержка роста плода, преэклампсия.
В качестве исследуемого материала была использована капиллярная кровь, центрифугированная при 800g в течение 1 мин. Кровь набирали в капилляры. Интервал времени между забором крови у пациенток и проведением исследования был не более 25 мин.
АФК определяли с помощью теста FORT («Каллегари», Италия), колориметрического анализа, основанного на способности переходных металлов, таких как железо, катализировать распад гидропероксидов (ROOH) на производные радикалы в соответствии с реакцией Фентона. Растворяясь в кислотном буфере, гидропероксиды реагировали с ионами переходных металлов, высвобождающимися из белков в кислой среде, и превращались в алкокси- (RO') и перокси- (ROO') радикалы. Виды радикалов, образующихся в результате реакции, взаимодействуют с добавкой (производным фенилендиамина [2CrNH2]), образующей окрашенный, довольно долгоживущий катион-радикал, который можно оценить с помощью спектрофотометра при 505 нм (реакция на основе линейной кинетики, 37°C). Интенсивность цвета напрямую коррелирует с количеством радикальных соединений, концентрацией гидропероксидов и, следовательно, с окислительным статусом образца в соответствии с законом Ламберта-Бера.
R-OOH + Fe — RO' + OH-+ Fe3+
R-OOH + Fe3— ROO' + H++ Fe2+
RO'+ ROO' + 2CrNH2 — ROO- + RO- + [CrNH2+']
Результаты выражаются в виде эквивалентных концентраций H2O2, ммоль/л.
Тест FORD использует предварительно сформированные стабильные и окрашенные радикалы и определяет снижение абсорбции, которое пропорционально концентрации антиоксиданта в крови в образце в соответствии с законом Ламберта-Бера. В присутствии кислого буфера (pH=5,2) и окислителя (FeCl3) хромоген, содержащий Т-амино-N, N-диэтиланилинсульфат, образует стабильный и окрашенный катион-радикал, обнаруживаемый фотометрически при 505 нм. Антиоксидантные соединения в образце уменьшают катион-радикал хромогена, вызывая обесцвечивание раствора, которое пропорционально их концентрации. Значения оптической плотности, полученные для образцов, сравнивают со стандартной кривой, полученной с использованием Trolox (6-гидрокси-2,5,7,8-тетраметилхроман-2-кар- боновая кислота), производного витамина Е для проницаемых клеток, обычно используемого в качестве антиоксиданта.
Хромоген(без цвета) + Fe2+ + H+ — хромоген'+(фиолетовый) Хромоген + (фиолетовый) + AOH — хромоген (без цвета) + AO Полученные значения оптической плотности сравнивали со стандартными кривыми, полученными для Trolox (6-гидрокси-2,5,7,8-тетраметил- хроман-2-карбоновая кислота), производного витамина E с повышенной растворимостью в воде. Значения FORD представлены в эквивалентах Trolox, ммоль/л.
Статистический анализ
Результаты представлены в тексте в виде медианы, верхнего и нижнего квартилей — Me (Q1;Q3), на рисунках — в виде диаграмм размаха (5%, Q1, Me, Q3, 95%). Статистическая значимость различий рассчитывалась с помощью непараметрического критерия Манна-Уитни. Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Различия считали статистически значимыми при p<0,05. Для определения эффективности проводимого исследования использовался ROC-анализ. Данные ROC-анализа представлены в виде площади под кривой (AUC) с 95% доверительным интервалом (ДИ). Статистическая обработка результатов и построение графиков проводились с помощью программ OriginPro 8.5 (USA), Attestat (Россия) и Statistica 10.
Результаты и обсуждение
Основные клинико-анамнестические данные и особенности течения беременности у женщин представлены в таблице.
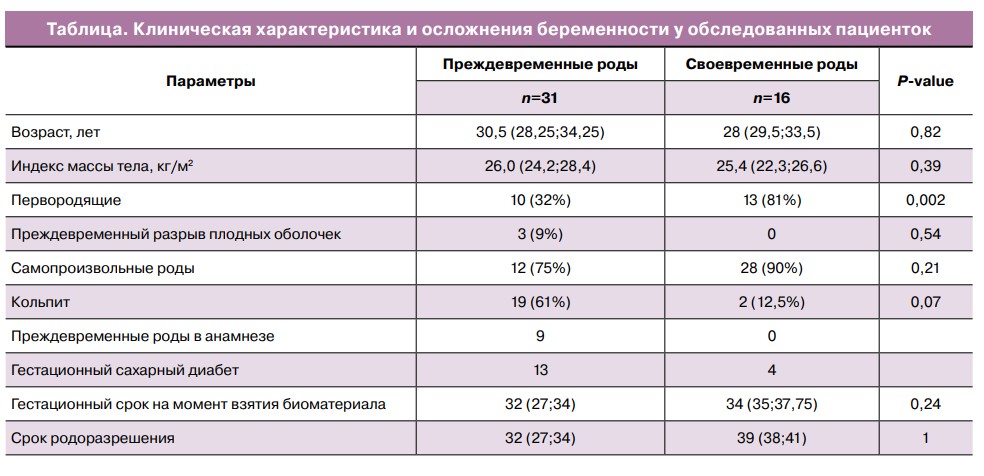
Как видно из данных, представленных в таблице, возраст женщин не имел статистически значимых различий между группами и составил 30,5 (28,25;34,25) лет в группе ПР и 28 (29,5;33,5) лет в группе контроля. Также не было статистически значимых различий в индексе массы тела между группами. Были выявлены факторы риска развития ПР: паритет, ПР в анамнезе и кольпит. В то же время гестационный сахарный диабет и вид родоразрешения не были отнесены к факторам риска.
Содержание АФК и антиоксидантов в группах женщин с ПР и при физиологической беременности на аналогичных сроках представлены на рисунке 1.
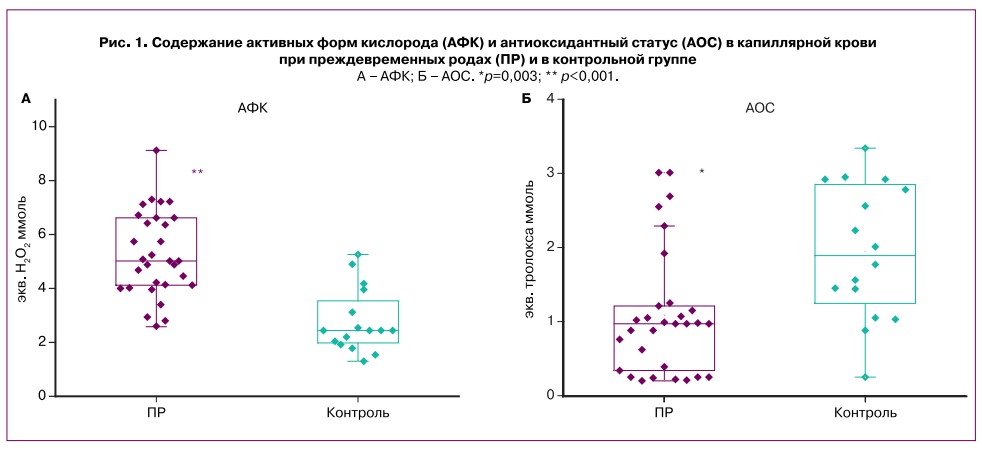
В группе пациенток с ПР наблюдалось повышение АФК по сравнению со своевременными родами. Содержание АФК составило 2,51 (2,06;3,03) ммоль/л и 1,22 (1,22;1,66) ммоль/л (по группам соответственно) (р=0,01) (рис. 1А). ROC-анализ показал отличную значимость: AuC=0,90 (95% ДИ 0,81-0,99), чувствительность составила 100% (95% ДИ 0,9-1), специфичность — 69% (95% ДИ 0,5-0,69), прогностическая ценность положительного результата — 86% (95% ДИ 0,77-0,86), прогностическая ценность отрицательного результата — 100% (95% ДИ 0,73-1) при оптимальном пороге 2,6 ммоль/л. При этом уровень антиоксидантов был значимо выше в группе контроля, что представлено на рисунке 1Б. Их содержание в капиллярной крови составило в контрольной группе 1,5 (1,03;2,31) ммоль/л, у женщин с ПР — 0,97 (0,35;1,195) ммоль/л. Площадь под ROC-кривой AUC=0,77 (95% ДИ 0,63-0,91) с чувствительностью 80% (95% ДИ 0,68-0,88) и специфичностью 75% (95% ДИ 0,57-0,9), прогностическая ценность положительного результата — 86% (95% ДИ 0,73-0,94), прогностическая ценность отрицательного результата — 61% (95% ДИ 0,47-0,8) при оптимальном пороге 1,25 ммоль/л.
Наибольшую значимость показало сочетанное определение обоих параметров (АФК+АОС), AUC=0,93 (95% ДИ 0,85-1), чувствительность — 93% (95% ДИ 0,82-0,99), специфичность — 81% (95% ДИ 0,610,91), прогностическая ценность положительного результата — 90% (95% ДИ 0,8-0,95), прогностическая ценность отрицательного результата — 87% (95% ДИ 0,65-0,97) при оптимальном пороге 0,55 (рис. 2).

В исследовании M. Grzesiak et al. [13] определяли уровень окислительного стресса в периферической крови беременных женщин колориметрическим методом, основанным на опосредованных железом реакциях очевидно стабильных продуктов процесса перекисного окисления липидов (гидропероксидов); в качестве антиоксиданта определяли уровень кати- он-радикала. Согласно представленным результатам, при ПР уровень окислительного стресса был значимо выше, чем у женщин с родами, реализованными после 37 недель.
H.E. Soydinc et al. [15], определяя уровень общего окислительного статуса и общей антиоксидантной способности в смывах влагалища, пришли к выводу, что именно так называемый индекс окислительного стресса является предиктором ПР.
R. Xu et al. [14], проводя исследование случай- контроль, определяли уровень 8-оксо-2'-дезоксигуа- нозина в венозной крови как маркера оксидативного стресса. Значимых различий между уровнем 8-оксо- 2'-дезоксигуанозина в крови у женщин с ПР по сравнению с нормальной беременностью выявлено не было
Вероятно, такие противоречивые данные обусловлены различиями в исследуемых материалах, методах определения маркеров оксидативного стресса, гестационного срока. Также уровень оксидативного стресса может отличаться в зависимости от расовых, географических принадлежностей и качества жизни.
Проведенное нами исследование установило повышенный уровень АФК (Н2О2) при ПР при снижении антиоксидантной активности, что согласуется с данными других исследователей и подтверждает роль оксидативного стресса в их развитии.
Заключение
Проведенное исследование доказывает, что ПР ассоциированы с синдромом системного воспалительного ответа, который, как известно, сопровождается развитием оксидативного стресса, приводящего к усилению процессов апоптоза, и нарушениями как на клеточном, так и субклеточном уровнях. Изучение показателей оксидативного стресса и антиоксидантов позволяет определять уровень провоспалительного ответа и прогнозировать развитие осложнений, а также оценивать эффективность терапии, направленной на пролонгирование беременности.



