Современные подходы к диагностике и лечению бесплодия основаны на достижениях фундаментальных наук в области изучения молекулярно-генетических процессов, лежащих в основе реализации процесса репродукции у человека [1]. Разработка и внедрение в клиническую практику вспомогательных репродуктивных технологий (ВРТ) стали важнейшим и принципиально новым этапом в лечении бесплодия [2]. Для повышения результативности программ ВРТ необходимо дальнейшее изучение молекулярных механизмов оплодотворения in vitro и развития беременности на раннем сроке гестации. В последнее время все большее внимание уделяется изучению роли универсальных иммунорегуляторных белков в механизмах оплодотворения и вынашивания. К ним относятся белки семейства макроглобулинов: α2-макроглобулин (МГ), ассоциированный с беременностью α2-гликопротеин, или «белок беременности» (АБГ), и ассоциированный с беременностью протеин А (PAPP-A). α2-МГ – основной представитель данного семейства, неспецифический ингибитор протеиназ, модулятор синтеза цитокинов, а также белок, осуществляющий и регулирующий транспорт цитокинов, гормонов и липидов к клеткам, участвующий в процессинге и презентации антигенов, влияющий на антителогенез, контролирующий деление и апоптоз клеток [3–5]. Содержание в крови резервных белков АБГ и РАРР-А, участвующих в механизмах оплодотворения и пролонгирования беременности, возрастает пропорционально сроку беременности [3, 5–7]. В последнее время к числу иммунорегуляторных белков, участвующих в механизмах оплодотворения, относят и лактоферрин (ЛФ), локально синтезируемый эпителиальными клетками и нейтрофилами. Помимо антибактериальных и антиоксидантных свойств, а также иммуномодулирующего воздействия на синтез цитокинов [8, 9], ЛФ постакросомального региона сперматозоидов дозозависимо ингибирует взаимодействие гамет [10], предположительно в целях предотвращения полиспермии. Являясь также острофазовым реактантом, ЛФ может быть использован в качестве «маркера готовности» к проведению ВРТ у пациенток с трубно-перитонеальным фактором бесплодия [11].
Однако исследований по изменению содержания данных белков в сыворотке крови у пациенток с индуцированными программами ЭКО беременностями в сравнении с физиологически наступившей беременностью не только на ранних сроках, но и перед родами до сих пор не проводилось, что и стало целью данного исследования.
Материалы и методы исследования
В исследование включены 20 участниц результативных программ ЭКО с трубно-перитонеальным фактором бесплодия воспалительного генеза в возрасте 30,6±0,5 лет. Обследование женщин проводилось в динамике: до начала программы ЭКО и на 15-й день после переноса эмбриона в полость матки. Индуцированные беременности в 73,6% закончились срочными и в 26,4% – преждевременными родами.
Кроме того, в исследование были включены 17 женщин в возрасте 31,7±1,1 года, с одноплодными беременностями после ЭКО, обследованных перед плановым родоразрешением, в сроках 36–40 недель. Роды закончились рождением здоровых детей с оценкой по шкале Апгар 8–9 баллов.
Группы сравнения были представлены 15 беременными в возрасте 20,3±0,6 года на ранних сроках гестации (3–5 недель), у которых беременность наступила в естественных циклах, а также 50 женщинами сопоставимого возраста (23,5±1,8 года) с доношенной беременностью, роды которых закончились рождением здоровых детей.
В контрольную группу вошли 30 здоровых небеременных женщин в возрасте 23,6±1,3 года.
Для определения содержания α2-МГ и АБГ в крови беременных использовался метод количественного ракетного иммуноэлектрофореза и моноспецифические антисыворотки против данных белков [12].
Уровень ЛФ и трофобластического β1-глобулина (ТБГ) определяли методом твердофазного иммуноферментного анализа при помощи тест-систем ЗАО «Вектор-Бест».
Для статистической обработки полученных данных применяли программу для биостатистики InStat 2.0 (Graph Pad, США). Статистически достоверными считали различия между группами р<0,05.
Результаты исследования
Сывороточные концентрации иммунорегуляторных АБГ и ЛФ, а также синтезируемого синцитиотрофобластом ТБГ в группе женщин с индуцированной беременностью (ЭКО) до вступления в программу, а также на ранних сроках гестации существенно отличались от показателей при физиологически наступившей беременности.
Перед вступлением в программу ЭКО сывороточное содержание α2-МГ было снижено (в среднем на 13%) по сравнению со здоровыми небеременными женщинами (таблица). Уровень АБГ достоверно не отличался от контрольных показателей. Концентрация ЛФ также была ниже, чем в контрольной группе.
На ранних сроках гестации (15-й день после переноса эмбриона) наблюдалось достоверное увеличение концентрации всех изученных показателей. При этом содержание АБГ и ЛФ в крови женщин с индуцированной беременностью превышало уровень данных белков при физиологической беременности в сопоставимых сроках, а концентрация ТБГ, напротив, была снижены в среднем в 5 раз. Уровень α2-МГ в крови на ранних этапах гестации был сопоставим и не зависел от способа наступления беременности.
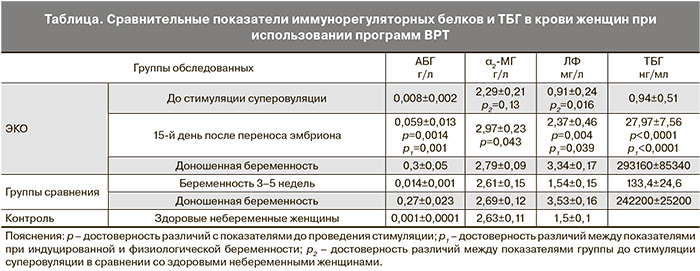
Совершенно иные сравнительные данные были получены при доношенной беременности. Сывороточный уровень АБГ, ЛФ и ТБГ значимо возрастал к концу беременности в сравнении с его показателями на ранних сроках гестации (3–5 недель) как при физиологически наступившей, так и при индуцированной беременности. Однако при доношенной беременности в сроке 38–40 недель нами не обнаружено никаких достоверных различий между группой женщин, участвовавших в программах ЭКО, и здоровыми беременными (таблица).
Таким образом, выявляемый при вступлении в программу ЭКО сниженный уровень α2-МГ, а также различия в концентрации ТБГ и АБГ на ранних сроках гестации при индуцированной беременности по сравнению с физиологически наступившей полностью компенсируются к родам. Повышение уровня иммунорегуляторных α2-МГ, АБГ, ЛФ при индуцированной беременности на поздних сроках соответствует его изменениям при физиологической беременности.
Обсуждение
Как показало проведенное исследование, при трубно-перитонеальном бесплодии воспалительного генеза достаточно часто наблюдаются остаточные явления хронического воспаления, не проявляющегося клинически, но обнаруживаемого на молекулярном уровне, о чем свидетельствует снижение сывороточных концентраций α2-МГ (не только иммуномодулятора, но и позднего негативного маркера воспаления [3]) до вступления в программу ЭКО. Кроме того, сниженный уровень ЛФ, являющегося не только ранним позитивным реактантом воспаления, но и основным фактором защиты слизистых от бактериальной и вирусной инвазии [9], позволяет предположить врожденный либо функциональный дефект его синтеза, являющийся одной из причин бесплодия трубного генеза вследствие тяжело перенесенной инфекции.
После стимуляции суперовуляции и переноса эмбриона значительно повышается уровень всех изученных показателей. При этом физиологическая беременность в сопоставимых сроках гестации характеризуется лишь недостоверной тенденцией к повышению содержания АБГ. Отчасти выявляемые различия в содержании α2-МГ и АБГ между этими группами можно объяснить влиянием стимуляции суперовуляции, поскольку синтез данных белков гормонозависим [5]. Кроме того, повышение уровня α2-МГ может объясняться купированием остаточных явлений воспаления на фоне метаболических изменений, происходящих при подготовке к ЭКО. Однако повышенное на ранних этапах индуцированной беременности содержание в крови женщин АБГ (основного белка беременности), сопровождаемое сниженной концентрацией ТБГ (показателя состоятельности фетоплацентарной системы), в сравнении с физиологической беременностью в сопоставимых сроках, может также свидетельствовать о том, что формирующаяся фетоплацентарная система плода в дебюте индуцированной беременности, особенно на фоне остаточных проявлений воспаления, в целом не состоятельна, и повышение уровня АБГ, способного стимулировать пролиферацию, является компенсаторной реакцией организма матери, позволяющей сохранить плод.
Повышение концентрации ЛФ в сыворотке крови женщин с индуцированной беременностью, определяемое на 15-й день после переноса эмбриона, в сравнении с его уровнем в сыворотке крови женщин с физиологически наступившей беременностью такого же гестационного срока, также может иметь несколько объяснений. С одной стороны, выполнение процедур ВРТ (забор ооцитов, перенос эмбрионов) способно вызвать локальную воспалительную реакцию, при отсутствии системной воспалительной реакции (на что указывает повышение сывороточного уровня α2-МГ). В этой связи гиперсинтез ЛФ, относимого рядом авторов к белкам беременности [13], вследствие активного участия в ее развитии может носить компенсаторный характер, направленный на сохранение плода.
Так или иначе, развитие беременности, как физиологически наступившей, так и индуцированной, приводит к закономерному увеличению содержания в крови активно участвующих в развитии плода АБГ, ЛФ и ТБГ. Уровень α2-МГ более консервативен и не демонстрирует значимых изменений в общей циркуляции. Однако самым важным, на наш взгляд, результатом был установленный факт нормализации сывороточного содержания изученных белков к доношенному сроку индуцированной беременности. Несмотря на ряд неблагоприятных изменений в уровне иммунорегуляторных белков сыворотки крови при бесплодии трубного генеза, и на значительные отличия их показателей при спонтанной и индуцированной беременности на ранних сроках гестации, дальнейшее неосложненное течение индуцированной беременности сопровождалось нормализацией показателей данных белков и ТБГ к моменту родоразрешения в соответствии с их уровнем при физиологически наступившей беременности.
Таким образом, решающими факторами, позволяющими выносить и родить здорового ребенка при индуцированной беременности, являются механизмы нормализации обменных и синтетических процессов, изменения в которых наблюдаются в начале программ ВРТ. В их числе – синтез иммунорегуляторных белков, участвующих как в развитии беременности, так и регулирующих воспалительные процессы, а также ТБГ.
Выводы
- Перед вступлением в программу ЭКО у женщин с бесплодием трубного генеза отмечается сниженный сывороточный уровень иммунорегуляторных белков α2-МГ и ЛФ.
- В раннем гестационном периоде индуцированной беременности (ЭКО) наблюдаются выраженные отличия в показателях иммунорегуляторных белков: АБГ, α2-МГ и ЛФ, а также ТБГ, по сравнению с физиологически наступившей беременностью. Эти различия могут быть обусловлены как наличием остаточных явлений воспаления у женщин с трубно-перитонеальной формой бесплодия, так и активацией компенсаторных процессов, направленных на сохранение плода.
- Перед родами сывороточный уровень изученных иммунорегуляторных белков и ТБГ у беременных с индуцированной беременностью (ЭКО) не отличается от показателей женщин с физиологически наступившей беременностью, что свидетельствует о развитии компенсаторных механизмов, позволяющих выносить и родить здоровых детей в группе женщин с положительным исходом программ ЭКО.



