Эндометриоз, занимающий третье место в структуре гинекологической патологии после воспалительных процессов и миомы матки, до сих пор остается нерешенной научной и клинической проблемой, заболеванием с невыясненным генезом [1].
Основной причиной обращения женщин за медицинской помощью являются жалобы на тазовые боли, частота которых при эндометриозе составляет от 26 до 70% [2]. Патогенетические механизмы, лежащие в основе тазовой боли при эндометриозе, недостаточно изучены. Считается установленным, что эндометриоидные гетеротопии имеют собственный сенсорный потенциал [3]. Поэтому предполагается, что в основе генерации тазовой боли при эндометриозе может лежать патологическая иннервация эктопических очагов эндометрия. Однако на сегодняшний день вопрос о связи особенностей иннервации эндометриоидных гетеротопий с клиническими проявлениями болевого синдрома остается нерешенным. Одним из актуальных направлений исследования генеза тазовой боли является поиск ассоциаций между интенсивностью местных воспалительных реакций при эндометриозе и интенсивностью болевого синдрома.
Наличие локальной воспалительной реакции у женщин с эндометриозом продемонстрировано многочисленными исследованиями. Высказывалось предположение, что эндометриоз характеризуется развитием локального воспаления с системной субклинической манифестацией [4, 5].
Для подтверждения признаков воспаления проводился анализ растворимых факторов перитонеальной жидкости, среди которых провоспалительные цитокины, хемоаттрактанты, факторы роста, металлопротеиназы. Особенности содержания растворимых факторов определяются динамическим разнообразием клеточного состава перитонеальной жидкости, включающего перитонеальные макрофаги, мезотелиальные клетки, эозинофилы, лимфоциты и тучные клетки, активирующиеся во время воспалительной реакции [6, 7].
Цитокиновый профиль перитонеальной жидкости исследовался на протяжении многих лет. Показано, что у женщин с эндометриозом и жалобами на сильные боли при менструациях в перитонеальной жидкости обнаружено значимое увеличение по сравнению с контролем содержания интерлейкина (ИЛ)-8, фактора некроза опухоли (ФНО)-α, гликоделина, ИЛ-6, ИЛ-4 и значимое снижение ИЛ-2 [8–11]. Отмечается увеличение содержания таких хемокинов, как RANTES и ИЛ-8 [12, 13]. Известно, что содержание ИЛ-8 в перитонеальной жидкости женщин с эндометриозом ранних стадий выше, чем у женщин без эндометриоза и у женщин с длительным течением эндометриоза [14–16]. Среди факторов роста показано увеличение содержания сосудисто-эндотелиального фактора роста, фактора роста фибробластов, фактора роста гепатоцитов, трансформирующих факторов роста [17, 18].
Считается, что цитокиновый профиль перитонеальной жидкости при эндометриозе меняется в сторону усиления митотической и ангиогенной активности. Так, ИЛ-1β активирует макрофаги, лимфоциты различных субпопуляций, запускает ангиогенез; ИЛ-8 является хемоаттрактантом для нейтрофилов из периферической крови, активирует ангиогенез и воспаление, влияет на процессы клеточного роста [6, 19]. На клеточных культурах эутопического эндометрия показано, что ИЛ-1β активировал продукцию ИЛ-8, и эта активация имела дозозависимый характер [20].
Показана ассоциация между концентрацией провоспалительных цитокинов в перитонеальной жидкости и количеством чувствительных нервных окончаний в эндометриодных гетеротопиях. Однако эта ассоциация зависит от локализации очагов: эндометриоз яичников мало ассоциирован с наличием или ростом нервных окончаний, тогда как эндометриоз ректо-вагинальной перегородки ассоциирован с увеличением чувствительных нервных окончаний в эндометриоидном очаге и возникновением периодической боли при менструациях [21]. Возможно, что увеличение содержания провоспалительных цитокинов может повышать чувствительность периферических нервных окончаний в очагах эндометриоза.
Показано существование связи между болью при эндометриозе и измененным содержанием в перитонеальной жидкости различных цитокинов, в том числе ИЛ-8, ИЛ-6, ИЛ-13 [22]. Считается, что увеличение уровня ИЛ-1β в сыворотке ассоциировано с гипералгезией у раковых больных [23]. Есть данные о том, что ИЛ-1β запускает реакции, связанные с феноменом продолжительного потенцирования в глицинергических синапсах [24]. Феномен продолжительного потенцирования связывают с процессами передачи болевой информации и с участием механизмов центральной чувствительности при формировании состояний хронической боли.
В последнее время интенсивно изучается роль вещества Р и его аналогов в изменении порога болевого воздействия. Субстанция Р – один из нейропептидов, медиаторов болевой нейротрансмиссии. По данным литературы, увеличение сывороточного уровня субстанции Р является фактором риска для пациентов с системными воспалительными заболеваниями, такими как хронический артрит и ревматоидный артрит [25].
Показано, что сывороточный уровень субстанции Р может выступать в роли объективного критерия степени выраженности болевого синдрома после хирургических манипуляций на прямой кишке [26].
Исследования участия этого нейропептида в генезе различных типов хронической боли считается актуальной задачей. В связи с вышесказанным интерес представляет поиск взаимосвязи между содержанием цитокинов и субстанции Р не только в крови, но и в перитонеальной жидкости пациенток с эндометриозом и хронической тазовой болью.
Целью настоящей работы явилась оценка содержания ИЛ-1β, ИЛ-8 и субстанции Р в плазме крови и перитонеальной жидкости женщин с наружным генитальным эндометриозом различной степени распространенности и с различной интенсивностью болевого синдрома.
Материал и методы исследования
В исследование были включены 86 женщин в возрасте от 21 до 44 лет, которые проходили стационарное лечение в отделении оперативной гинекологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Всем пациенткам была выполнена малоинвазивная операция – лапароскопия в сочетании с гистероскопией. По данным послеоперационных заключений женщины были подразделены на 2 группы:
- основная группа – 62 женщины с наружным генитальным эндометриозом;
- группа сравнения – 24 женщины без наружного генитального эндометриоза.
Всем женщинам основной группы диагноз наружный генитальный эндометриоз был поставлен интраоперационно и подтвержден гистологически. В 95,2 и 96,8% случаях эндометриоидные очаги были обнаружены на брюшине малого таза и крестцово-маточных связках соответственно. Эндометриоидные кисты яичников наблюдались у 52 женщин (83,9%), кисты диаметром 0,1–4,9 см обнаружены у 57 женщин (91,9%), кисты более 5 см в диаметре – у 6 женщин (9,7%). Эндометриоидные очаги также были выявлены на шейке матки у 4 женщин (6,5%), широких связках матки – у 48 (77,4%), ректовагинальной/ректоцервикальной перегородке – у 11 (17,7%), в дугласовом пространстве – у 45 (72,6%), в области пузырно-маточной складки – у 27 (43,5%), на маточных трубах – у 9 (14,5%), на кишечнике – у 8 (12,9%), на диафрагме – у 4 (6,5%), в области рубца на передней брюшной стенке – у 1 (1,6%). Всем пациенткам по показаниям была выполнена органосохраняющая операция, резекция яичников, коагуляция и/или иссечение очагов наружного генитального эндометриоза. Интраоперационно была оценена степень распространенности эндометриоза и в основной группе были выделены 2 подгруппы:
- подгруппа А – 29 женщин с III степенью распространенности эндометриоза;
- подгруппа Б – 33 женщины с IV степенью распространенности эндометриоза.
У всех пациенток основной группы отмечался синдром хронической тазовой боли. Для оценки выраженности болевого синдрома использовалась визуальная аналоговая шкала (ВАШ) – visual analog scale (VAS), основанная на субъективной оценке своих ощущений самим пациентом. По методу ВАШ на отрезке прямой длиной 10 см пациент отмечает интенсивность боли. Для удобства количественной обработки на отрезке наносят деления через каждый сантиметр, то есть от 0 до 10 баллов. Начало линии слева (0 баллов) соответствует отсутствию болевого ощущения, конец отрезка справа (10 баллов) – непереносимой боли. Пациент должен обозначать интенсивность боли, зная, что ноль соответствует отсутствию боли, а конечная цифра шкалы – максимально выраженной боли.
В связи с этим также было выделено 2 подгруппы:
- подгруппа В – 17 пациенток с умеренно выраженным болевым синдромом (2–5 баллов по ВАШ);
- подгруппа Г – 45 женщин с сильно выраженным болевым синдромом (6–10 баллов по ВАШ).
В связи с наличием у некоторых пациенток с IV степенью эндометриоза эктопических очагов с инфильтративным ростом также было выделено 2 подгруппы:
- подгруппа Д – 19 женщин с эндометриозом IV степени без инфильтративного роста;
- подгруппа Е – 14 женщин эндометриозом IV степени с инфильтративным ростом.
При изучении репродуктивного анамнеза пациенток основной группы первичное бесплодие наблюдалось у 23 женщин (37,1%), вторичное – у 11 (17,7%). Самостоятельная беременность наступала у 22 женщин (35,5%). Программы вспомогательных репродуктивных технологий проводились у 4 пациенток (6,4%).
По данным лапароскопического и гистероскопического исследований у женщин группы сравнения миома матки малых размеров наблюдалась в 79,2% случаев (19 женщин), пороки развития внутренних половых органов – внутриматочная перегородка и внутриматочные синехии были диагностированы у 2 женщин (8,3%). Синдром хронической тазовой боли не зафиксирован ни у одной из пациенток группы сравнения.
В репродуктивном анамнезе женщин группы сравнения первичное бесплодие было у 8 (33,3%), вторичное бесплодие – у 5 (20,8%), самостоятельная беременность наступала у 13 (54,2%).
Образцы плазмы периферической крови забирали до проведения оперативного вмешательства, образцы перитонеальной жидкости – при лапароскопическом исследовании.
Выборки для анализа субстанции Р формировались из общих выборок основной группы и группы сравнения случайным образом.
Содержание ИЛ-1β и ИЛ-8 определяли методом твердофазного иммуноферментного анализа с использованием наборов Вектор-Бест (РФ), субстанции Р – с использованием тест-системы компании Peninsula Laboratories, LLC (США). Учет результатов производили на планшетном спектрофотометре Expert plus «АSYS HITECH». Построение калибровочного графика и расчет концентраций цитокинов производили по уравнениям линейной регрессии в логарифмических координатах. Данные представлены как среднее±ошибка среднего. Статистическую обработку данных проводили общепринятыми методами вариационной статистики. Значимость наблюдаемых отклонений оценивали с помощью t-критерия Стьюдента. Значимость корреляционной связи оценивали с помощью F-критерия Фишера.
Результаты исследования и обсуждение
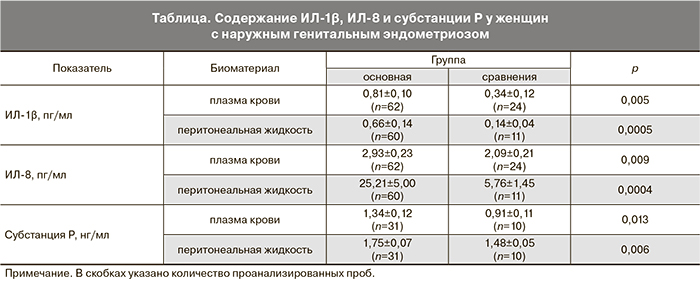
Результаты анализа исследованных показателей женщин основной группы и группы сравнения представлены в таблице.
Из представленных результатов видно, что как в плазме крови, так и в перитонеальной жидкости содержание исследованных цитокинов и субстанции Р выше в группе женщин с эндометриозом, что может являться отражением воспалительных реакций у таких пациенток.
Следует отметить, что уровни ИЛ-1β и субстанции Р в плазме сходны с уровнями в перитонеальной жидкости, а уровень ИЛ-8 существенно выше в перитонеальной жидкости, чем в плазме крови.
Корреляция в основной группе уровней ИЛ-1β и ИЛ-8 в перитонеальной жидкости (r=0,5948, p=0,0001, n=57) при отсутствии таковой в группе сравнения указывает на признаки локального воспаления и на возможную патогенетическую взаимосвязь этих цитокинов, продемонстрированную на клетках эутопического эндометрия in vitro [20]. В плазме крови отмечена слабая корреляция уровней ИЛ-1β и ИЛ-8 (r=0,2855, p=0,016, n=57), что связано с разнообразной интенсивностью локальных воспалительных реакций и с тем, что воспаление на системном уровне у пациенток основной группы, как правило, не находит яркого клинического отражения.
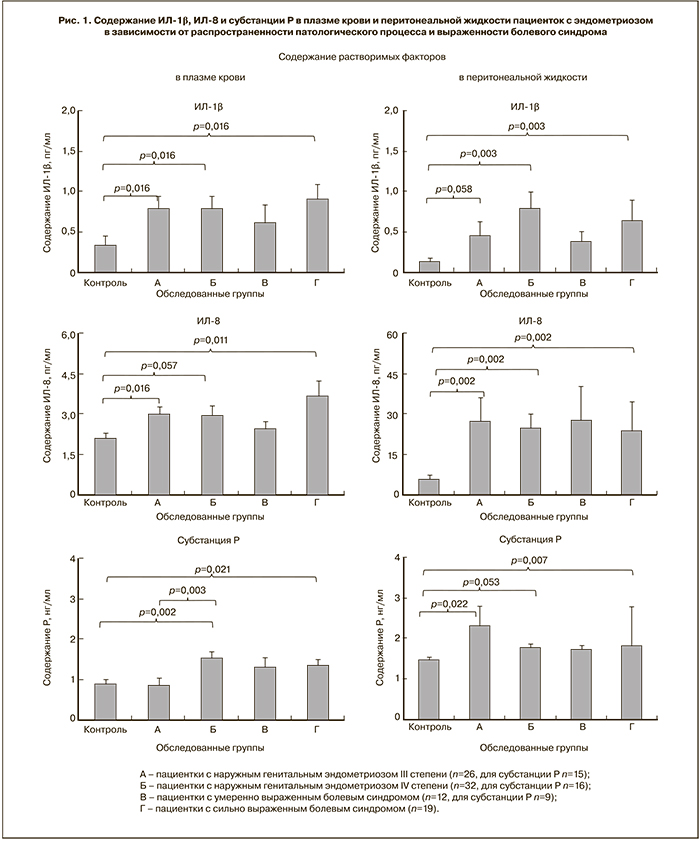
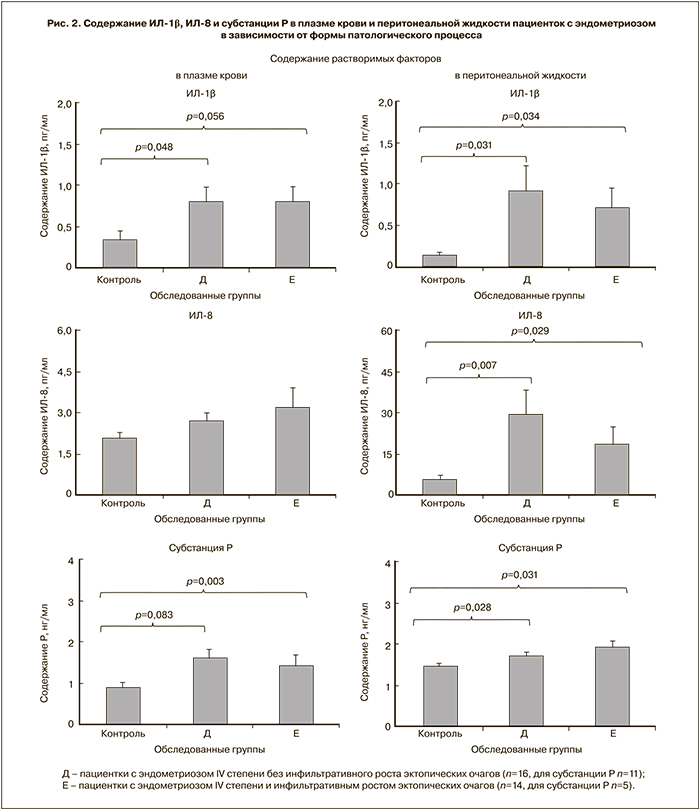
На рисунках представлены данные о содержании измеренных показателей в обоих типах биологических жидкостей в зависимости от степени распространенности и выраженности болевого синдрома (рис. 1), а также формы патологического процесса (рис. 2).
Содержание цитокинов в подгруппах с разной степенью распространенности эндометриоидных гетеротопий значимо отличается от значений в группе сравнения как в плазме, так и в перитонеальной жидкости, что повторяет общие закономерности (таблица), но разницы между исследуемыми группами не выявлено. Возможно, отсутствие разницы отражает значимость самого факта воспаления, независимо от его распространенности. Однако корреляционная связь между уровнями ИЛ-1β и ИЛ-8 в подгруппе пациенток с эндометриозом IV степени выявлена не только в перитонеальной жидкости (r=0,692, p=0,0001, n=30), но и в плазме крови (r=0,4061, p=0,011, n=32). Этот результат подтверждает предположение, что степень распространенности локальных воспалительных реакций связана с их проявлением на системном уровне.
В подгруппе женщин с сильно выраженным болевым синдромом содержание цитокинов в обоих типах биологических жидкостей значимо выше по сравнению с данными группы сравнения, но содержание цитокинов у пациенток в подгруппе с умеренно выраженным болевым синдромом не отличается ни от показателей группы сравнения, ни от подгруппы пациенток с сильно выраженной болью. При этом у пациенток с сильно выраженным болевым синдромом и в плазме крови, и в перитонеальной жидкости есть значимая корреляция между уровнями ИЛ-1β и ИЛ-8 (r=0,5054, p=0,014, n=19 и r=0,563, p=0,006, n=19 соответственно), что, возможно, отражает существование зависимости локальных воспалительных реакций и выраженности боли.
На рис. 2 представлены данные по содержанию исследуемых показателей в биологических жидкостях пациенток с эндометриозом IV степени, разделенных на подгруппы в зависимости от отсутствия или наличия инфильтративного характера роста эктопических очагов.
По отношению к группе сравнения содержание ИЛ-1β значимо выше в обеих подгруппах и в плазме крови, и в перитонеальной жидкости; содержание ИЛ‑8 – только в перитонеальной жидкости. Различий между подгруппами ни по одному из цитокинов не выявлено. Как и ожидалось, у пациенток с инфильтративным ростом эктопических очагов выявлены корреляционные связи между уровнями ИЛ-1β и ИЛ-8 и в плазме крови (r=-0,673, p=0,004, n=14), и в перитонеальной жидкости (r=-0,572, p=0,016, n=14).
Содержание субстанции Р в обоих типах биологических жидкостей значимо выше:
- в подгруппе с эндометриозом IV степени (рис. 1) как по отношению к результатам группы сравнения, так и подгруппе пациенток с эндометриозом III степени;
- в подгруппе пациенток с сильно выраженным болевым синдромом (рис. 1) по отношению к группе сравнения;
- в подгруппе с инфильтративным ростом гетеротопий (рис. 2).
Устойчивая прямая корреляция содержания субстанции Р обнаруживается с уровнем ИЛ-1β в плазме крови, но не в перитонеальной жидкости: у пациенток основной группы (r=0,357, p=0,024, n=31); в подгруппе пациенток с сильно выраженной болью (r=0,612, p=0,003, n=19), в подгруппе женщин с инфильтративным ростом эктопических очагов (r=0,691, p=0,098, n=5), у пациенток с сочетанием сильного болевого синдрома и инфильтративного роста эктопических очагов (r=0,962, p=0,019, n=4).
Как упоминалось выше, эндометриоз характеризуется развитием локального воспаления с системной субклинической манифестацией [4]. Полученные в данной работе результаты, на наш взгляд, подтверждают высказанное заключение. Во-первых, тем, что и в плазме крови, и в перитонеальной жидкости содержание исследованных цитокинов и субстанции Р выше в группе женщин с эндометриозом (таблица). Во-вторых, сходством уровней ИЛ-1β и субстанции Р в плазме крови и перитонеальной жидкости и более высоким уровнем ИЛ-8 в перитонеальной жидкости по сравнению с плазмой крови (таблица, рис. 1 и 2). В-третьих, корреляциями уровней ИЛ-1β и ИЛ-8 в перитонеальной жидкости (r=0,5948, p=0,0001, n=57) при отсутствии таковых в группе сравнения. В-четвертых, тем, что закономерности, выявленные для цитокинов в перитонеальной жидкости, совпадают с закономерностями, выявленными в плазме крови. Все факты укладываются в представление о наличии при эндометриозе хронической локальной воспалительной реакции и субклинических признаков системной реакции.
В данной работе не обнаружено зависимости содержания цитокинов в исследованных биологических жидкостях от распространенности эндометриоидных гетеротопий. Однако при выделении среди пациенток с эндометриозом IV степени подгрупп пациенток с инфильтративным и неинфильтративным ростом очагов оказалось, что в перитонеальной жидкости, но не в плазме крови, содержание цитокинов отличалось от таковых в группе сравнения, что также согласуется с утверждением о развитии локального воспаления с системной субклинической манифестацией. Выявленные довольно устойчивые корреляционные зависимости между ИЛ-1β и ИЛ-8 как в плазме крови, так и в перитонеальной жидкости согласуются с предположениями об их взаимовлиянии в воспалительных реакциях [20].
В работе показано, что содержание субстанции Р в обоих типах биологических жидкостей было повышенным у пациенток с эндометриозом и выраженным болевым синдромом. Но разницы в содержании субстанции Р между группами с различным типом распространенности эктопических очагов так же, как и по уровню цитокинов, не обнаружено. Однако выявление устойчивых корреляций содержания субстанции Р с уровнем ИЛ-1β в плазме крови, но не в перитонеальной жидкости, заставляет признать, что в генезе боли, а возможно, и в изменении содержания субстанции Р принимают участие не только локальные воспалительные реакции, но и центральные механизмы. Анализ содержания субстанции Р у пациенток с различными формами наружного генитального эндометриоза в зависимости от особенностей их психоэмоционального статуса является одним из направлений дальнейших исследований при изучении механизмов генеза тазовой боли при эндометриозе.
Выводы
- Содержание ИЛ‑1β, ИЛ-8 и субстанции Р выше в группе женщин с эндометриозом по сравнению с группой сравнения и в плазме крови, и в перитонеальной жидкости.
- В подгруппах с разной степенью распространенности эндометриоидных гетеротопий содержание цитокинов и субстанции Р значимо отличается от значений в группе сравнения при отсутствии разницы между подгруппами.
- В подгруппе с сильно выраженным болевым синдромом содержание цитокинов и субстанции Р в обоих типах биологических жидкостей было значимо выше по сравнению с группой сравнения.



