Гестационный сахарный диабет (ГСД) встречается почти у 13% беременных женщин [1], т.е. более чем каждая седьмая беременность осложняется развитием ГСД [2], что обусловливает медико-социальную значимость этой проблемы, в том числе в связи с последствиями для здоровья матери и ребенка. Средняя распространенность ГСД варьирует в зависимости от климато-географического региона проживания и колеблется от 12,9% на Ближнем Востоке, около 11% в Юго-Восточной Азии, Западной части Тихого океана, Южной и Центральной Америке до 5,8% в разных регионах Европы [3]. Согласно данным Государственного регистра сахарного диабета, распространенность ГСД в России составляет 8–9% [4]. Следует особо отметить, что помимо этнического происхождения, на существенные различия в распространенности ГСД в каждой стране влияют разные критерии скрининга и диагностики [3].
Существуют молекулярно-генетические детерминанты развития ГСД [5]. ГСД ассоциируется не только с повышенным риском осложнений беременности [6], но и с долгосрочными рисками заболеваний, как для матери, так и для ребенка. Риск развития сахарного диабета 2 типа (СД 2 типа) в 8 раз выше у детей, подвергшихся гипергликемии внутриутробно, что позволяет предположить, что наследование приобретенных характеристик, сегодня называемых эпигенетикой, обеспечивает тесную молекулярную связь в программировании будущего здоровья ребенка [7]. Таким образом, гипергликемия во время беременности способствует эпигенетическим изменениям плода и связана с повышенным риском хронических заболеваний во взрослой жизни.
Скрининговые и диагностические критерии для диагностики ГСД до настоящего времени являются предметом многочисленных дискуссий [8, 9]. «Золотым стандартом» считается проведение перорального глюкозо-толерантного теста (ПГТТ) в 24–28 недель беременности, что в ряде случаев приводит к запоздалой диагностике ГСД с соответствующими, порой неоптимистичным, последствиями. Развитие прикладных молекулярных технологий, направленных на поиски ранних предикторов заболеваний, в т.ч. ГСД, способствует не только профилактике осложнений для беременной и плода, но и снижению ближайших и отдаленных рисков для их здоровья.
Эффективность ранней диагностики ГСД может быть улучшена за счет использования дополнительных биомаркеров, таких, как внеклеточные везикулы (ВВ) [10]. Как известно, ВВ – это общий термин, признанный Международным обществом ВВ (ISEV), включающий в себя целое семейство наночастиц, разделяющихся на 4 основных класса: 1) эктосомы, 2) экзосомы, 3) апоптозные тельца и 4) ретровирус-подобные частицы/микровезикулы [11, 12]. С помощью ВВ локально на уровне клеточной ниши и системно на уровне организма осуществляется межклеточная коммуникация (перекрестный обмен сигнальной информацией) в виде крупных биомолекул, таких как РНК и белки-ферменты [13, 14]. Во время беременности слой синцитиотрофобласта плаценты секретирует малые ВВ в кровоток матери уже с 6 недель беременности [15]. Они выделяются большинством клеток и содержатся в различных жидкостях организма, включая кровь, мочу, грудное молоко, околоплодные воды, спинномозговую жидкость, сперму, асцитическую жидкость, желчь и слюну. Экзосомы несут широкий спектр биологически активных молекул, включая белки, липиды и нуклеиновые кислоты, которые могут доставляться в другие клетки для облегчения межклеточного взаимодействия [16, 17]. Исследования показали участие циркулирующих экзосом при нормальной и осложненной беременности (включая ГСД) [18]. Что касается функции ВВ, то Liu et al. показали, что ВВ, полученные из плазмы беременных с ГСД, значительно увеличивают высвобождение воспалительных цитокинов из эндотелиальных клеток [19], что может быть связано с воспалительным процессом при ГСД. Кроме того, эндотелиальные клетки вены пуповины (ЭКВП) также высвобождали ВВ in vitro; связанное исследование показало, что ВВ, высвобожденные из ЭКВП при нормальной беременности, могли обратить вспять фенотип ГСД, в то время как ВВ из ЭКВП при беременности, осложненной ГСД, несли факторы, которые индуцировали дисфункцию эндотелиальных клеток при нормальной беременности [20]. Хотя механизмы, лежащие в основе метаболической адаптации матери к здоровой беременности и при ГСД, остаются плохо изученными, ВВ могут представлять собой новый механизм регуляции гомеостаза глюкозы у матери во время беременности. Так, установлено, что ВВ, выделенные от здоровых беременных женщин, способствуют островковой стимулированной глюкозой секреции инсулина и периферической резистентности к инсулину у небеременных мышей; в то время как ВВ от женщин с ГСД не стимулируют секрецию инсулина и вызывают повышение инсулинорезистентности [21]. Плацента производит сотни микроРНК, которые высвобождаются в материнскую циркуляцию, инкапсулированные во ВВ [22]. Некоторые из этих микроРНК уникальны для плаценты и корегулируются в кластерах (например, кластерная хромосома 14 и кластерная хромосома 19) в зависимости от срока беременности [23].
ВВ – это стабильные контейнеры, содержащие различные биомолекулы, которые защищены от деградации ферментами крови внутри своей структуры. Кроме того, цитоплазматическая мембрана клеточного происхождения защищает содержимое везикул от деградации внеклеточными ферментами [24]. Принимая во внимание относительную стабильность содержимого груза ВВ, они могут являться предпочтительным источником биомаркеров. Мы предполагаем, что эффективность раннего выявления ГСД может быть улучшена с использованием дополнительных биомаркеров, таких как ВВ.
Цель исследования: изучение особенностей состава и количества ВВ в плазме крови в I триместре беременности и оценка их способности к ранней предикции ГСД.
Материалы и методы
На базе акушерских отделений ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» МЗ РФ проведено проспективное исследование, в которое вошли 45 беременных с неотягощенным акушерским анамнезом и низким риском осложнений беременности по результатам расширенного комбинированного скрининга I триместра. В 24–28 недель беременности им был проведен ПГТТ с 75 г глюкозы. Диагноз ГСД устанавливался на основании критериев IADPSG [25]. По результатам теста беременные были разделены на 2 группы: 20 пациенток с ГСД (основная группа) и 25 пациенток с нормогликемией (группа сравнения), что явилось критериями включения в исследование. У всех обследованных детально анализировались клинико-анамнестические и лабораторные данные: соматический и акушерско-гинекологический анамнез, течение беременности, ультразвуковая фетометрия.
У всех пациенток было получено информированное согласие на участие в исследовании.
Критериями невключения пациентов были: многоплодная беременность, хромосомные аномалии, СД 1 и 2 типов, аутоиммунные, онкологические заболевания, врожденные пороки развития плода.
Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» МЗ РФ (протокол от 11.11.2019).
Выделение ВВ
Венозная кровь пациентов объемом 10 мл была собрана в вакутейнеры, содержащие ЭДТА (BD Vacutainer) в сроке 11–14 недель беременности. Затем полученную кровь центрифугировали при 2000 g в течение 10 мин при +4°С. Полученная плазма была разделена на аликвоты по 3 мл и помещена в криопробирки для хранения при -80°С. Затем размороженную плазму объемом 2,8 мл доводили PBS (фосфатно-солевым буфером) до 40 мл и центрифугировали при 2000 g в течение 30 мин при +4°С. Полученный супернатант затем переливали в центрифужные стаканы и центрифугировали при 12000 g в течение 45 мин при +4°С, и образовавшийся супернатант вновь центрифугировали при 108 000 g в течение 120 мин при +4°С. Осадок растворяли в коммерческом PBS (Gibco) (100 мкл) и хранили при -80°С. Сбор биологического материала и хранение проводилось при участии Биобанка ФГБУ «НМИЦ АГП им. В.И. Кулакова».
Анализ траекторий наночастиц
Распределение частиц по размерам и количественные концентрации изолированных везикул измеряли с помощью метода «Анализа траекторий наночастиц» (NTA) с использованием прибора Nanosight LM10 HS (NanoSightLtd., Эймсбери, Великобритания), как описано ранее (https://www.mdpi.com/2073-4409/8/3/258). Все измерения проводились в соответствии с рекомендациями стандарта ASTM E2834-12. Вкратце, образцы разбавляли PBS до конечной концентрации около 1,5×108 частиц/мл. Каждое видео броуновского движения частиц было записано в течение 1 минуты при комнатной температуре с пассивным считыванием температуры и следующими настройками камеры (калибровка: 166 нм/пиксель; размытие: автоматическое; порог обнаружения: 8, минимальная длина дорожки: автоматическая, минимальный ожидаемый размер частиц: 30 нм, температура: 24,7°C, вязкость: 0,90 Па*с), оптимизированными для ВВ (12–18 видео на один образец). Видео обрабатывались с помощью аналитического программного обеспечения Nanoparticle Tracking Analysis версии 2.3 build 0033 (NanoSight Ltd., Эймсбери, Великобритания).
Статистический анализ
Статистический анализ проводился с использованием программы StatTech v. 2.4.7 (ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, описаны в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3).Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода, применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Статистически значимыми для всех видов анализа считались различия при p<0,05.
Результаты
Клинико-анамнестическая характеристика обследованных
Как указывалось выше, пациентки были разделены на 2 группы (с ГСД и с нормальной толерантностью к глюкозе). Статистически значимых различий по возрасту, сроку беременности на момент включения в исследование, массо-ростовым показателям и индексу массы тела выявлено не было. Все женщины были некурящими, имели одноплодную беременность и не имели инфекционно-воспалительных и других акушерских осложнений, кроме ГСД (I группа). Клиническая характеристика пациенток представлена в таблице 1.
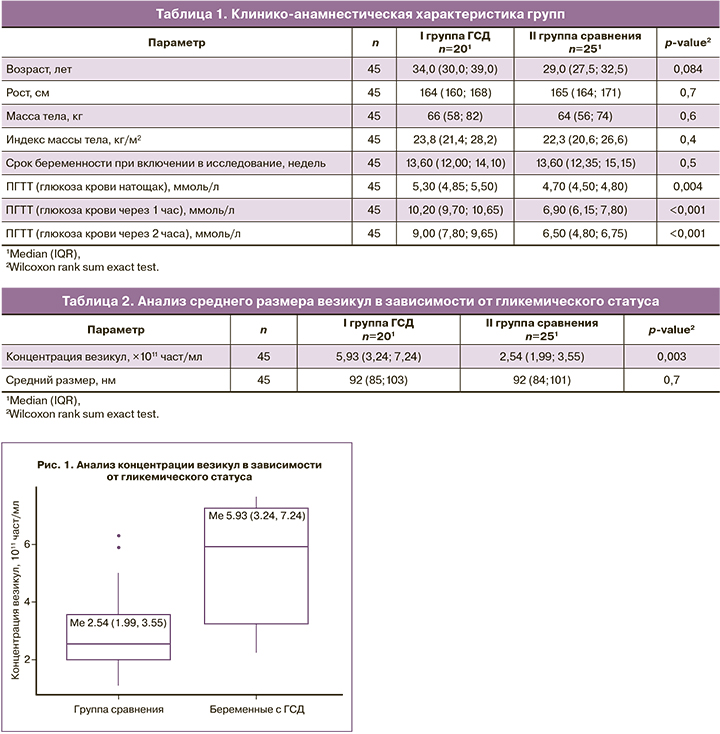
Характеристика и количественная оценка ВВ
Чтобы оценить, были ли различия ВВ, полученных из материнской плазмы в первом триместре беременности, между исследуемыми группами (ГСД и группа сравнения), было проанализировано распределение ВВ по размерам, полученным с помощью центрифугирования. Анализ NTA показал отсутствие значительных различий средних размеров везикул между группами (92 (84, 101) нм для контроля и 92 (85, 103) для пациенток с ГСД (табл. 2). Однако, концентрация ВВ была значительно выше у пациенток, у которых впоследствии развился ГСД, по сравнению с «нормогликемическими» беременными (табл. 2, рис. 1, 2).
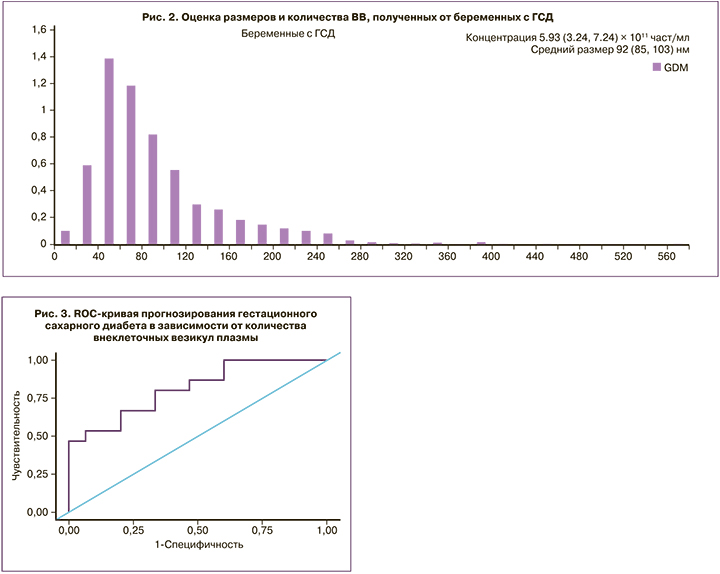
Чтобы оценить диагностическую точность использования концентрации ВВ в качестве биомаркера для раннего прогнозирования ГСД, был проведен ROC-анализ. При оценке зависимости вероятности развития ГСД от концентрации ВВ плазмы с помощью ROC-анализа была получена кривая (рис. 3). Площадь под ROC-кривой составила 0,813±0,080 с 95% ДИ: 0,657–0,970. Полученная модель была статистически значимой (p=0,003). Пороговое значение концентрации везикул в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 3,224×1011 част/мл. Развитие ГСД прогнозировалось при значении концентрации везикул выше данной величины или равном ей. Чувствительность и специфичность модели составили 80,0 и 66,7%, соответственно.
Обсуждение
Цель нашего исследования состояла в выяснении способности ВВ в предикции ГСД. Полученные данные свидетельствуют о том, что в 11–14 недель женщины, у которых в последствие в течение беременности развивается ГСД, имеют значительно более высокие концентрации ВВ, чем женщины группы сравнения (с нормогликемией).
Необходимо отметить, что мы, также как и большинство исследователей в рамках своей работы руководствовались пожеланиями и рекомендациями, разработанными ISEV [26]. В литературе часто существует путаница в названиях наночастиц, однако согласно рекомендациям ISEV, экзосомы и ВВ отождествлять не корректно [12]. В свою очередь, стоит отметить, что экзосомы, являясь самыми маленькими наночастицами среди категорий ВВ (30–100 нм), генерируемыми по классическому пути эндосома-мультивезикулярное тело (MВТ) также формируются как довольно разнородная популяция. H. Zhang, et al. описали отдельную популяцию немембранозных экзосом, названную экзомерами (≈35 нм) [27]. Более того коллективом других авторов в дальнейшем показано, что субпопуляция экзосом, названная экзомерами отличается от «классических» экзосом по протеомному составу и включает белки ответа на гипоксию, микротрубочки, участники коагуляционных процессов и ряд других, что функционально также отличает их от «классических» экзосом [28]. ВВ больших размеров, чем экзосомы, в основном получены из плазматической мембраны и достигают размеров в диапазоне от сотен нм до нескольких мкм. Среди них наиболее изученными являются апоптотические тельца [29] и эктосомы/микровезикулы [30].
Существует распространенное мнение, что большинство доступных наборов для экстракции изолируют именно экзосомы, что позволяет быстрее сосредоточиться на наименьшей популяции ВВ по сравнению с другими популяциями. Однако процесс биогенеза и высвобождения больших ВВ (микровезикулы и апоптотические тела), полученных из плазматической мембраны связан как с механическими, так и с биохимическими процессами. В связи с этим, биогенез больших ВВ, микровезикул в частности, очень чувствителен к условиям микросреды; именно этим фактором, по крайней мере частично, объясняется огромная изменчивость данных, полученных как о биогенезе, так и о функционировании больших ВВ. Исключением здесь являются апоптотические тельца, генез которых связан исключительно с состоянием «запрограммированной клеточной смерти» [31].
Таким образом, опираясь на выше упомянутые данные, мы в данной работе использовали термин ВВ, обобщая и постулируя тем самым тот факт, что с помощью признанного метода дифференциального центрифугирования без градиента мы получаем смешанную популяцию ВВ, состоящую преимущественно из экзосом с примесью микровезикул, о чем свидетельствуют данные гистограмм распределения наночастиц по размерам методом анализа траектории наночастиц (NTA) (рис. 2).
Метод дифференциального центрифугирования выбран нами не случайно, а в связи с его высокой продуктивностью, относительной простотой исполнения и эффективной интеграцией в клинику [32]. В литературе действительно имеются данные, что высокоскоростное центрифугирование более 4 ч значительно снижает чистоту ВВ и приводит к их механическому повреждению [33], однако мы используем меньшие времена центрифугирования и проводим все операции согласно протоколу, разработанному для получения ВВ из плазмы крови, адаптированному под наши технические возможности [34] и, судя, по визуальным данным NTA, а также электронным микрофотографиям, получаем достаточно однородную популяцию ВВ. Касаемо стабильности ВВ и условий хранения биологических жидкостей мы руководствовались данными литературы, одобренными ISEV. В частности, недавно было показано, что для долгого хранения полученных ВВ наиболее оптимальными условиями является температурный режим -80°С [35] с избеганием циклов заморозки/разморозки.
Наши данные согласуются с результатами анализа траекторий наночастиц, полученных аналогичным путем ультрацентрифугирования [36]. Кроме того, в исследовании С. Salomon et al. показано, что беременные, у которых развивается ГСД, демонстрируют повышенную концентрацию как общих, так и плацентарных ВВ, по сравнению с «нормогликемическими» беременными [34]. Это увеличение циркулирующих ВВ, связанное с ГСД, продолжается на протяжении всей беременности, при этом количество циркулирующих ВВ в течение беременности увеличивается примерно в 2 раза по сравнению со здоровыми беременными [37].
Важно отметить, что ВВ могут быть выделены из различных биологических жидкостей (плазмы, мочи и слюны) с использованием различных методик, в том числе ультрацентифугирования; они являются очень стабильными компонентами секретома клеток и способны защитить свое биологическое содержимое от деградации. Характеристика распределения ВВ, а также их общее количество между 10 и 14 неделями беременности могут быть использованы для выявления бессимптомных женщин, у которых в последующие сроки диагностируется ГСД, раннего лечения и профилактики не только специфических анте- и перинатальных осложнений, но и трансформации ГСД в другие формы диабета после родов для беременной, а для плода – облегчение бремени перинатального программирования, связанного с внутриутробной гипергликемией.
Вместе с тем, несмотря на полученные оптимистичные и многообщающие результаты, требуются дальнейшие исследования. В первую очередь, потому что прогнозирование ГСД в ранние сроки беременности на основании количества ВВ не имеет высокой специфичности, поскольку ВВ – важный компонент секретома различных клеток, обеспечивающий комплексную передачу биологически активных молекул и горизонтальный перенос генетической информации. В связи с этим весьма перспективным представляется исследование содержимого ВВ, в частности, анализ профиля микроРНК. Имеются данные о том, что ВВ с повышенным содержанием определенных микроРНК могут быть использованы в качестве биомаркеров для диагностики различных заболеваний [38]. Кроме того, анализ профиля микроРНК, специфичных для ГСД, который выполняется нами в настоящее время, позволит не только прогнозировать развитие заболевания, но при динамическом исследовании служить своеобразным инструментом мониторинга в процессе ведения беременности и контроле эффективности проводимой терапии.
Заключение
ГСД становится глобальной проблемой здравоохранения, и его ранняя диагностика остается сложной задачей, поскольку ни один из существующих биомаркеров не обладает высокой специфичностью. Необходимы будущие, более обширные исследования для оценки прогностической значимости ВВ. Мы выделили ВВ из плазмы, используя метод, который подходит для применения в клинических условиях. Наши результаты дают представление о потенциальной способности ВВ в I триместре беременности, как ранних биомаркеров для прогнозирования ГСД. Дальнейшее изучение профиля специфических микроРНК позволит окончательно определить роль ВВ в ранней предикции ГСД.



