Распространенность мастопатии, доброкачественной дисгормональной дисплазии молочных желез (N 60 по МКБ-10) характеризуется широким спектром пролиферативных и регрессивных изменений тканей молочной железы. В возрасте до 40 лет диагностируется у 40% женщин, а после 40 лет – в 60–80% наблюдений. Данная патология является важной медико-социальной проблемой в силу двух обстоятельств. Во-первых, многие формы заболевания имеют выраженную клиническую симптоматику, что значительно снижает качество жизни женщины. Во-вторых, дисгормональная дисплазия молочных желез относится к предопухолевым заболеваниям. Несмотря на то что мастопатия не является облигатным предраком, частота возникновения онкопатологии у этой категории больных возрастает в 3–5 раз по сравнению с общепопуляционным, а при пролиферативных формах риск возрастает в 25–30 раз [1–4].
Этиология и патогенез дисгормональных заболеваний молочных желез до настоящего времени являются предметом дискуссий. Накопленные к настоящему времени данные свидетельствуют, что определяющей причиной развития мастопатии является нейро-гуморальный фактор, обозначающий, что пусковым механизмом болезни может быть стресс, депрессия, невроз. В свою очередь «гуморальный фактор» указывает на внутреннюю среду организма, состояние которой определяется работой биологически активных веществ, в том числе гормонов [5–7].
Известно, что дисгормональные дисплазии часто сочетаются с поражением того или иного отдела вегетативной нервной системы (ВНС). Расстройство вегетативного обеспечения деятельности нарушает поведение и адаптацию человека [8, 9]. С другой стороны, доказано наличие прямого и опосредованного влияния ВНС на гормональный статус и состояние иммунной системы.
На сегодняшний день работ по изучению состояния и диагностике патологии ВНС при заболевании молочных желез недостаточно, они фрагментарны и не затрагивают проблемы возможного прогнозирования течения фиброзно-кистозной болезни молочных желез при различных изменениях функционирования ВНС.
Цель исследования: изучить участие ВНС в патогенезе диффузной дисгормональной дисплазии молочных желез и оценить возможности коррекции вегетативной дисфункции при доброкачественной патологии молочных желез препаратом мастодинон.
Материал и методы исследования
В рамках целевой межведомственной научно-практической программы «Здоровье женщины», совместного проекта СибГМУ, НИИ фармакологии РАМН, НИИ психического здоровья РАМН (руководитель – профессор Л.С. Сотникова) обследованы 350 женщин репродуктивного возраста. Средний возраст пациенток в исследовании был 32,2±0,3 года. Основную группу составили 205 пациенток с диагнозом диффузная дисгормональная дисплазия молочных желез (ДДДМЖ) по клинико-рентгенологической классификации Н.И. Рожковой (1993). Наличие дисгормональной патологии молочных желез подтверждено данными ультразвукового исследования с использованием линейного датчика 14 МГц с применением цветового и энергетического допплеровского картирования в первую фазу менструального цикла (5–10-й день). Пациенткам старше 35 лет дополнительно выполнена рентгенологическая маммография. Полученные эхографические показатели позволили разделить пациенток с ДДДМЖ на четыре клинических группы: I группа (n=63): с преобладанием железистого компонента (ЖК); II группа (n=52): с преобладанием кистозного компонента (КК); III группа (n=48): с преобладанием фиброзного компонента (ФК); IV группа (n=42): смешанной формы. Контрольную группу составили 45 практически здоровых женщин, сопоставимых с основной группой по возрасту, без соматической и гинекологической патологии.
Скрининг-диагностика и количественная оценка наличия синдрома вегетативной дистонии выполнялись анкетным методом, разработанным Всесоюзным центром вегетативной патологии («Схема исследования для выявления признаков вегетативных нарушений», А.М. Вейн, 2003). Для оценки вегетативного тонуса использовали расчет вегетативного индекса (ВИ) Кердо (1957) по формуле: ВИ=(1-Д:ЧСС)х100, где Д – величина диастолического давления, ЧСС – частота сердечных сокращений в 1 мин. При полном вегетативном равновесии (эйтония) в сердечно-сосудистой системе ВИ=0. Если коэффициент положительный, то преобладают симпатические влияния (симпатикотония); если цифровое значение коэффициента получают со знаком минус, то повышен парасимпатический тонус (парасимпатикотония).
Состояние ВНС оценивали путем исследования вариабельности сердечного ритма методом кардиоинтервалографии (кардиоанализатор «Анкар-131», Россия, 1989). Применяли стандартную методику проведения 5 кардиоваскулярных проб по Ewing. При анализе кардиоинтервалографии оценивали следующие показатели: частота сердечных сокращений (ЧСС); мода (Мо) – отражает состояние гуморального канала регуляции ритма сердца; амплитуда моды (АМо) – характеризует степень влияния симпатического отдела вегетативной нервной системы на сердечный ритм (мс); вариационный размах (ВР) – характеризует степень влияния парасимпатического отдела вегетативной нервной системы на сердечный ритм (мс); индекс напряжения (ИН) – интегральный показатель уровня функционирования центрального контура регуляции сердечным ритмом, указывает степень централизации управления ритмом сердца с учетом как соотношения активности симпатического и парасимпатического отделов ВНС, так и состояния гуморального канала регуляции.
Автоматический анализ и интерпретация результатов обследования проводились на вегетотестере «ВНС – Ритм» компании «Нейрософт» с использованием программы «Поли-Спектр-Ритм» (2009). Оценивали общую мощность спектра (TP) и спектральную мощность в сверхнизкочастотном (VLF) диапазоне, отражающем гуморально-метаболические или центрально-эрготропные влияния на сердечный ритм, в низкочастотном (LF) диапазоне, отражающем симпатические влияния на сердечный ритм и высокочастотном (HF) диапазоне, отражающем модулирующее влияние парасимпатического отдела вегетативной нервной системы на пейсмекерную активность синусового узла в абсолютном (мс2) и процентном (VLF%, LF%, HF%) выражениях. Дополнительно рассчитывали баланс симпатических и парасимпатических влияний (LF/HF, у.е.) и коэффициент, характеризующий реактивность парасимпатического отдела ВНС (К30/15, у.е.). Каждый из перечисленных параметров оценивался до и после проведения ортостатической пробы.
Всем пациенткам основной и контрольной групп в раннюю фолликулиновую фазу определяли базальный уровень циркулирующих гормонов: пролактин (ПЛ), адренокортикотропный гормон (АКТГ), кортизол, тиреотропный гормон (ТТГ) иммуноферментным методом на автоматическом анализаторе Elecsys с использованием стандартных наборов фирмы Hoffman La Rosh (Франция).
Результаты исследования обрабатывали с использованием стандартного пакета программ Statistica 6.0 (StatSoft Inc., США) и пакета программ Excel 2007 (Microsoft, США).
Результаты исследования и обсуждение
Синдром вегетативной дистонии не является самостоятельной нозологической единицей и включает множественные клинические проявления и сосудисто-трофические синдромы. В подавляющем большинстве случаев данный синдром вторичен вследствие психофизиологических сдвигов, гормональных расстройств, психических заболеваний или неврозов.
При использовании скрининг-диагностики и количественной (бальной) оценки наличия синдрома вегетативной дистонии (А.М. Вейн, 2003) расстройства функционирования автономной нервной системы были зарегистрированы у всех пациенток с мастопатией. В контрольной группе индекс Кердо (0,1±0,03 усл. ед) и индекс Вейна (11,2±2,25) соответствовали практически полному равновесию в вегетативном тонусе. У пациенток с ДДДМЖ индекс Вейна был в диапазоне от 27 до 32, а индекс Кердо составил в среднем 14,60±1,20 усл. ед., при этом максимально высоким он оказался в группе пациенток с диффузной дисплазией с преобладанием фиброзного компонента.
При оценке результатов кардиоинтервалографии было выявлено снижение парасимпатической регуляции и повышение тонуса симпатического отдела, что отразилось в статистически значимом увеличении амплитуды моды и индекса напряжения у пациенток всех обследуемых групп с ДДДМЖ в сравнении с группой контроля. Причем минимальные значения данных показателей зафиксированы в группе ДДДМЖ с преобладанием железистого компонента, а максимальные – в группе с преобладанием фиброзного компонента (табл. 1).
Таким образом, полученные данные позволяют говорить о дисбалансе отделов ВНС в сторону выраженной симпатикотонии, централизации процессов регуляции, снижении адаптационных механизмов у пациенток с диффузной дисплазией молочных желез. Это наглядно показано при проведении активной ортостатической пробы. Амплитуда моды статистически значимо растет в группах с ДДДМЖ с преобладанием железистого, кистозного и фиброзного компонентов, индекс напряжения достоверно повышается у пациенток всех групп (табл. 1).
Выраженные сдвиги при проведении активной ортостатической пробы служат критериями снижения адаптации организма обследуемых женщин к модулируемой нагрузке. Динамика показателей указывает на стабилизацию регуляции сердечного ритма с переходом с рефлекторного вегетативного уровня на гуморально-метаболический [10].
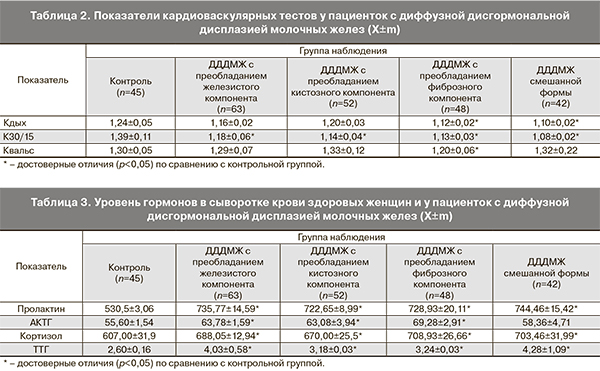
По данным кардиоваскулярных тестов также были выявлены изменения, характеризующие снижение реактивности парасимпатического отдела ВНС – уменьшение регуляторных возможностей системы «быстрого» реагирования (табл. 2).
В основе механизмов формирования различий в состоянии и изменении адаптационных резервов при диффузной дисгормональной дисплазии молочных желез лежат особенности вегетативного обеспечения функций, характеризующиеся перераспределением симпатических и парасимпатических влияний. Минимальные изменения зафиксированы в группе ДДДМЖ с преобладанием железистого компонента, наиболее выраженные – в группе с преобладанием фиброзного компонента.
Патогенетическая роль гиперпролактинемии в развитии мастопатии в настоящий момент не вызывает сомнения. С одной стороны, увеличение концентрации пролактина в сыворотке крови может быть маркером гипоталамо-гипофизарных нарушений в системе регуляции репродуктивной функции. С другой стороны, избыток пролактина оказывает прямое стимулирующее влияние на пролиферативные процессы в периферических органах-мишенях половой системы, реализуемое путем увеличения содержания рецепторов к эстрадиолу в тканях молочной железы и повышения чувствительности клеток к действию последнего. Кроме того, пролактин сенсибилизирует ткани железы к эндо- и экзогенным эстрогенам, к действию гормонов надпочечников и щитовидной железы, что приводит к пролиферации эпителия молочных желез [6].
При оценке гормонального статуса у пациенток всех групп с ДДДМЖ выявлены однонаправленные изменения основных патогенетически значимых гормонов, имеющих физиологическую связь с функционированием ВНС (табл. 3).
В рамках целевой межведомственной научно-практической программы «Здоровье женщины» (СибГМУ, НИИ фармакологии РАМН, НИИ психического здоровья РАМН) проведено клиническое исследование эффективности коррекции вегетативной дисфункции при применении лекарственного препарата мастодинон (Бионорика CE, Германия). Основным доказанным механизмом действия этого препарат является нормализация концентрации пролактина. Клиническое исследование (IV фаза) было проспективным (метод «случай-контроль») и моноцентровым.
Мастодинон – лекарственный препарат растительного происхождения, традиционно в течение 40 лет с успехом применяющийся в терапии фиброзно-кистозной болезни молочных желез. Механизмы лечебного действия мастодинона у больных с мастопатией связаны с содержанием в этом средстве биологически активных веществ, в том числе детерпенов, влияющих на обмен дофамина в ЦНС и регуляцию уровня пролактина.
В программу исследования вошли 140 пациенток репродуктивного возраста от 24 до 43 лет с наличием ДДДМЖ, которые были распределены в четыре равноценных группы с железистой, кистозной, фиброзной и смешанной формами заболевания, по 35 человек каждая. Основным препаратом для лечения был мастодинон (капли для приема внутрь) в суточной дозе 60 капель курсом 12 нед и дальнейшим сроком наблюдения до 12 нед (3 мес). В течение исследования пациентки посещали врача трижды согласно плану – до начала исследования (визит 0), в начале лечения (визит 1) и через 3 месяца после начала лечения (визит 2). После окончания периода наблюдения оценивали характер жалоб пациенток, эхографические показатели молочных желез и состояние ВНС. Контрольную группу составили 45 практически здоровых женщин. Все женщины давали добровольное информированное согласие на участие в исследовании. При проведении исследования побочные эффекты не зарегистрированы. Отклонений (в процессе 12-недельного исследования и 12-недельного периода наблюдения) в состоянии соматического статуса не определено. Косвенным подтверждением этого является отсутствие изменений в результатах оцениваемых биохимических тестов, общих анализах мочи и периферической крови.
Терапия ДДДМЖ является достаточно длительным процессом и, как правило, занимает от 3 до 6 месяцев, после чего производится оценка эффективности лечения с помощью УЗИ и оценки гормонального статуса. В данной работе нас интересовала реакция ВНС на действие препарата мастодинон, поэтому для анализа эффективности терапии была выбрана методика оценки вариабельности сердечного ритма. Данный метод наиболее информативен в оценке показателей работы автономной нервной системы [11]. В ходе опроса на запланированных визитах субъективное улучшение самочувствия за счет снижения жалоб на эмоциональную лабильность, масталгию было отмечено у всех пациенток, получавших в качестве терапии мастодинон.
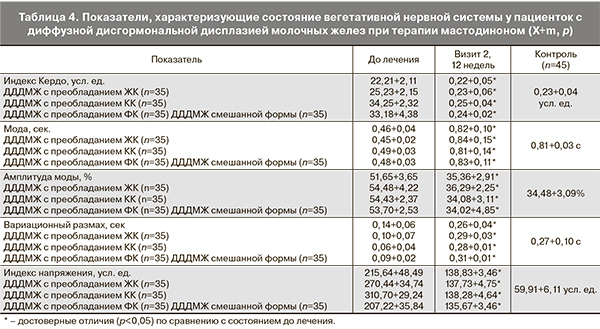
При комплексной оценке основных показателей функционирования ВНС при терапии мастодиноном выявлена тенденция к нормализации соотношения всех показателей, входящих в структуру спектра ритма сердца, что отражает улучшение состояния ВНС (табл. 4).
При оценке эффективности проводимой терапии у пациенток с ДДДМЖ выявлено, что общая мощность спектра повысилась в 1,5 раза по сравнению с уровнем до лечения. Это было обусловлено изменением в сторону увеличения индикатора работы как симпатического отдела ВНС (LF), так и статистически значимым изменением парасимпатического тонуса (НF), при этом симпато-парасиматическое отношение (LF/HF) понизилось в 1,2 раза, что свидетельствует о выравнивании вклада отделов ВНС в модуляцию ритма сердца. Структура спектра перераспределилась следующим образом: VLF (как составляющая показателя LF) компонент, отражающий гуморально-метаболические влияния и преобладающий у пациенток с ДДДМЖ, при терапии мастодиноном составил 24,82%, LF компонент – 37,63%, а HF компонент спектра – 30,27% (при 44,56, 30,29 и 25,15% до начала терапии соответственно). Обобщая результаты, полученные при анализе данного теста, можно сделать заключение, что у пациенток после терапии мастодиноном наблюдается функциональное состояние равновесия симпатического и парасимпатического отделов ВНС.
Заключение
Представленный взгляд на проблему патогенеза ДДДМЖ позволяет ответить на вопрос о высокой эффективности многолетнего применения лекарственного препарата мастодинон при традиционном лечении доброкачественной патологии молочных желез. Можно предположить, что механизм действия препарата мастодинон состоит не только в нормализации концентрации пролактина в крови пациентки, но и в купировании вегетативной дисфункции за счет действия на регуляторные центры нервной и гормональной систем.
Полученные результаты позволят оптимизировать терапию диффузной дисгормональной дисплазии молочных желез за счет воздействия на патогенетические звенья возникновения и прогрессирования заболевания (патент № 2452389 «Способ лечения вегетативной дисфункции при фиброзно-кистозной болезни молочных желез у женщин репродуктивного возраста» зарегистрирован от 10.01.2013).