В России, как и в большинстве стран мира, в последние годы отмечается отчетливое снижение показателя материнской смертности. В 2017 г., по данным Минздрава РФ, он составил 9,6 на 100 000 родившихся живыми, что на 8,6% ниже, чем в 2016 г., и на 60,3% ниже, чем 10 лет назад (рис. 1).
В то же время структура причин материнской смертности изменяется мало. По последним опубликованным данным Минздрава России, в 2017 г. по-прежнему ведущее место занимают экстрагенитальные заболевания (35%), акушерские кровотечения (23,3%), а также гипертензивные расстройства, в том числе преэклампсия (ПЭ) и эклампсия (12,9%) [1].
Снижение показателя материнской смертности от ПЭ и эклампсии крайне нестабильно, что представлено на рис. 2. В 2017 г. данный показатель снизился на 10,1% по сравнению с предыдущим годом и составил 1,24 на 100 000 живорожденных (см. рис. 2) [1]. По предварительным данным Минздрава России, в 2018 г. данный показатель снизился почти на 20% по сравнению с 2017 г.
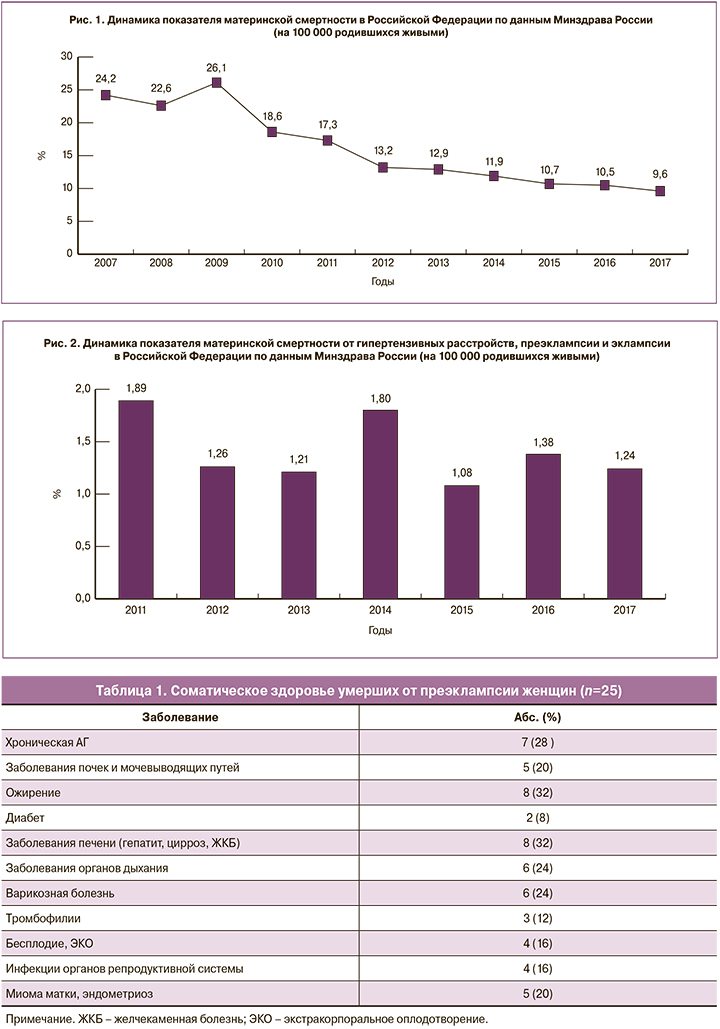
В структуре осложнений ПЭ и эклампсии, которые привели к летальному исходу, не теряют своей значимости высокая частота тяжелых поражений печени (острая печеночная недостаточность, HELLP-синдром), почек (острая почечная недостаточность), головного мозга (эклампсия, острые нарушения мозгового кровообращения) и массивных коагулопатических кровотечений. Частота таких жизненно опасных осложнений, по данным Минздрава России, представлена на рис. 3.
Доля предотвратимых и условно предотвратимых случаев смерти от ПЭ, по данным Минздрава, увеличилась до 80,9% в 2017 г. (в 2016 г. она составила 69,2%). Все пациентки умерли в условиях стационаров II и III уровня оказания медицинской помощи.
С целью более подробного изучения современных особенностей развития и прогрессирования наиболее тяжелых форм ПЭ и ее осложнений, выявления и анализа врачебных ошибок и недочетов при оказании медицинской помощи умершим пациенткам (как на этапе амбулаторного наблюдения, так и в стационаре) нами проведен очередной этап конфиденциального аудита материнской смертности от ПЭ и эклампсии в регионах Российской Федерации за 2017–2018 гг. Проведен сравнительный анализ результатов последнего и предыдущего аудитов, уже опубликованного в ведущих российских журналах и методических письмах Минздрава России (2013–2015 гг.).
Материалы и методы
Аудит проводился на основании ретроспективного анализа медицинской документации (медицинские карты амбулаторного больного, индивидуальные карты беременной и родильницы, истории родов, медицинские карты стационарного больного, протоколы патологоанатомического исследования, протоколы клинических разборов) на 25 случаев материнской смерти от ПЭ, эклампсии и их осложнений в 2017–2018 гг. в РФ. Документация предоставлена департаментом медицинской помощи детям и службой родовспоможения Минздрава России.
Результаты и обсуждение
Среди 80% умерших от преэклампсии – женщины старше 30 лет, 16% – в возрасте 20–25 лет, 4% – 25–30 лет. Первобеременные составили лишь 20%, а 80% были повторнобеременными.
Не состояли на учете по беременности в женской консультации и не были обследованы 5 (20%) женщин исследуемой группы.
Все (100%) пациентки имели 1–2 и более соматических и гинекологических заболеваний (табл. 1). Эти данные совпадают с результатами предыдущего аудита и подтверждают тот факт, что умирают в основном больные женщины. Наиболее часто имели место хроническая артериальная гипертензия (АГ), инфекции почек и мочевыводящих путей, ожирение, заболевания печени (инфекционной и неинфекционной природы). У 3 (12%) достаточно молодых женщин (27, 30 и 36 лет) после патологоанатомического исследования был выявлен ранний выраженный атеросклероз аорты и коронарных артерий. Еще у 3 (12%) женщин фоновое заболевание не было диагностировано при жизни и выявлено только патологоанатомом (хронический гепатит, цирроз печени, хронический гломерулонефрит). Необходимо отметить тот факт, что на врожденные и приобретенные тромбофилии обследованы 3 (12%) пациентки уже при развитии критического состояния (постэкламптическая кома, геморрагический инсульт).
У 23 (92%) умерших имела место ранняя ПЭ с клинической манифестацией до 34 недель беременности. При этом у 13 (52%) – ее наиболее неблагоприятный вариант с появлением клинических симптомов до 30 недель. Соотношение ранней и поздней ПЭ в исследуемой группе составило примерно 12:1, в то время как в общей популяции это соотношение обычно равно 1:4 и более.
Что касается особенностей манифестации ПЭ в группе умерших женщин, то чаще всего в качестве первого симптома регистрировалась патологическая прибавка веса и отечный синдром – у 13/21 (61,9%), реже АГ – у 7/21 (33,3%), очень редко первым симптомом была протеинурия – у 1/21 (4,8%). У 4 умерших особенности начала ПЭ выяснить не удалось (не наблюдались).
В то же время у каждой третьей (32%) еще до появления классических симптомов ПЭ имели место нарушения гемодинамики в сосудах фетоплацентарного комплекса (ФПК), у каждой пятой (20%) – патологические изменения в системе гемостаза, чаще активация внутрисосудистого свертывания крови (при этом на тромбофилии не обследована ни одна беременная).
По-прежнему отмечаем, что характерной современной особенностью является нетипичная, неклассическая клиническая картина тяжелой ПЭ, что во многом может быть обусловлено проводимой терапией (антигипертензивные препараты, антиагреганты, антикоагулянты и др.) и развитием некоторых осложнений. Так, тяжелая артериальная гипертензия зафиксирована лишь у 52%, массивная протеинурия – у 58,8%, выраженные отеки, анасарка – также у 58,8%. У некоторых погибших женщин (8%) имела место гипотония (на фоне преждевременной отслойки плаценты и кровотечения), что затрудняло диагностику ПЭ.
У 52% умерших регистрировалась тяжелая, рефрактерная к терапии АГ, когда назначение трех и более антигипертензивных препаратов в адекватной дозировке не позволяло достичь безопасного уровня АД. По сути, это одна из основных причин разрыва мозговых сосудов и развития внутримозговых кровоизлияний, что в большинстве наблюдений и привело к смерти.
Основными осложнениями, послужившими причиной летального исхода, являются отек головного мозга с дислокационным синдромом, синдром полиорганной недостаточности, массивные коагулопатические кровотечения и, что особо обратило на себя внимание, – это увеличение частоты развития острых нарушений мозгового кровообращения (ОНМК). Летальные осложнения по данным последнего и предыдущего аудитов представлены на рис. 4.

В связи с высокой частотой ОНМК в 4 раза возросла частота проведения трепанации черепа с целью удаления внутричерепных гематом (до 12% по сравнению с 3% в предыдущие годы), хотя необходимость данной операции возникала еще чаще, но в силу тяжести состояния пациенток трепанация была невозможна. По-прежнему отмечается высокая частота оперативного родоразрешения (84%), а также гистерэктомии (36%), перевязки регионарных сосудов (24%) и релапаротомии (28%).
Непосредственной причиной смерти у большинства умерших пациенток явились внутримозговые кровоизлияния, отек головного мозга с дислокационным синдромом (48%), а также полиорганная недостаточность (32%), геморрагический шок (8%), акушерские эмболии (8%), септический шок (4%).
Смерть наступила в первые сутки после родоразрешения у 4 (16%) женщин, на 2–7-е сутки – у 11 (44%), после 7 суток – у 10 (40%).
Родилось 28 детей (3 двойни). Перинатальные потери, по данным последнего аудита, несколько уменьшились – с 42,9% в предыдущие годы до 28,6%. Возросло число преждевременных родов до 90% по сравнению с 79,4% в предыдущие годы. Однако частота таких осложнений, как гипоксически-ишемическое поражение ЦНС, внутрижелудочковые кровоизлияния, тяжелая асфиксия, гипотрофия у новорожденных, достоверно не изменилась.
Несколько подробнее хотелось бы остановиться на ОНМК, частота которых, по данным последнего аудита, увеличилась более чем в 2 раза и зарегистрирована у 13 (52%) погибших. Лишь у 8% это были ишемические инсульты, у 92% – геморрагические. А именно геморрагические поражения головного мозга имеют особенно неблагоприятный прогноз: на их долю, по опубликованным данным, приходится от 40 до 60% случаев смерти при эклампсии [2].
В процессе родоразрешения или сразу после него произошло 90,9% всех ОНМК, во время беременности – 9,1%. В этой группе умерших женщин ОНМК предшествовала тяжелая АГ у 81,8%. К моменту инсульта у 100% регистрировалась тромбоцитопения. У 72,7% ОНМК возникло на фоне HELLP-синдрома (для которого также характерна тромбоцитопения). Почти все (90,9%) пациентки родоразрешены путем операции кесарева сечения (КС) под эндотрахеальным наркозом.
Обращаясь к данным литературы, частота инсультов у беременных в 2–3 раза выше, чем у небеременных репродуктивного возраста [2], – 11 случаев на 100 000 небеременных 15–44 лет и 25–34 на 100 000 родов. У беременных с АГ любого генеза риск инсульта в 6–9 раз выше, чем у беременных без АГ [3].
Если проследить частоту ОНМК во время гестационного процесса, то, как свидетельствуют недавно опубликованные данные [4], наиболее опасные в этом плане периоды – это роды (инсульт развивается у 161,1 из 100 000) и ранний послеродовый период (у 47,1 из 100 000). Во время беременности, по данным тех же авторов, инсульт развивается в 10,7 случаях на 100 000 родов.
Проанализировав все клинические данные собственных исследований и с учетом данных литературы, мы выделили основные факторы риска развития ОНМК:
- тяжелая, рефрактерная к терапии АГ, сохраняющаяся достаточно длительное время;
- тромбоцитопения, состояние гипокоагуляции, которые сопровождают наиболее тяжелые формы ПЭ и HELLP-синдром;
- деструктивный характер поражения эндотелия сосудов у женщин с ПЭ, описанный нами ранее и неоднократно опубликованный;
- сам процесс родоразрешения (родовой стресс). Немаловажное значение имеют резкие колебания АД (на фоне неадекватной антигипертензивной терапии, в момент интубации и экстубации, недостаточного обезболивания и т.д.);
- значимые изменения гемодинамики во всех органах и системах в раннем послеродовом периоде, в том числе в головном мозге;
- патогенетические особенности ПЭ, которые входят в понятие PRES (posterior reversible encephalopathy syndrom) – синдрома задней обратимой энцефалопатии. В частности, описанная многими авторами форсированная вазодилатация церебральных артериол, чрезмерная гиперперфузия могут приводить к разрыву мозговых сосудов;
- нарушение (срыв) ауторегуляции мозгового кровотока, которое у беременных с ПЭ может происходить при значительно более низких цифрах АД (эклампсия при умеренной гипертензии) [5];
- изменения в архитектонике мозговых артерий, мальформация сосудов головного мозга. В таких сосудах имеет место уменьшение коллагена, снижение эластичности и прочности сосудистой стенки, нарушение микроциркуляции, что и способствует разрыву сосудов.
Эклампсия зарегистрирована у 7 (28%) умерших. У 6 (85,7%) из них судорожный приступ развился в разные сроки беременности (у 1 – в 38 недель, у 5 – в 22–37 недель); у 1 (14,2%) – в первые сутки после КС в 40 недель. Эклампсии предшествовала тяжелая АГ у 5 (71,4%) женщин (после приступа в 100% имела место тяжелая, критическая гипертензия – свыше 180/120 мм рт.ст.). Головная боль в качестве предвестника эклампсии имела место у 85,7% пациенток; тошнота, рвота – у 42,9%, боли в эпигастральной области, правом подреберье – у 28,6%, печеночная и почечная дисфункция/недостаточность отмечена у ⅔ умерших.
HELLP-синдром диагностирован у 12 (48%) пациенток. В ⅔ случаев его симптомы зарегистрированы во время беременности (66,7%). Лишь у ⅓ развитие и прогрессирование клинической картины HELLP отмечено после родоразрешения. Обратил на себя внимание тот факт, что в некоторых стационарах уже пытаются диагностировать другие формы тромботической микроангиопатии (ТМА), к которым относится и HELLP-синдром, а также применять специфическую таргетную терапию атипичного гемолитико-уремического синдрома – аГУС (констатирован у 2 умерших). В остальных наблюдениях диагноз HELLP-синдрома был поставлен только на основании клинической картины, и дополнительные диагностические мероприятия не проводились.
Далее хотелось бы представить перечень врачебных ошибок и недочетов в ведении беременности, родов и послеродового периода у женщин, умерших от ПЭ/эклампсии и их осложнений.
1. Частое отсутствие постоянного мониторинга АД, резкие колебания которого могут быть причиной ОНМК.
Клинический пример.
Беременная, 40 лет. Беременность 4, предстоящие роды 2 (в анамнезе 1 самопроизвольный выкидыш до 12 недель, 1 медаборт). Экстрагенитальные заболевания: НЦД «по гипертоническому типу», варикозная болезнь. С 20-й недели подъемы АД до 140/90, с 35-й недели – отеки. Поступила в стационар с доношенной беременностью. АД 160/100, выраженные отеки ног, кистей рук, лица, передней брюшной стенки. Протеинурия 0,48 г/л. Введено Sol. MgSО4 25% – 20 мл в/в болюсно, реланиум 2 мл, Нифедипин 2 таблетки под язык. Через 10 мин – АД 120–130/80–85. Через 3 ч – лапаротомия, КС. В 1-е сутки послеоперационного периода: HELLP-синдром, нарастание печеночно-почечной недостаточности, тромбоцитопения до 56×109, рефрактерная к терапии АГ до 190/100, ОНМК (подтверждено КТ через 12 ч после операции). Смерть на 3-и сутки послеоперационного периода (отек ГМ, дислокационный синдром).
Необходимо помнить также о том, что для ПЭ характерен антиангиогенный дисбаланс в течение довольно длительного времени, что приводит к снижению плотности капиллярного русла в органах и тканях, обеднению капиллярного кровотока. Данный факт подтвержден собственными иммуногистохимическими (ИГХ) исследованиями аутопсийного материала. В связи с этим быстрое и резкое снижение АД (как показано в клиническом примере) может приводит к снижению перфузии органов и тканей, вплоть до некротических изменений (клинический эквивалент – HELLP-синдром).
2. По-прежнему имеет место неполное обследование беременных.
Клинические примеры:
- при привычном невынашивании беременности (5 самопроизвольных выкидышей в анамнезе) пациентка не обследована по протоколу; только при развитии ОНМК выявлена тяжелая мультигенная тромбофилия;
- в женской консультации выявлена тромбоцитопения в 28 недель (78×109), направлена к гематологу. Из амбулаторной карты: «записалась на прием к гематологу через 22 дня (!). В 29 недель поступила с клинической картиной классического HELLP-синдрома, смерть на 2-е сутки после родоразрешения»;
- у беременной в 13 недель выявлена бессимптомная бактериурия, в 16 недель – лейкоцитурия, в 19 недель поставлен диагноз «гестационный пиелонефрит» (по лабораторным данным). УЗИ почек не выполнено. Консультации уролога нет. Адекватная терапия не проведена.
У 12% умерших женщин диагностика серьезных заболеваний и некоторых осложнений беременности проведена патологоанатомом: хронический гломерулонефрит, хронический гепатит, цирроз печени; гнойный децидуит, хориоамнионит.
3. Несвоевременная диагностика тяжелой ПЭ.
Клинический пример:
Беременная, 34 года, доставлена МСП с признаками преждевременной отслойки плаценты в 36 недель беременности. АД 80/60–70/40, отеки голеней. Антенатальная смерть плода. Диагноз: Беременность 8-я, 36 недель. ПОНРП. Массивное кровотечение. Геморрагический шок III степени. Антенатальная смерть плода. Начата интенсивная ИТТ, развернута операционная. Через 5 минут от момента поступления – генерализованный судорожный приступ (в отсутствие диагноза ПЭ и введения сульфата магния).
4. Незнание врачами смежных специальностей особенностей ПЭ и ее осложнений, когда вместо HELLP-синдрома ставится диагноз «острый вирусный гепатит», «острый холецистопанкреатит» и др.
Клинический пример:
У беременной 27 лет (беременность 3, роды предстоят 3) в сроке 35 недель появились жалобы на тошноту, рвоту, боли в правом подреберье. При осмотре – субиктеричность кожи и слизистых, незначительные отеки. АД 140/90. Доставлена МСП в приемное отделение ЦРБ. Осмотрена неврологом, урологом, инфекционистом, гинекологом. Диагноз: Беременность 35 недель. Острый вирусный гепатит? Острый холецистопанкреатит? Умеренная ПЭ. Диагноз «HELLP-синдром» поставлен только в послеоперационном периоде.
В данной ситуации поразила запись невролога: «…обращает на себя внимание повышение магния в крови, что требует отмены в/в инфузии МgSO4» (и это у беременной с тяжелой ПЭ).
5. По-прежнему отмечаются ошибки в определении объема кровопотери с последующим неадекватным ее восполнением.
Клинический пример:
Беременная, 34 года. Беременность 10-я. Роды предстоят 6-е. Вес 94 кг. В 35–36 недель – преждевременная отслойка плаценты, кровотечение на фоне тяжелой ПЭ. АД 90/60. В 7.40 доставлена в стационар: в 7.53 – КС, ампутация матки (матка Кувелера), Hb 62 г/л (исходно – Hb 112 г/л). «Общая кровопотеря 1500 мл». В 13.07 – релапаротомия в связи с внутрибрюшным кровотечением (из протокола операции – «в брюшной полости 1500 мл жидкой крови»). Смерть во время операции («остановка сердца»). «Общая кровопотеря 3000 мл». В течение этих 5 ч от момента поступления до смерти перелито: эритроцитарная масса 460 мл, свежезамороженная плазма 1200 мл, кристаллоиды 5300 мл, венофундин 6% – 500 мл. Заключение патологоанатома: причина смерти – геморрагический шок (реальная кровопотеря не менее 4000 мл).
6. В большинстве наблюдений при развитии клиники HELLP-синдрома отсутствует дифференциально-диагностический поиск других форм ТМА, при которых возможна специфическая терапия, позволяющая в десятки раз снизить смертность, в частности при аГУС. Так, аГУС вынесен в диагноз у 2 пациенток (основываясь только на клинических симптомах, без дообследования и соответствующей терапии). Экулизумаб введен 1 пациентке – с большим опозданием, на 12-е сутки послеоперационного периода (при этом в истории родов диагноз ТМА вообще не был выставлен); женщина умерла на 15-е сутки от полиорганной недостаточности. Активность ADAMATS-13 определена лишь у 1 пациентки (для исключения тромботической тромбоцитопенической пурпуры).
7. Ошибки маршрутизации, длительная транспортировка из учреждений I в II, а затем в учреждение III группы оказания медицинской помощи, когда происходит антенатальная смерть плода, и развиваются необратимые повреждения в органах и системах матери.
Клинический пример:
Беременная, 20 лет с хроническим пиелонефритом. Беременность 2. Роды 1. Наблюдалась на ФАП с 9 недели. В 22 недели – головные боли в течение 2 дней (принимала самостоятельно цитрамон, без эффекта), слабость, головокружение, отеки, вызван фельдшер. 11.07.2017 г. в 7.10 – «на момент появления фельдшера появились клонические судороги, в/в введено 16 мл сульфата магния». 7.20 – «доложено по телефону дежурному врачу скорой помощи». 7.45 – выехала реанимационная бригада СП. 8.05 – прибыла реанимационная бригада: «судорожная готовность, АД 145/100, сердцебиение плода отсутствует. Провели следующие мероприятия: введен желудочный зонд, проведено промывание желудка, поставлен периферический венозный катетер, катетеризация мочевого пузыря, нифедипин 10 мг под язык, реланиум 10 мг, сульфат магния 6 мл/ч. Под в/в наркозом интубирована, переведена на ИВЛ. 9.15 (через 2 ч!) – доставлена в отделение реанимации ЦРБ. Проведено обследование (анализы мочи, крови, ЭКГ, УЗИ плода, УЗИ органов брюшной полости, УЗИ почек, рентгенограмма органов грудной клетки, консультации офтальмолога, невролога, хирурга). «В связи с тяжестью состояния решено перевести в учреждение III группы». 12.50 – санавиацией доставлена в республиканскую больницу. 13.03–13.48 (через 6 ч!) – лапаротомия, КС. Смерть на 2-е сутки после операции (ОНМК, отек головного мозга, полиорганная недостаточность).
8. Анестезиологические осложнения: сквозное повреждение стенки подключичной вены c повреждением париетальной плевры и формированием массивной медиастинальной гематомы 1750 мл, не диагностированное при жизни.
Клинический пример:
Первобеременная, 22 года. С 34 недели – АД до 140/90 (стационарное лечение с диагнозом: Гестационная АГ). В 37 недель – госпитализирована в экстренном порядке: АД 180/105, протеинурия 6,6 г/л, анурия. При УЗИ выявлена ретроплацентарная гематома. В 0.30 – лапаротомия, КС, экстирпация матки в связи с кровотечением, формированием «матки Кувелера». Общая кровопотеря 1500 мл. Согласно записи в истории родов: «ввиду затруднения доступа к периферическим венам выполнена катетеризация центральной вены». В 15.00 – падение гемодинамики. При ЭхоКГ – нарушение сократимости левого желудочка, клапанная недостаточность (аортальная недостаточность I, митральная недостаточность II, недостаточность легочного клапана I, трикуспидальная недостаточность I). На рентгенограмме – «расширение верхней трети средостения, медиастинит». Релапаротомия, ревизия органов брюшной полости (в брюшной полости источника кровотечения не найдено). Hb 26 г/л, эритроциты 0,41×1012, тромбоциты 37×109 (явно недостаточная, неадекватная инфузионно-трансфузионная терапия!). Через сутки – смерть от геморрагического шока. Массивная медиастинальная гематома обнаружена патологоанатомом.
Тщательный анализ всех случаев материнской смертности позволил сформулировать и обосновать несколько рекомендаций, которые позволят использовать резервные возможности в снижении материнской смертности от ПЭ, эклампсии и их осложнений:
1. Необходима качественная диагностика АГ, в том числе в I триместре беременности, когда в норме в 10–14 недель имеет место максимальное снижение общего периферического сосудистого сопротивления и АД (оценка среднего АД – это вычисление среднего АД из серии последовательных измерений в течение 15–20 минут). По-видимому, АД выше 120/80 мм рт.ст. в эти сроки не может считаться нормальным. В этом мы согласны с нашими зарубежными коллегами, в частности, с новыми рекомендациями по лечению АГ американской коллегии кардиологов и американской кардиологической ассоциации (2017 г.). В последних указано, что АД 120–129/80 мм рт.ст. – это повышенное АД, а 130–139/80–89 мм рт.ст. – уже АГ I степени, которая, при наличии факторов риска, требует назначения антигипертензивных препаратов [6].
2. Тщательное проведение непрерывного мониторинга АД при уже развившейся ПЭ. Его цель – предупреждение резких подъемов АД. Антигипертензивная терапия должна носить предупредительный характер (не после подъема АД, а до него, с учетом периода полувыведения препаратов).
3. Терапевтическое снижение АД должно быть не резким, а более постепенным для сохранения и поддержания перфузии внутренних органов и плаценты в условиях антиангиогенного состояния при ПЭ. Грамотный мониторинг и терапевтический контроль АД во многом зависят от реанимационно-анестезиологической службы стационаров.
4. Наиболее опасные периоды для ОНМК при ПЭ, эклампсии – роды и 1-е сутки послеродового периода. Следует прогнозировать возможность развития ОНМК в эти сроки у пациенток с тяжелой рефрактерной к терапии гипертензией, тромбоцитопенией, врожденными и приобретенными тромбофилиями, мальформациями сосудов головного мозга, а также при развитии симптомокомплекса ТМА.
5. Требуется постоянная настороженность в отношении возможного развития ПЭ и ее осложнений при появлении любого ее клинического симптома в перинатальном периоде (с 22 недель).
6. При развитии наиболее тяжелых форм ПЭ, эклампсии и их осложнений трудно переоценить значение многопрофильных больниц, когда доступна и быстро осуществима консультация любого специалиста:
- гематолога (в группах риска и при любых гематологических отклонениях, у всех женщин с клинической картиной ПЭ);
- невролога (всех пациенток с ПЭ, эклампсией и HELLP-синдромом);
- нефролога, офтальмолога и других;
- при любом подозрении на ОНМК имеется возможность проведения КТ или МРТ головного мозга.
7. При развитии клинической картины HELLP-синдрома (микроангиопатическая гемолитическая анемия, тромбоцитопения, микротромбозы, полиорганная дисфункция) возможно проведение дополнительных диагностических мероприятий для исключения других заболеваний и осложнений, протекающих с клинической картиной ТМА.
В частности, ранняя диагностика аГУС и комплексное его лечение с применением специфической терапии, блокирующей образование конечного продукта чрезмерной активации системы комплемента (МАК – мембран-атакующего комплекса), позволяет снизить летальность с 90 до 10% [7, 8].
При выявлении тромботической тромбоцитопенической пурпуры введение пациентке тромбоцитов усугубляет процесс микротромбообразования и ухудшает течение заболевания;
8. Повышение знаний врачей смежных специальностей в отношении ПЭ и ее осложнений;
9. Внедрение и использование современных методик по прогнозированию и ранней диагностике плацентарных нарушений и ПЭ. Проведение комбинированного скрининга (факторы риска ПЭ, среднее АД, PI в маточных артериях, биохимические предикторы PIGF или sFlt/PIGF) позволяет прогнозировать преэклампсию до 37 недель с вероятностью 76,6% [9].
10. Наблюдение и родоразрешение беременных группы высокого риска должно осуществляться в учреждениях III группы оказания медицинской помощи.
Заключение
Таким образом, тщательный анализ всех случаев материнской смертности позволил сформулировать и обосновать рекомендации, которые дают возможность использовать резервные возможности в снижении материнской смертности от ПЭ, эклампсии и их осложнений.



