Большинство аутоиммунных заболеваний манифестирует у пациенток репродуктивного возраста, и многие женщины данной группы сталкиваются с проблемами в реализации репродуктивной функции. Ревматоидный артрит (РА) является одним из наиболее распространенных аутоиммунных заболеваний во всем мире. В России, по данным эпидемиологических исследований, РА страдают около 800 тысяч человек [1]. Известно, что около трети пациенток с РА, диагностированным до наступления первой беременности, имеют сниженную фертильность [2]. В исследовании Clowse M. et al. (2012) по оценке репродуктивной функции у женщин с РА и системной красной волчанкой (СКВ) было установлено, что 55% женщин с РА и 64% – с СКВ имели меньше детей, чем планировали изначально [3]. О снижении фертильности у женщин с ревматическими заболеваниями, в частности с РА, сообщалось в ряде публикаций 2011–2016 гг. [4, 5].
Следует отметить, что у пациенток с РА зафиксирован более длительный период до наступления первой беременности по сравнению со здоровыми женщинами [5]. Отрицательное влияние на функционирование репродуктивной системы может оказывать как само аутоиммунное заболевание, так и лекарственная терапия [6].
Отрицательное влияние течения РА, а также проводимой терапии на репродуктивную функцию может быть обусловлено следующими механизмами.
- Нарушением взаимодействия провоспалительных медиаторов. Многие цитокины, хемокины и факторы роста играют важную роль в физиологии репродукции, в частности, в процессе имплантации [7], однако их роль в снижении фертильности у больных системными воспалительными заболеваниями до конца не изучена [8].
- Использованием нестероидных противовоспалительных препаратов (НПВП), которые могут нарушать процессы овуляции, имплантации и плацентации путем ингибирования синтеза простагландинов [9]. Считается, что селективные ингибиторы циклооксигеназы-2 подавляют овуляцию сильнее, чем неселективные НПВП. Однако данные выводы основаны на исследованиях с немногочисленными выборками [10].
- Использованием преднизолона, что может оказывать влияние на функционирование гипоталамо-гипофизарно-яичниковой оси. Показано, что глюкокортикоиды в терапевтических дозах могут негативно влиять на пик лютеинизирующего гормона, нарушая процессы овуляции, а также пролонгируют время ожидания наступления беременности [11].
Наряду с НПВП и глюкокортикоидами, многие пациенты в качестве базисной терапии получают метотрексат (MTX) – цитотоксический препарат, относящийся к группе антиметаболических средств. MTX оказывает негативное влияние на быстро делящиеся клетки, к которым можно отнести клетки ткани яичника и эндометрия. Повреждение этих клеток, будь то временное или постоянное, способно повлиять на фертильность, особенно у женщин с уже скомпрометированной репродуктивной функцией на фоне течения основного заболевания и/или в связи с приемом других препаратов и сопутствующей гинекологической патологией [12]. В ряде исследований оценивали влияние МТХ на состояние репродуктивной системы и овариальный резерв. По данным Brouwer J. et al. (2013), уровни антимюллерова гормона (AMГ) сыворотки у 72 женщин с недавно диагностированным РА, которые не получали терапию, значительно не отличались от показателей здоровых женщин [13]. Уровень AMГ у пациенток с РА, получавших МТХ парентерально в дозе 20 мг/неделю в течение 6 месяцев, был аналогичен уровню гормона у женщин, не получавших лечение [14]. Однако, согласно результатам исследования Henes M. et al. (2015), уровни AMГ сыворотки были значительно снижены у пациенток с ревматическими заболеваниями (РА, болезнь Бехчета и спондилоартрит) по сравнению с сопоставимыми по возрасту здоровыми женщинами [15]. В ходе другого исследования, в котором оценивали овариальный ответ на стимуляцию яичников, было показано, что среди женщин, принимавших МТХ в течение 18 месяцев, наблюдался значительно более слабый ответ яичников на стимуляцию по сравнению с контрольной группой [12].
Таким образом, отсутствие однозначных данных о влиянии основного заболевания на репродуктивную функцию, а также терапии МТХ на состояние овариального резерва у женщин с проблемами реализации репродуктивной функции и РА послужило основанием для проведения настоящего исследования.
Цель исследования – оценить показатель АМГ – основного маркера овариального резерва, у пациенток с РА и бесплодием, получавших и не получавших терапию МТХ.
Материалы и методы
В наблюдательное исследование были включены 72 пациентки с бесплодием, в том числе: 32 больные РА, которые составили основную группу, и 40 соматически здоровых пациенток группы сравнения, обследованных в ФГБУ «НМИЦ АГП им. В.И. Кулакова» по поводу бесплодия в 2016–2019 гг. Учитывая тот факт, что исследование является пилотным, объем выборки определялся числом пациентов с заданным диагнозом, выявленным в указанный период. Подбор пациенток основной и сравниваемой групп осуществлялся согласно методу метчированного контроля «pair matching method». Пациентки основной и сравниваемой групп были сопоставимы по возрасту, длительности и типу бесплодия.
Возраст больных РА (основная группа) составил 36 [33;39] лет, возраст начала заболевания – 29 [24;34] лет, медиана продолжительности РА – 4,0 [3; 11] года. На момент исследования 6 (18,8%) пациенток с РА находилось в ремиссии; 13 (40,6%) имели низкую, 10 (31,3%) – среднюю, а 3 (9,3%) – высокую степень активности болезни. Клиническая стадия заболевания оценивалась как ранняя у 7 (21,9%) пациенток, развернутая – у 18 (56,2%) и поздняя – у 7 (21,9%) пациенток. Ревматоидный фактор (РФ) был выявлен у 22 (68,8%) больных, а антитела к циклическому цитруллинированному пептиду (АЦЦП) – у 25 (78,1%). В основной группе 19 (59,4%) женщин получали терапию МТХ, из которых 11 (34,4%) применяли препарат перорально, а 8 (28,1%) – подкожно или внутримышечно в дозе от 10 до 25 мг/неделю. Медиана дозы МТХ составила 15 [15;20] мг/неделю, длительности терапии МТХ ко дню включения в исследование – 18,7 [1;15] месяцев.
Всем пациенткам проведено комплексное обследование на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова», больные основной группы наблюдались также в ФГБНУ «НИИ ревматологии им. В.А. Насоновой». Всеми было подписано информированное согласие на участие в исследовании. Критериями включения в основную группу являлись: достоверный диагноз РА, наличие бесплодия, возраст от 18 до 40 лет. Критерии невключения: недостоверный диагноз РА, возраст старше 40 лет, применение иных (кроме МТХ) цитотоксических препаратов, оперативные вмешательства на яичниках. Критерии включения в группу сравнения: наличие бесплодия, возраст от 18 до 40 лет, отсутствие соматических заболеваний и оперативных вмешательств на яичниках.
Уровень AMГ определяли количественно с использованием стандартного хемилюминесцентного анализа на парамагнитных частицах в сыворотке крови. Нормативные значения АМГ – 1,0–10,6 нг/мл. Значение <1 нг/мл расценивалось как снижение овариального резерва пациенток.
Для статистического анализа использовался пакет статистических программ Statistica 10 for Windows (StatSoft Inc., USA). Для количественных переменных проводился тест на нормальность распределения. Для оценки полученных результатов использованы методы статистического анализа: χ2-критерий Пирсона (анализ таблиц сопряженности), непарный t-критерий Стьюдента. Если выборки из переменных не соответствовали нормальному закону распределения, использовали непараметрические тесты: U-тест по методу Манна–Уитни, критерий Краскела–Уоллиса. Количественные переменные описывались следующими статистиками: медианой (Ме) и интерквартильным размахом [25; 75 перцентили], качественные переменные – абсолютными и относительными частотами (процентами). Для определения взаимного влияния показателей использовали корреляционный анализ Спирмена. Было рассчитано отношение шансов (ОШ) снижения овариального резерва в зависимости от наличия основного заболевания и приема МТХ и 95% доверительный интервал (ДИ) для него. Различия считались статистически значимыми при уровне ошибки p<0,05.
Результаты
Анализ клинико-анамнестических данных показал, что пациентки основной и сравниваемой групп были сопоставимы по возрасту (Ме 36 и 35 лет; р=0,594) и длительности бесплодия (Ме 3 и 4,5 года; р=0,120). Первичное (53,1% и 42,5%) и вторичное (46,9% и 42,5%) бесплодие встречались с одинаковой частотой в обеих группах (p=0,369). Существенных различий в преобладании трубно-перитонеального (21,9% и 32,5%, p=0,317) и мужского (31,3% и 37,5%, p=0,579) факторов бесплодия в группах выявлено не было. Также в обеих группах не было выявлено различий в возрасте менархе (Ме 12,9 и 11,4 лет, р=0,692) и числе самостоятельных беременностей (от 1 до 4) в анамнезе у пациенток с вторичным бесплодием (p=0,503) (табл. 1).
Концентрация АМГ оказалась статистически значимо ниже в основной группе (2,1 нг/мл против 2,73 нг/мл – в группе сравнения, р=0,043). Доля пациенток со снижением овариального резерва (уровень АМГ менее 1,0 нг/мл) существенно превалировала в группе пациенток с РА (25% и 5% в основной и группе сравнения соответственно, р=0,015).
При сравнении больных РА с продолжительностью заболевания 5 лет и менее и более 5 лет значимых различий в медианных уровнях АМГ выявлено не было: 2,8 [0,7;3,8] нг/мл против 1,8 [0,9;2,5] нг/мл (р=0,213). На уровень АМГ не оказывали существенного влияния ни наличие РФ, ни наличие АЦЦП: у 22 (68,7%) пациенток с положительным РФ медианный уровень АМГ составил 2,4 [1,0;3,7] нг/мл, а у 10 (31,3%) серонегативных по РФ – 1,8 [0,7;2,6] нг/мл (р=0,309). 25 (78,1%) пациенток с АЦЦП имели медианный уровень АМГ 2,3 [0,9;3,7] нг/мл, а 7 (21,9%) пациенток, отрицательных по АЦЦП, – 2,1 [0,7;2,6] нг/мл (р=0,412).
С целью уточнения влияния терапии МТХ на показатели АМГ основная группа была разделена на две подгруппы. Первую подгруппу составили 19 пациенток с бесплодием и РА, которые получали терапию МТХ. Вторую подгруппу составили 13 пациенток с бесплодием и РА, которые не получали МТХ. Обе подгруппы были сопоставимы по возрасту, длительности и степени активности заболевания (р>0,05). Сравнительная оценка уровня АМГ в зависимости от использования МТХ представлена в таблице 2.
Статистически значимых различий в показателях АМГ двух подгрупп не было выявлено (р1-2=0,788). Уровень АМГ больных РА, не получавших МТХ, и пациенток группы сравнения существенно не отличался (р2-К=0,160). При оценке уровня АМГ пациенток с РА, получавших МТХ, и пациенток группы сравнения была выявлена тенденция к снижению показателя в первой подгруппе, однако статистически значимого различия выявлено не было (р1-К=0,074), что может быть обусловлено небольшой выборкой.
С целью определения снижения овариального резерва (уровень АМГ менее 1,0нг/мл) в зависимости от наличия основного заболевания и приема МТХ было рассчитано отношение шансов (ОШ) и 95% ДИ для него (табл. 3).
Снижение овариального резерва чаще имело место у больных РА (8/32 (25%)), чем у пациенток группы сравнения (2/40 (5%)), ОШ 3,52; 95% ДИ 0,96–12,81; р=0,063. В группе пациенток с РА снижение овариального резерва существенно чаще выявлялось у больных, не принимавших МТХ (5 из 13 (38%)), чем у представителей группы сравнения (2/40 (5%)), ОШ 5,63; 95% ДИ 1,22–26,05; р=0,031. Пациенты с терапией МТХ в анамнезе не продемонстрировали более высокой частоты снижения уровня АМГ по сравнению с пациентами группы сравнения. При сравнении случаев снижения овариального резерва у больных, принимавших МТХ (3/19 (16%)) и не принимавших МТХ (5/13 (38%)), статистически значимой разницы в показателях не было выявлено (ОШ 2,3; 95% ДИ 0,49–11,27; р=0,427).
Следует отметить, что в результате проведения сравнительного анализа статистически значимых корреляций между показателями АМГ и степенью активности заболевания, а также дозой и длительностью приема МТХ показано не было (р>0,05).
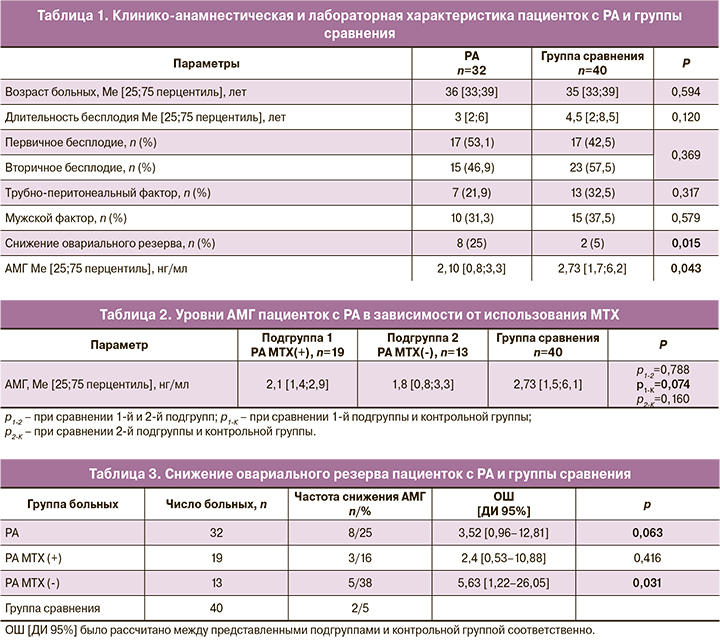
Известно, что уровень AMГ в сыворотке крови – наиболее объективный маркер овариального резерва, который снижается с возрастом. Для выявления влияния МТХ на состояние овариального резерва была проведена оценка уровня АМГ в выделенных подгруппах, а также во всей группе больных РА. Корреляционный анализ зависимости уровня АМГ от возраста пациенток с РА (пациентки были сопоставимы по возрасту во всех сравниваемых группах) показал наиболее выраженное снижение АМГ в подгруппе пациенток, принимавших МТХ, по сравнению с подгруппой больных РА, не получавших МТХ, и по сравнению со всеми пациентками с РА независимо от получаемой терапии (rs=-0,563; р<0,05) (рис. 1а, 1б и 1в).
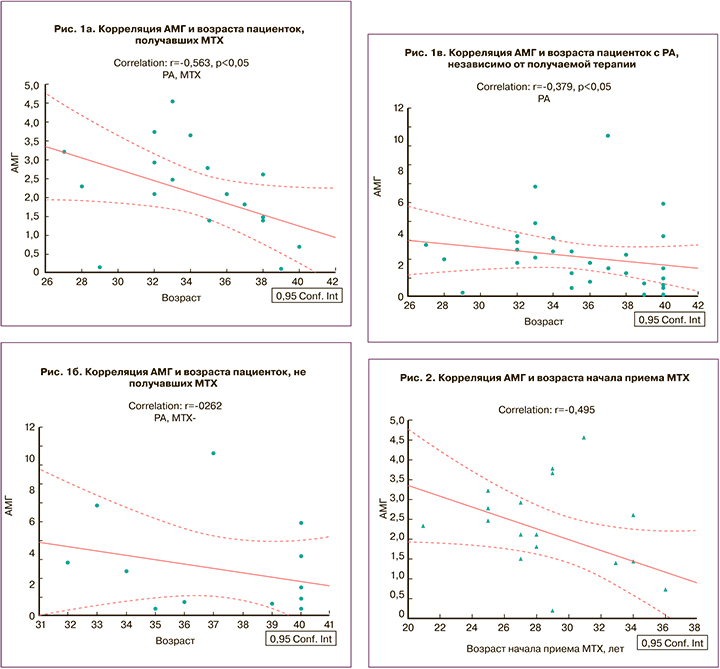
Была отмечена слабая отрицательная корреляция значения АМГ с возрастом начала терапии МТХ (rs=-0,459; р<0,05) (рис. 2).
Обсуждение
О снижении фертильности у пациенток с РА сообщалось в нескольких исследованиях [2–5], однако достоверное влияние определенного фактора или группы факторов не было установлено.
В данном исследовании было проанализировано влияние самого заболевания и терапии МТХ на уровень АМГ и состояние овариального резерва.
АМГ – один из ключевых параметров оценки репродуктивной функции и овариального резерва. Уровень AMГ в сыворотке крови довольно стабилен на протяжении всего менструального цикла и коррелирует с остаточным фолликулярным пулом у женщин репродуктивного возраста [16]. Литературные данные об уровне AMГ как у женщин с РА, не получавших терапию МТХ, так и у женщин с терапией МТХ в анамнезе противоречивы [12, 13, 14].
В представленном исследовании проанализировано влияние основного заболевания и его параметров, а также применяемой терапии на уровень АМГ. Концентрация АМГ была значительно ниже у пациенток с РА по сравнению с соматически здоровыми женщинами (2,1 нг/мл и 2,73 нг/мл, р=0,043). Длительность и степень активности РА, наличие РФ и антител к АЦЦП не оказали существенного влияния на уровень АМГ, что согласуется с данными других исследователей [14].
Другой параметр, который оценивался в ходе исследования, – применение МТХ – базисного препарата в лечении РА. При оценке влияния препарата на уровень АМГ выявлена тенденция к снижению овариального резерва в подгруппе пациенток, получавших МТХ, по сравнению с пациентками группы сравнения (2,1 нг/мл и 2,73 нг/мл; р=0,074). Однако различия не достигали статистической значимости, возможно, ввиду малочисленности исследуемой группы.
При оценке ОШ снижения овариального резерва в выделенных подгруппах было показано, что снижение овариального резерва чаще имело место у больных РА (8/32 (25%)), чем у пациенток группы сравнения (2/40 (5%)), ОШ 3,52; 95% ДИ 0,96–12,814; р=0,063. При этом снижение овариального резерва существенно чаще выявлялось у больных, не принимавших МТХ, по сравнению с пациентками, получавшими терапию. Полученные результаты свидетельствуют о необходимости дальнейшего исследования при условии увеличения мощности групп с целью уточнения влияния терапии МТХ на состояние овариального резерва.
Корреляционный анализ выявил более выраженное снижение АМГ в подгруппе пациенток с РА, принимавших МТХ, по сравнению с больными РА, не получавшими терапию МТХ, и по сравнению с больными РА, у которых применяемая терапия не учитывалась (rs=-0,563; р<0,05). Таким образом, возрастное снижение АМГ более выражено у больных с терапией МТХ в анамнезе. Была отмечена отрицательная корреляция показателя АМГ с возрастом начала терапии МТХ (rs=-0,459; р<0,05), что позволяет сделать вывод о том, что при использовании МТХ в более позднем репродуктивном возрасте наблюдается более выраженное снижение овариального резерва. Влияние МТХ на состояние овариального резерва в этом случае возможно аналогично влиянию циклофосфана. Так, по данным Manger K. et al., при применении циклофосфана у пациенток с СКВ частота развития преждевременной недостаточности яичников распределяется следующим образом: менее 50% – среди пациенток моложе 30 лет, около 60% – среди пациенток от 30 до 40 лет [17].
Заключение
Таким образом, результаты исследования продемонстрировали, что РА и терапия МТХ ассоциируются со снижением уровня АМГ и, соответственно, овариального резерва. Больные РА составляют большую группу пациентов с аутоиммунными заболеваниями, при которых, как и в случае онкологических заболеваний, может использоваться цитотоксическая терапия. Если в случае онкологических заболеваний цитотоксические препараты используются в больших дозах и значительно влияют на состояние репродуктивной функции пациентов, в случае аутоиммунных заболеваний те же препараты используются в меньших дозах, что не всегда ассоциировано с резким снижением репродуктивной функции. Однако применение цитотоксических препаратов в течение продолжительного времени, наряду с течением иммуновоспалительного процесса у данного контингента больных, также способно оказывать негативное влияние на фертильность.
В связи с этим пациентам с уже скомпрометированной репродуктивной функцией и снижением овариального резерва, которые планируют получать МТХ, следует рекомендовать сохранение генетического материала или реализацию репродуктивного потенциала в более раннем возрасте.



