Рак шейки матки (РШМ) является полностью предотвратимым заболеванием, если обнаруживается на стадии цервикальной интраэпителиальной неоплазии (CIN), и эффективно лечится. Во всем мире насчитывается до 400 000 случаев РШМ каждый год и более 200 000 случаев смерти, что делает его вторым наиболее распространенным злокачественным заболеванием гениталий у женщин репродуктивного возраста [1, 2]. По данным Минздрава Российской Федерации, в 2016 г. в России было зарегистрировано 15 342 новых случаев РШМ. Выявлен прирост заболеваемости РШМ, особенно у женщин репродуктивного возраста [3]. Из общего числа больных преинвазивным раком в России (7187) большинство (4318) имело локализацию в шейке матки [4].
С 1995 г. доказано, что ДНК вируса папилломы человека (ВПЧ) идентифицируется во всех случаях РШМ [5], нередко сочетающегося с анальной формой, как у пациенток, так и у их партнеров, а также с поражением вагинальной и вульварной областей [6, 7]. ВПЧ обнаружен практически во всех карциномах шейки матки и в 65,0–87,0% предраковых заболеваний по всему миру [8]. Персистирующая ВПЧ является основным фактором прогрессирования неопластической трансформации вследствие вирогении, интеграции ДНК ВПЧ в геном клетки и синтеза онкобелков Е7 и Е6 с возникновением иммунных дисфункций на местном уровне. При этом наличие ВПЧ высокоонкогенного риска в цервикальных мазках с нормальной цитоморфологией повышает риск развития CIN III в 116 раз [9–11].
Существующий на данный момент оппортунистический цитологический скрининг не дает ожидаемых результатов раннего выявления онкотрансформации шейки матки [12, 13]. Многочисленные исследования, опубликованные в течение последних 15 лет, продемонстрировали ценность тестирования на ДНК ВПЧ при первичном скрининге РШМ, поскольку ВПЧ диагностируется продолжительнее цитологических изменений [14]. Было неоднократно продемонстрировано, что чувствительность анализа ДНК ВПЧ для выявления заболеваний шейки матки выше, чем у цитологического исследования; в некоторых странах ВПЧ-тестирование используется в качестве основного теста либо в сочетании с цитологическим методом [15, 16].
Активное внедрение вирусологического скрининга РШМ в странах Европейского Союза, а также дискуссионные вопросы цервикального скрининга в России и во всем мире создают предпосылки для создания единого диагностического и прогностического алгоритма для оптимизации диагностики и лечения неоплазии.
Тест digene HC2 HPV DNA Test (QIAGEN) широко используется для скрининга РШМ в городах с высоким уровнем оснащения медицины, который недоступен для сельских, отдаленных районов или районов с низким уровнем оснащенности [17]. Для таких территорий была разработана система диагностическая careHPV (QIAGEN) – скрининг-тест, основанный на технологии гибридного захвата (Hybrid Capture 2=HC2), специально адаптированный для удаленных территорий или территорий с недостаточной инфраструктурой. Тест предназначен для качественного выявления 14 типов ВПЧ с высокой степенью канцерогенного риска (ВПЧ-ВР), время проведения исследования составляет лишь 2,5 ч. Портативный аппарат для выявления ВПЧ не требует отдельного кабинета и больших площадей. Клинические исследования, проведенные на европейских территориях, показали, что его чувствительность в плане обнаружения предраковых состояний шейки матки идентична digene HC2 HPV DNA Test (QIAGEN) [18]. Мы провели перекрестное исследование, чтобы оценить диагностическую точность системы careHPV как быстрого скрининг-теста в провинциальном городе Свердловской области.
Цель исследования – оценить клиническую чувствительность и специфичность системы диагностической careHPV на выявление ДНК ВПЧ в программе организованного скрининга, по сравнению со стандартным цитологическим исследованием на удаленных территориях Свердловской области.
Материалы и методы
Женщинам в возрасте от 30 до 60 лет из города Верхняя Пышма Свердловской области с населением 50 132 человека было предложено присоединиться к исследованию. Критерии включения: женщины 30–60 лет, информированное согласие на проведение вирусологического и цитологического скрининга на РШМ. Критерии исключения: беременность, гистерэктомия в анамнезе, выявленная ранее или пролеченная CIN в анамнезе, ВИЧ-позитивные женщины. Потенциальные участники получали информационный буклет об исследовании, и от них было получено письменное информированное согласие. У женщин проводилось взятие мазка на традиционное цитологическое исследование цитощеткой на стекло и параллельно щеткой careBrush в пробирку со средой careHPV Collection Medium. Пробирка отправлялась в холодильник до проведения исследования. При наборе 90 пробирок проводилось одномоментное ВПЧ-тестирование на системе диагностической careHPV в женской консультации г. Верхняя Пышма. Цитологические образцы были оценены независимо от результатов ДНК тестирования в цитологической лаборатории, в соответствии с классификацией Папаниколау с адаптацией для адекватного анализа данных классификации по системе Бетесда: нормальная цитология, атипичные плоские клетки неясного значения (ASCUS), характеризующие пограничное состояние или эквивалент, LSIL – low-grade squamous intraepithelial lesion – низкая степень плоскоклеточного интраэпителиального поражения; ВПЧ-эффект, соответствует легкой дисплазии (CIN I); HSIL –high-grade squamous intraepithelial lesion – высокая степень плоскоклеточного интраэпителиального поражения; соответствует умеренной дисплазии, а также тяжелой дисплазии (CIS) или CIN II и CIN III; РШМ. При получении аномальных результатов ВПЧ-тестирования, цитологического исследования всем женщинам было проведено кольпоскопическое исследование в женской консультации при ГБУЗ СО «Верхнепышминская ЦГБ». Интерпретацию данных проводили согласно Международной кольпоскопической классификации (обновленной Международной ассоциацией по патологии шейки матки в Рио-де-Жанейро, 2011 г.). Пациенткам с измененным эпителием была предложена и проведена биопсия шейки матки с оценкой согласно гистологической классификации: нормальная, CIN I (LSIL), CIN II, CIN III (HSIL), РШМ.
Статистическую обработку данных проводили с помощью программного пакета SPSS Statistics версии 20.0. Статистическую значимость различий проверяли с помощью двустороннего критерия Фишера (при сравнении данных по частоте выявления) при уровне значимости р<0,05. Для оценки диагностических методов вычисляли и анализировали следующие характеристики: чувствительность, специфичность, +PV (positive predictive value) – прогностическая ценность положительного результата теста, -PV (negative predictive value) – прогностическая ценность отрицательного результата теста, диагностическая точность метода. Чувствительность метода – доля истинно положительных результатов среди больных. Специфичность метода – доля истинно отрицательных результатов среди здоровых. Методы расчета:
Чувствительность = a / (a+c);
Специфичность = d/ (d+b),
где: a – истинно позитивные результаты; b – ложнопозитивные результаты; d – истинно негативные результаты; c – ложнонегативные результаты.
Прогностическая ценность положительного результата теста отражала то, что пациент, имеющий положительные результаты теста, действительно имел заболевание: +PV = а/(а+b)=0,… Прогностическая ценность отрицательного результата теста вычислялась по формуле: -PV = d/(c+d). Диагностическая точность метода – доля истинных результатов среди всех результатов:
Диагностическая точность =(a+d)/ (a+b+c+d) [19].
Чувствительность и специфичность метода были оценена при помощи ROC-анализа с вычислением площади под ROC-кривой.
Результаты и обсуждение
В скрининг были включены 857 женщин. В результате проведенных исследований у обследованных пациенток положительный тест на ВПЧ-ВР в высоком титре методом гибридного захвата на системе диагностической careHPV выявлен у 84 пациенток, что составило 9,80%. Результаты проведенного в дальнейшем кольпоскопического и гистологического исследований продемонстрировали значительно более высокое количество пациенток с CIN и РШМ в группе ВПЧ-ВР-позитивных, по сравнению с данным показателем у ВПЧ-негативных женщин. Следует отметить, что в значительном большинстве случаев спектр заболеваний у ВПЧ-позитивных женщин представлен высокой степенью предраковых и раковых заболеваний шейки матки. Обращает на себя внимание наличие CIN и у ВПЧ-негативных пациенток с визуально измененной шейкой матки. Однако спектр выявленных заболеваний был представлен в основном CIN I (табл. 1). Полученные данные незначительно отличались от результатов, полученных в на территории Европы, и демонстрировали детерминантную роль папилломавирусной инфекции (ПВИ) в развитии высокой степени неоплазии [20].
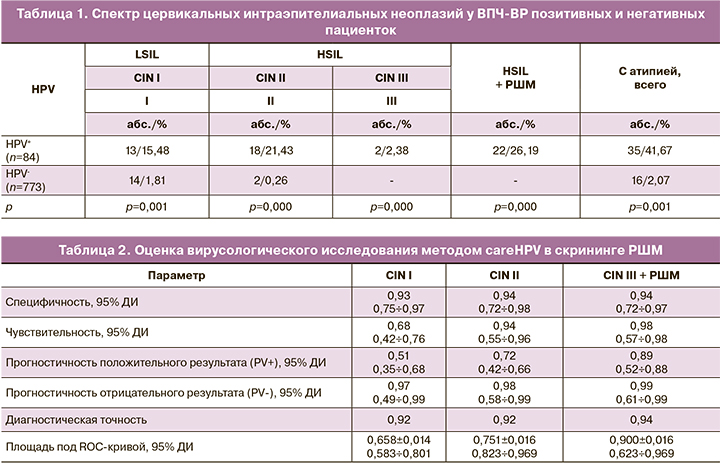
Расчет специфичности и чувствительности метода гибридного захвата на тест-системе careHPV продемонстрировал значительно более высокую чувствительность метода при высокой степени цервикальной неоплазии и РШМ (р=0,002 при CIN II и р=0,001 при CIN III, p=0,000 при РШМ), что совпадает с исследованиями, проведенными на других евроазиатских территориях [21]. Следует отметить высокую прогностичность как положительного, так и отрицательного результата метода гибридного захвата на тест-системе careHPV. По результатам построения ROC-кривой показатель AUC (Area under ROC-curve – площадь под ROC-кривой, пер. с англ.) для CIN III составил 0,900±0,016 с 95%ДИ: [0,623÷0,969] при р=0,001, что соответствовало высокому качеству метода (табл. 2).
Параллельно проведенное цитологическое исследование традиционным методом продемонстрировало значительное различие результатов по выявлению атипической картины поражения цервикального эпителия при сравнении с вирусологическим методом с последующим морфологическим подтверждением (р=0,002) (табл. 3).
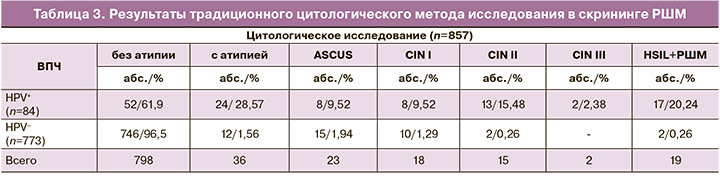
Цитологический метод позволил выделить такое поражение, как ASCUS, диктующее проведение дальнейшего мониторинга состояния экзо- и эндоцервикса. При анализе показателя HSIL+РШМ обращает на себя особое внимание значительное расхождение между результатами традиционного цитологического метода и вирусологического исследования (р=0,004), что также свидетельствует в пользу вирусологического скрининга HSIL и РШМ как первичного звена на удаленных территориях. Имеющиеся в литературе данные о самоизлечении CIN I в 50–60% случаев свидетельствуют о целесообразности выявления на удаленных территориях лишь высокой степени CIN, поскольку CIN I зарубежными исследователями не вносится в классификацию предракового заболевания, и вопрос о лечении CIN I дискутабелен, а удаленность ряда территорий в Российской Федерации требует больших материальных затрат на оказание помощи при данном заболевании. Поскольку концепция профилактики РШМ в Российской Федерации включает лечение LSIL в профилактике развития цервикальной онкопатологии, целесообразно применение на территориях мегаполиса ко-скрининга, позволяющего увеличить чувствительность и специфичность выявления CIN I–III и провести адекватную персонифицированную терапию в сочетании с физиомедикаментозными методами лечения.
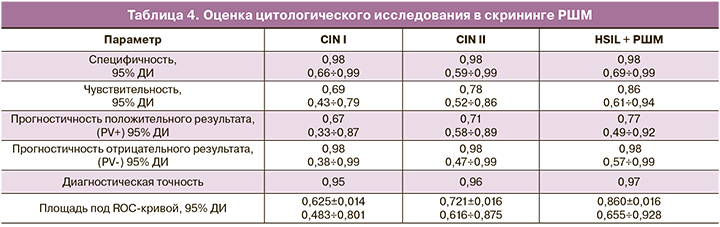
Расчет специфичности и чувствительности традиционного цитологического метода продемонстрировал значительно более высокую специфичность метода, по сравнению с вирусологическим скринингом, что незначительно отличалось от исследований, проведенных на европейских территориях [22]. Наблюдалось повышение чувствительности при высокой степени CIN, однако данный показатель был значительно ниже аналогичного при вирусологическом скрининге (табл. 4).
Алгоритм дальнейшей тактики ведения пациенток с выявленными предраковыми заболеваниями шейки матки включал в себя комплексную терапию: коррекцию вагинального микробиоценоза по результатам тест-полосок на изменение рН среды, противовирусную и иммуномодулирующую терапию с помощью кавитированных низкочастотным ультразвуком растворов пептидных регуляторов иммунитета [23]. После проведенного контроля пациентки с CIN I и сохраненной кольпоскопической картиной подвергались деструкции – аргоноплазменной аблации аппаратом Фотек. Всем пациенткам с высокой степенью неоплазии после коррекции микробиоценоза проводилось оперативное воздействие в виде электроэксцизии или электроконизации, реабилитация для ускорения заживления.
Заключение
Проведенное исследование и расчет оценки скрининговых методов продемонстрировали значительно более высокую чувствительность метода гибридного захвата на системе диагностической careHPV при выявлении CIN II, CIN III и РШМ, по сравнению с традиционным цитологическим исследованием, что отражает целесообразность применения данного метода в скрининге РШМ, особенно на удаленных территориях Российской Федерации.



