Беременность как физиологическое явление – сложный феномен, сопровождающийся формированием особых механизмов равновесия всех реакций жизнедеятельности. Беременность, роды, послеродовой период связаны со многими гемостазиологическими осложнениями, а также заболеваемостью и смертностью у матери и плода [1, 2]. Беременность сама по себе ассоциируется с прогрессирующей во времени тромбогенностью, формируемой организмом матери для снижения кровопотери в родах [3, 4], что непосредственно связано с гормональными изменениями, приводящими к повышению риска артериальных и венозных тромбозов. Данные обстоятельства подчеркивают необходимость динамического исследования системы гемостаза в различные сроки беременности.
Имеется ряд сообщений, касающихся нормативных значений тех или иных показателей системы гемостаза при физиологически протекающей беременности [5–10]. Тем не менее, работ, посвященных комплексной оценке «глобальных» параметров сосудисто-тромбоцитарного звена гемостаза – тромбоцитов, фактора Виллебранда (ФВ) и контролирующего его фермента – металлопротеиназы ADAMTS-13 во время физиологически протекающей беременности мало. Мы полагаем, что продолжение работ в этой области имеет большое значение не только для «вооружения» клинической практики нормативными данными для формирования групп риска по кровотечениям и тромбозам, но позволит описать ранее неизвестные особенности уникального гемостатического баланса на протяжении беременности.
Материалы и методы
 В рамках проспективного исследования были получены данные о 301 женщине, обследованной в женских консультациях и родильном доме № 2 г. Барнаула в период с 2011 по 2012 г. Исследования выполнялись в лаборатории патологии гемостаза КГБУЗ Краевая клиническая больница (г. Барнаул) при участии сотрудников Алтайского филиала ФГБУ Гематологический научный центр Минздрава России и лаборатории ООО «Инвитро-Сибирь», г. Новосибирск. Представленное исследование было одобрено Региональным этическим комитетом Алтайского государственного медицинского университета и все участники дали свое информированное согласие.
В рамках проспективного исследования были получены данные о 301 женщине, обследованной в женских консультациях и родильном доме № 2 г. Барнаула в период с 2011 по 2012 г. Исследования выполнялись в лаборатории патологии гемостаза КГБУЗ Краевая клиническая больница (г. Барнаул) при участии сотрудников Алтайского филиала ФГБУ Гематологический научный центр Минздрава России и лаборатории ООО «Инвитро-Сибирь», г. Новосибирск. Представленное исследование было одобрено Региональным этическим комитетом Алтайского государственного медицинского университета и все участники дали свое информированное согласие.
С учетом результатов клинического и лабораторного обследования проводилась консультация акушером-гинекологом, терапевтом и гематологом, после чего решался вопрос о включении женщины на том или ином сроке беременности в настоящее исследование. Учитывались данные у перво- и повторнобеременных в возрасте от 18 до 35 лет.
Критерии исключения: возраст старше 35 лет; отягощенный акушерский и гинекологический анамнез; осложненное течение настоящей беременности; отягощенный личный геморрагический или тромботический анамнез; прием комбинированных оральных контрацептивов в течение 3 последних месяцев до наступления настоящей беременности; вспомогательные репродуктивные технологии в анамнезе или при настоящей беременности; оперативное родоразрешение в анамнезе или при настоящей беременности; наличие экстрагенитальной патологии, в том числе сахарного диабета, бронхиальной астмы, эндокринной патологии, наличие клинических проявлений мезенхимальной дисплазии, протезы клапана сердца и сосудов, острый пиелонефрит, цистит или обострение их хронического течения, злокачественные новообразования, носительство вируса иммунодефицита человека, вирусного гепатита B и/или С; прием лекарственных препаратов во время настоящей беременности, влияющих на систему гемостаза (антиагреганты, нестероидные противовоспалительные препараты, антикоагулянты); отклонения в результатах лабораторного обследования: уровень гомоцистеина в сыворотке крови (до беременности) свыше 15 мкМ, гемоглобин выше 140 г/л вне беременности и выше 135 г/л во время беременности, количество тромбоцитов в крови ниже 150 или выше 450×109/л, количество лейкоцитов в крови более 12×109/л; носительство мутаций F5 Лейден (1691G>A) и/или FII (20210G>A), а также редкой гомозиготы MTHFR (677C>T), антифосфолипидный синдром и другие аутоиммунные состояния.
Отобраны следующие контрольные точки для исследования системы гемостаза, учитывающие волны инвазии трофобласта и отражающие «критические» сроки беременности: предгравидарный период, 6–8 недель, 12–13 недель, 22–24 недели, 34–36 недель и 2–3-е сутки после родоразрешения (таблица).
Исследования в предгравидарном периоде проводились преимущественно у первобеременных (81,5%).
Техника лабораторного обследования. Взятие венозной крови осуществлялось из локтевой вены в пробирки VACUETTE с буферным раствором цитрата натрия в соотношении 9:1 (9NC Coagulation sodium citrate 3,2%). Кровь центрифугировали при 1400 g в течение 15 мин при комнатной температуре. Для исследования агрегационной активности тромбоцитов плазма, обогащенная тромбоцитами, получалась путем центрифугирования отдельной порции цитратной крови при 160 g в течение 7 мин. Перед проведением иммуноферментных анализов плазму хранили при температуре –40оС от одних суток до одного месяца.
Агрегация тромбоцитов оценивалась в обогащенной тромбоцитами плазме крови с использованием реагента ADP (Helena Bioscience) на агрегометре Chronolog 490-D (CHRONO-LOG Corporation). Активность ФВ определялась в плазме крови по ристоцетин-кофакторной активности с реагентами Ristocetin Cofactor Kit (Helena Bioscience) на агрегометре AggRAM (Helena Laboratories). Количественное содержание ФВ изучалось с помощью реагентов vWF Ag (Siemens) на автоматическом коагулометре Sysmex CA-1500 (Sysmex Corporation). Активность металлопротеиназы ADAMTS-13 изучали с помощью тест-системы ELISA, TECHNOZYM ADAMTS-13 Activity ELISA (Technoclone GmbH), а антиген ADAMTS-13 – на основе применения тест-системы TECHNOZYM ADAMTS-13 Antigen того же производителя на фотометре Bio-Rad 680 (Bio-Rad Laboratories).
Статистическая обработка полученных данных осуществлена с использованием программ Microsoft Offise Excel 2003, Statistica 6.1 и Medcalc 12.2.1. Использовался непараметрический критерий Манна–Уитни для двух независимых групп, а также ранговый коэффициент корреляции Спирмена. Статистически значимыми принимались различия P<0,05. Для показателей каждого теста были рассчитаны референтные интервалы (2,5‰ – 97,5‰).
Результаты исследования
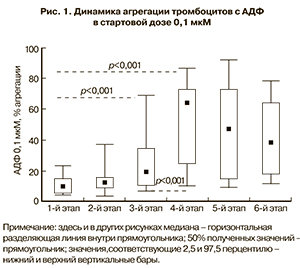
Первоначально были оценены особенности агрегации тромбоцитов в ответ на «малую» стартовую дозу динатриевой соли аденозиндифосфата (АДФ) – 0,1 мкМ, реагирующей с рецептором P2Y1 и P2Y12 тромбоцитов (рис. 1).
Определено, что уровень агрегации тромбоцитов при таком варианте оценки их функции у женщин вне беременности находится в достаточно широком диапазоне (от 4 до 30%) и значительно ниже, чем ответ у практически здоровых людей на использование рекомендованной в международных протоколах «высокой» стартовой дозы АДФ – 2,5 мкМ (обычно от 70 до 80%) [11, 12].
Повышение чувствительности тромбоцитов к АДФ в дозе 0,1 мкМ проявляло себя уже с ранних сроков беременности, а медиана максимального значения агрегации увеличивалась в 1,3–6,4 раза (в сравнении с данными у небеременных женщин), достигая максимума на 4-м этапе обследования (22–24-я неделя).
Интересно, что агрегация тромбоцитов с АДФ в стартовой дозе 2,0 мкМ у обследованных нами женщин вне беременности составляла 61,0–86% (в интервале 2,5‰ – 97,5‰) и не менялась на разных сроках гестации (54,0–89,2%), что показывает низкую чувствительность и информативность подобных исследований.
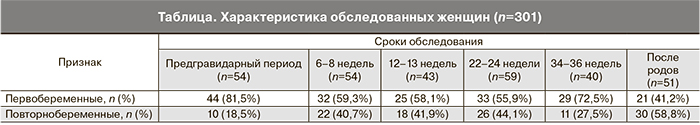
Далее была оценена функциональная активность ФВ в различные сроки физиологически протекающей беременности. С этой целью измерялись значения ристоцетин-кофакторной активности, которая, как известно, характеризует потенциал ФВ, оцениваемый по агрегации с ристоцетином донорских тромбоцитов, помещенных в плазму пациента. Эта активность у женщин вне беременности находилась в пределах от 53,8 до 152,3% (рис. 2).
Ристоцетин-кофакторная активность ФВ возрастала по мере прогрессирования беременности, начиная с 12–13-й недели и увеличиваясь по медиане от исходных значений в 1,19 (P<0,008) на 22–24-й и 1,42 раза (P<0,001) на 34–36-й неделе гестации, оставаясь высокой в первые сутки после родоразрешения (P<0,001).
Определена корреляционная связь между ристоцетин-кофакторной активностью ФВ и агрегацией тромбоцитов с АДФ в «малой» дозе (r=0,21; Р=0,02).
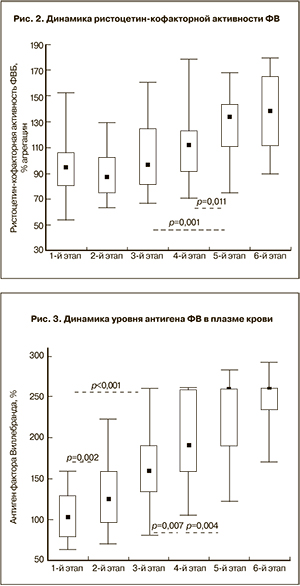
Помимо активности ФВ в тех же образцах плазмы крови был исследован уровень антигена ФВ (рис. 3). Установлено динамичное повышение концентрации этого белка во время беременности – от исходного уровня на 20,6, 55,9, 86,3 и 154,9% (по медиане) соответственно на 2-м, 3-м, 4-м и 5-м этапах обследования. Максимальные значения этого показателя были зафиксированы на 2–3-е сутки после родоразрешения, с верхним пределом допустимых значений на уровне 291%.
Коэффициент корреляции между антигеном и активностью ФВ в плазме крови беременных женщин до и после родоразрешения составил 0,43 (Р<0,001).
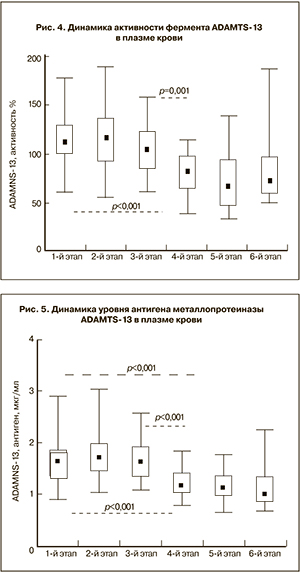
 Также был проведен анализ динамики как активности, так и содержания металлопротеиназы ADAMTS-13 в плазме крови (рис. 4 и 5).
Также был проведен анализ динамики как активности, так и содержания металлопротеиназы ADAMTS-13 в плазме крови (рис. 4 и 5).
Диапазон допустимых значений активности этого фермента у женщин вне беременности и после родов составляет 50–142%, а его антигена 0,89 до 2,88 мкг/мл [17].
Полученные результаты указывают на достаточно стабильный уровень активности и антигена металлопротеиназы ADAMTS-13 в интервале с 6-й по 13-ю неделю беременности, сравнимый по величине с показателями, установленными у небеременных женщин.
В последующем, начиная с 22-й недели и до поздних сроков гестации, наблюдалось заметное снижение уровня данного фермента – по активности на 26,4–39,2% и по антигену на 28,7–31,7%, по сравнению с данными вне беременности. Кроме того, в ближайшие дни после родоразрешения активность и антиген фермента ADAMTS-13 оставались также сниженными, хотя у части женщин и имелась наклонность к увеличению их значений.
Установлена положительная корреляционная связь между антигеном и активностью металлопротеиназы ADAMTS-13 в плазме крови (r=0,41; Р<0,001).
Обсуждение
В доступных литературных источниках нам встретилась лишь одна обстоятельная работа аргентинских исследователей [20], посвященная изучению активности фермента ADAMTS-13 в сопоставлении с антигеном ФВ в плазме крови при физиологически протекающей беременности, опирающаяся на более ранние исследования Mannucci и соавт. [21]. Согласно этой работе, учитывающей наблюдения у 325 женщин в возрасте от 14 до 41 года, снижение активности фермента ADAMTS-13 было зафиксировано в среднем до 65% нормы (в 17–23 недели), 61% (в 24–28 недель), 65% (в 29–35 недель), 58% (в 36–40 недель) и 52% (в первые двое суток после родоразрешения). Кроме того, в ней была определена зависимость между повышением антигена ФВ во время беременности и снижением количества фермента ADAMTS-13 (коэффициент корреляции Пирсона –0,22, Р=0,0003).
Выявленное нами нарастание ристоцетин-кофакторной активности ФВ соответствуют результатам, приведенным Y. Stirling и соавт. [12], по итогам обследования 239 женщин, где ристоцетин-кофакторная активность ФВ увеличивалась, начиная с 16-й недели физиологически протекающей беременности, и достигала наибольшего значения в 36–40 недель (составляя в среднем 179%, с интервалом ±2s от 62 до 296%). В работе Н.Г. Беловой и соавт. [13] показано, что раннее начало преэклампсии (в 25–28 недель беременности) сопровождается увеличением ристоцетин-кофакторной активности ФВ в 1,78 раза (P<0,05).
Обращает на себя внимание, что в справочной таблице, опубликованной M. Abbassi-Ghanavati и соавт. [6], основанной на обзоре электронных баз данных с помощью PUBMED и MEDLINE (70 источников – с 1975 по 2008 г.) и предназначенной для интерпретации лабораторных исследований при физиологически протекающей беременности, приводятся лишь отрывочные данные о содержании ФВ в плазме крови (75–125% – вне беременности и 121–260% – в третьем триместре, 2,5‰ – 97,5‰). Более подробные данные в этом направлении имеются в ряде других работ [9, 13, 15], материалы которых в целом не противоречат полученным в настоящей работе результатам.
 Предполагается, что повышение уровня ФВ при беременности связано с гиперэстрогенемией и активацией его синтеза эндотелием кровеносных сосудов [9, 16]. ФВ, как известно, представляет собой сложный мультимерный адгезивный гликопротеин (в мономерной форме 280 кДа), синтезируемый эндотелиальными клетками и мегакариоцитами [17]. Особая роль этого фактора в системе гемостаза определяется его структурой в виде серии неоднородных по размеру (от 0,5 до 20 млн Да) мультимеров, состоящих из многократно повторяющихся субъединиц, в которых имеются домены связывания с гликопротеиновыми рецепторами тромбоцитов (GPIb и IIb/IIIa), коллагеном, гепарином и VIII фактором свертывания крови. Он опосредует адгезию тромбоцитов к субэндотелию через взаимодействие с рецептором тромбоцитов – гликопротеином Ib [18]. Крупные мультимеры ФВ расщепляются металлопротеиназой ADAMTS-13 в процессе их секреции из эндотелиальных клеток под влиянием провоспалительных цитокинов [16]. Необычно большие мультимеры ФВ при низкой активности этого фермента инициируют активацию тромбоцитов и способны привести к тотальной тромбоцитопении и множественному образованию гиалиновых (тромбоцитарных) тромбов в микрососудах при тромботической тромбоцитопенической пурпуре – ТТП [17, 19].
Предполагается, что повышение уровня ФВ при беременности связано с гиперэстрогенемией и активацией его синтеза эндотелием кровеносных сосудов [9, 16]. ФВ, как известно, представляет собой сложный мультимерный адгезивный гликопротеин (в мономерной форме 280 кДа), синтезируемый эндотелиальными клетками и мегакариоцитами [17]. Особая роль этого фактора в системе гемостаза определяется его структурой в виде серии неоднородных по размеру (от 0,5 до 20 млн Да) мультимеров, состоящих из многократно повторяющихся субъединиц, в которых имеются домены связывания с гликопротеиновыми рецепторами тромбоцитов (GPIb и IIb/IIIa), коллагеном, гепарином и VIII фактором свертывания крови. Он опосредует адгезию тромбоцитов к субэндотелию через взаимодействие с рецептором тромбоцитов – гликопротеином Ib [18]. Крупные мультимеры ФВ расщепляются металлопротеиназой ADAMTS-13 в процессе их секреции из эндотелиальных клеток под влиянием провоспалительных цитокинов [16]. Необычно большие мультимеры ФВ при низкой активности этого фермента инициируют активацию тромбоцитов и способны привести к тотальной тромбоцитопении и множественному образованию гиалиновых (тромбоцитарных) тромбов в микрососудах при тромботической тромбоцитопенической пурпуре – ТТП [17, 19].
Такая ситуация может возникнуть при наследственном дефиците секреции ADAMTS-13 или его сниженной активности, вызванной генными мутациями, или вследствие приобретенных дефектов активности ADAMTS-13, обусловленных аутоантителами [17].
Можно констатировать, что активность ФВ во время беременности находится в обратной связи с функциональной активностью металлопротеиназы ADAMTS-13, выделяемой эндотелием кровеносных сосудов и расщепляющей ФВ. В наших исследованиях у женщин во время физиологически протекающей беременности и сразу после родов коэффициент корреляции между активностью ФВ и активностью фермента ADAMTS-13 составил –0,27 (P<0,001), а между антигенами ФВ и металлопротеиназы ADAMTS-13 был равен –0,32 (P<0,001).
Неспособность деградировать крупные мультимеры ФВ связывается с наследственными и идиопатическими типами ТТП либо предрасполагает к сходным нарушениям [22, 23]. ТТП чаще встречается у женщин (66–78%), причем 12–25% эпизодов этой патологии связывается с беременностью [24], прежде всего в III триместре и в послеродовом периоде [25, 26]. Представляет интерес в этом отношении работа A. Lattuada и соавт. [27], описывающая снижение активности фермента ADAMTS-13 у пациенток с HELLP-синдромом (в среднем до 31%, с вариацией от 12 до 43%) в сравнении с женщинами в III триместре физиологически протекающей беременности (в среднем 71%, с вариацией 48–105%) и небеременными женщинами (по средним данным – 101%, с вариацией 45–152%). Активность фермента ADAMTS-13 часто опускается ниже предельного уровня при антифосфолипидном синдроме [28] септических состояниях и злокачественных новообразованиях [29, 30], обменных нарушениях, а также у новорожденных [21].
В целом, значимым для беременности является не столько повышение уровня ФВ, сколько снижение активности и антигена фермента ADAMTS-13, потенциально способствующее увеличению мультимерности этого фактора и повышающего активацию тромбоцитов по мере приближения к срокам родоразрешения.
Заключение
Таким образом, в нашем исследовании установлены референтные значения результатов измерений ФВ и фермента ADAMTS-13 и агрегационной активности тромбоцитов на разных сроках беременности. Продемонстрировано прогрессирующее во времени физиологически протекающей беременности увеличение активности и содержания ФВ на фоне снижения активности и уровня металлопротеиназы ADAMTS-13 начиная с 12–13-й недели гестации. Этот факт может иметь важное значение для учета вероятности развития тромботических событий, связанных с избыточной активацией тромбоцитов на фоне низкой активности ADAMTS-13, и предполагает дальнейшие исследования в этом направлении.



