Врожденная дисфункция коры надпочечников (ВДКН) представляет собой группу заболеваний, передающихся по аутосомно-рецессивному типу, в основе которых лежит дефект ферментов стероидогенеза. В свою очередь, данный дефект способствует нарушению продукции кортизола [1]. В большинстве случаев развитие патологии обусловлено мутациями гена СYP21, который кодирует фермент 21-гидроксилазу [1–3]. В настоящее время частота встречаемости только классических форм дефицита 21-гидроксилазы, рассчитанная на основании данных неонатального скрининга в мире, составляет 1 случай на 14 199 живорожденных (от 1 на 10 000 до 1 на 18 000 новорожденных). Так как все формы ВДКН являются аутосомно-рецессивными заболеваниями, оба пола страдают с одинаковой частотой [2, 4].
Актуальность изучения данной проблемы обусловлена, прежде всего, тем, что в детском возрасте большая часть пациентов, имеющих классические формы ВДКН, находится под регулярным наблюдением детских эндокринологов для постоянного контроля гормонального профиля, отслеживания темпов роста и полового развития. Успех лечения пациентов в детском возрасте во многом определяется комплаентностью родителей. После достижения совершеннолетия данная когорта пациентов нередко перестает наблюдаться специалистами, и заболевание переходит в стадию декомпенсации.
Рассматриваемое клиническое наблюдение сольтеряющей формы ВДКН свидетельствует о необходимости тщательного динамического наблюдения за взрослыми пациентами с данным заболеванием и решения проблем, которые явились следствием «родительской воли».
Клиническое наблюдение
Пациентка N., 1995 г.р., поступила в Отделение терапевтической эндокринологии ФГБУ «НМИЦ эндокринологии» МЗ РФ (Москва) с жалобами на слабость, утомляемость, огрубение голоса в течение последних трех лет, отсутствие менструаций, потемнение кожных покровов, избыточное оволосение.
С рождения наблюдалась в НИИ Детской эндокринологии ФГБУ «НМИЦ эндокринологии» МЗ РФ с диагнозом: ВДКН, сольтеряющая форма.
Диагноз был установлен с первого месяца жизни на основании: неправильно сформированных наружных половых органов при рождении (гипертрофия клитора III–IV ст. по Прадеру), развившегося на 2-е сутки жизни сольтеряющего криза (неукротимая рвота, жидкий стул, потеря массы тела, в анализе крови гиперкалиемия (6,1 ммоль/л), гипонатриемия (120 ммоль/л)), высокого уровня 17-ОН-прогестерона. Также отмечалась умеренно выраженная гиперпигментация наружных половых органов. В роддоме назначена терапия глюкокортикоидами (преднизолоном); на фоне данного лечения состояние улучшилось.
У пациентки есть родной брат с таким же заболеванием.
Регулярно, до 20 лет получала заместительную гормональную терапию (глюкокортикоиды и минералокортикоиды). По решению родителей феминизирующая пластика наружных половых органов в детском и подростковом возрасте пациентке не проводилась. Наблюдалась эндокринологом по месту жительства и в ФГБУ «НМИЦ эндокринологии». Последняя госпитализация в НИИ Детской эндокринологии в 2013 г. (17 лет). В лабораторных анализах: 17-ОН-прогестерон – 73 нмоль/л, тестостерон – 1,5 нмоль/л, АКТГ, ДГЭА-С – в пределах нормы. При ультразвуковом исследовании органов малого таза: гипоплазия матки, размеры матки соответствуют возрасту 10–11 лет, увеличение размеров яичников, мелкокистозные изменения. Гинекологом было рекомендовано проведение феминизирующей пластики наружных гениталий после достижения компенсации основного заболевания. В связи с первичной аменореей, помимо терапии глюкокортикоидами (преднизолон 10 мг в сутки), минералокортикоидами (флудрокортизон 0,075 мг в сутки), рекомендован прием комбинированных оральных контрацептивов (КОК) (дидрогестрон/эстрадиол 2/10). Рекомендованную терапию КОК пациентка не принимала в связи с выраженным (с ее слов) набором веса.
В дальнейшем пациентка наблюдалась у специалистов в частной клинике. При проведении магнитно-резонансной томографии (МРТ) органов малого таза в феврале 2017 г. выявлена ткань предстательной железы. Специалистом частной клиники изменен диагноз пациентки на нарушение формирования пола и рекомендовано отменить заместительную терапию глюко- и минералокортикоидами, что и было сделано. В 2017 г. в частной клинике проведена лабиопластика, ушивание клитора в кожную складку промежности. Швы в последующем разошлись, и складка расформировалась.
В марте 2018 г. пациентка обратилась в КДО ФГБУ «НМИЦ эндокринологии» МЗ РФ. После консультации было рекомендовано проведение генетического анализа на выявление мутаций в гене CYP21 гидроксилазы, исследование гормонального профиля: 17-ОН-прогестерона, ренина, тестостерона, ДГЭА-С, ТТГ. По результатам генетического анализа: методом полимеразной цепной реакции выявлена гомозиготная делеция гена CYP21A2.
Таким образом, диагноз ВДКН не вызывал сомнений.
На момент поступления в отделение терапевтической эндокринологии лекарственную терапию не принимала в течение 2 лет.
Объективно при поступлении.
Общее состояние относительно удовлетворительное. Телосложение правильное, с чертами маскулинизации. Вес 66 кг. Рост 153 см. Индекс массы тела 28,2 кг/м². Кожные покровы смуглые, пигментные пятна на коже, бледные стрии на бедрах, избыточное оволосение на бедрах, по белой линии живота (эпилирована), гирсутное число 8. Молочные железы несколько гипопластичные, сформированы асимметрично (s<d). Сосково-ареолярный комплекс гиперпигментирован, несколько уплощен. Выделений из сосков нет. Пульс 72 в минуту, артериальное давление 119/73 мм рт. ст.
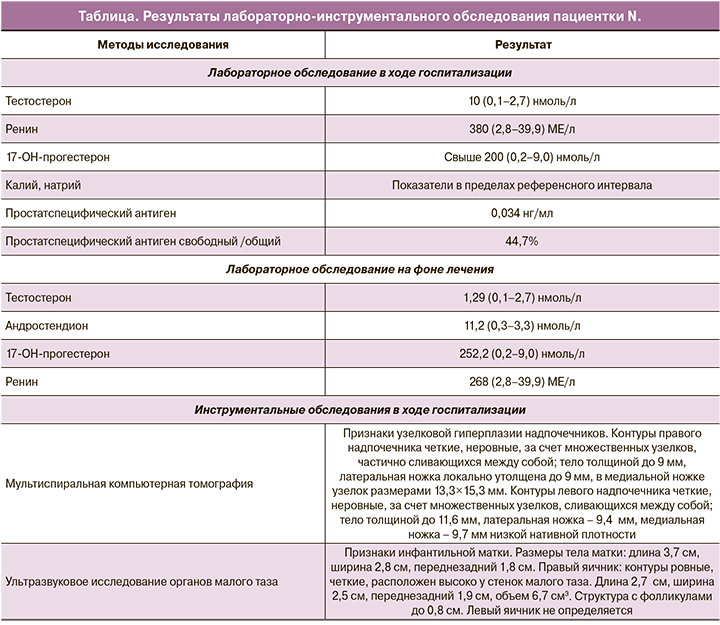
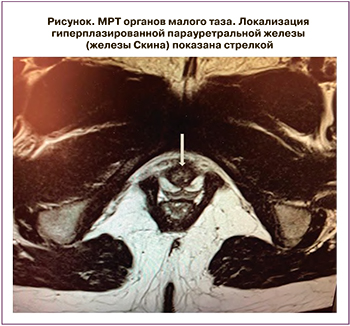 Результаты лабораторных и инструментальных обследований представлены в таблице 1. Обращало на себя внимание выраженное повышение уровней андрогенов и ренина вне приема терапии глюко- и минералокортикоидами. По результатам МРТ органов малого таза, выполненного в ходе госпитализации: признаки гипоплазии матки. Яичники: справа 2,3×1,4 см, в структуре множественные фолликулы диаметром до 9 мм; слева 2,4×2,0 см, в структуре множественные фолликулы диаметром до 8 мм. Дополнительно была верифицирована мягкотканная структура под мочевым пузырем округлой формы, неоднородной структуры, с четкими контурами, муфтообразно охватывающая проксимальные отделы уретры, размерами 2,0×1,7×2,0 см – рудиментарная ткань предстательной железы (рисунок).
Результаты лабораторных и инструментальных обследований представлены в таблице 1. Обращало на себя внимание выраженное повышение уровней андрогенов и ренина вне приема терапии глюко- и минералокортикоидами. По результатам МРТ органов малого таза, выполненного в ходе госпитализации: признаки гипоплазии матки. Яичники: справа 2,3×1,4 см, в структуре множественные фолликулы диаметром до 9 мм; слева 2,4×2,0 см, в структуре множественные фолликулы диаметром до 8 мм. Дополнительно была верифицирована мягкотканная структура под мочевым пузырем округлой формы, неоднородной структуры, с четкими контурами, муфтообразно охватывающая проксимальные отделы уретры, размерами 2,0×1,7×2,0 см – рудиментарная ткань предстательной железы (рисунок).
Осмотр гинеколога: наружные половые органы сформированы неправильно. Клитор-пенис, степень вирилизации – IV–V по Прадеру. Длина клитора-пениса от корня – 7–7,5 см, с хорошо сформированной головкой, не эрегирован, при пальпации не напряжен. Под головкой клитора открываются 2 устья периуретральных желез. Входы во влагалище и уретру отдельно не дифференцируются. Высокий урогенитальный синус. Вход во влагалище свободно проходим для маточного зонда. Длина влагалища по зонду – 9,5 см. Мочевой пузырь опорожнен, попытка визуализировать вход в уретру при акте мочеиспускания не удалась. Рекомендовано после достижения компенсации заболевания – проведение реконструктивно-пластической операции на наружных половых органах в объеме: клиторопластика, рассечение урогенитального синуса, интроитопластика. До проведения оперативного лечения – цистоуретровагиноскопия с целью определения топики уретры.
На основании жалоб, анамнеза жизни, объективного статуса и данных лабораторно-инструментальных методов исследования выставлен диагноз: ВДКН, сольтеряющая форма, ст. декомпенсации; аменорея II; рудиментарная ткань предстательной железы (по данным МРТ малого таза); избыточная масса тела.
В отделении у пациентки N. с декомпенсацией ВДКН вновь инициирована терапия глюко- и минералокортикоидами: дексаметазон 0,5 мг в 23 ч, гидрокортизон 15 мг в сутки (10 мг после завтрака, 5 мг в обед), флудрокортизон 0,05 мг утром. На фоне возобновленной минерало- и глюкокортикоидной терапии (с мая 2018 г.) наступило менархе, прибавка в весе около 9 кг. Менструации по 2–3 дня через 25 дней, крайне скудные, безболезненные. В связи с целевыми уровнями андрогенов на фоне изолированного повышения 17-ОН-прогестерона (таблица), выраженной прибавкой в весе рекомендовано снизить суточную дозу глюкокортикостероидов: гидрокортизона – до 15 мг в сутки (10 мг после завтрака, 5 мг после обеда), дексаметазона – до 0,25 мг в сутки, доза флудрокортизона, учитывая уровень ренина, увеличена до 0,1 мг в сутки.
По поводу выявленной при МРТ рудиментарной ткани предстательной железы, учитывая референсный уровень простатспецифического антигена, рекомендовано динамическое наблюдение, показаний к оперативному лечению не выявлено.
В последующем, через 7 месяцев (в декабре 2018 г.), пациентка была госпитализирована в отделение оперативной гинекологии ФГБУ «НМИЦ эндокринологии» МЗ РФ, где была выполнена цистоуретровагиноскопия. Протокол операции: под внутривенной анестезией осмотрена область промежности. Вирилизация наружных гениталий IV–V степени по Прадеру. Гипертрофированный клитор 9,0 см. В половую щель раздельно открывается уретра и влагалище. Задняя спайка несколько перемещена кпереди, создавая видимость общего мочеполового канала. На цистоскопии слизистая мочевого пузыря гладкая, устья расположены типично, сомкнуты, в области левого устья определяется гипертрофия слизистой 0,7 см. При осмотре уретры определяется продольная складчатость слизистой, семенной бугорок отсутствует. Вход во влагалище сужен, окружен складками слизистой (гименальное кольцо). Влагалище с циркулярной складчатостью, в просвете бели.
Постманипуляционный период протекал без осложнений. В дополнительном введении глюкокортикоидов не нуждалась.
Данная процедура позволила выяснить топические и анатомические особенности урогенитального тракта. В дальнейшем пациентке рекомендуется проведение реконструктивно-пластической операции в ранее описанном объеме: клиторопластика, рассечение урогенитального синуса, интроитопластика.
Обсуждение
Основным методом в лечении классической формы ВДКН, связанной с дефицитом 21-гидроксилазы, является пожизненная заместительная терапия глюкокортикоидами и, в случае сольтеряющей формы ВДКН, необходимо добавление минералокортикоидов.
Основными показателями эффективности применения глюкокортикоидной терапии являются комплексная оценка уровней 17-ОН-прогестерона, тестостерона и андростендиона [5]. Многие исследователи считают, что при полном подавлении уровня 17-ОН-прогестерона могут возникать побочные эффекты глюкокортикоидной терапии, поэтому необходимо следить за тем, чтобы уровни андростендиона и тестостерона находились в пределах референсных значений для пола и соответствующего возраста пациентов.
Существует физиологический циркадный ритм секреции гормонов гипофиза и коры надпочечников: концентрация АКТГ, кортизола и всех его предшественников низкая ночью, увеличиваясь к 2.00 ч ночи с пиком секреции в 8.00 ч. В течение дня отмечается их некоторое снижение [1, 3, 6]. По мнению большинства исследователей, очень сложно подобрать такой режим глюкокортикоидной терапии, который будет способен полностью имитировать нормальный ритм секреции кортизола.
В данном случае для быстрой коррекции длительной гиперандрогении рекомендован прием глюкокортикоидов короткого и пролонгированного действия. В последующем пациентке может быть рекомендован перевод на глюкокортикоиды пролонгированного действия для удобства применения (двукратный прием 5–7,5 мг преднизолона). Учитывая необходимость пожизненной глюкокортикоидной терапии при ВДКН, необходимо иметь в виду возможности развития передозировки данными препаратами с развитием ятрогенного гиперкортицизма и ассоциированных с ним осложнений. В связи с этим, контроль необходимых показателей и динамическое наблюдение у специалистов является залогом высокого качества и большей продолжительности жизни [1].
В качестве минералокортикоидной терапии (в случае сольтеряющей формы заболевания) обычно применяют флудрокортизон в дозе 0,05–0,15 мг в сутки (1–2 раза в день), которая способна поддерживать уровень активности ренина плазмы на верхней границе нормы или слегка выше (до 2 раз) [1, 6]. У детей грудного возраста потребность в минералокортикоидах выше и может достигать 0,3 мг в сутки; в более старшем возрасте потребность в минералкортикоидах уже не столь высока. Флудрокортизон назначен пациентке N. в средней терапевтической дозе 0,05 мг, затем 0,1 мг в сутки.
В случае нашей пациентки ошибочная трактовка диагноза специалистом частной клиники и отмена заместительной терапии привела к декомпенсации заболевания и могла закончиться фатально, развитием аддисонического криза.
Наряду с консервативной терапией девочкам с классическими формами ВДКН проводится хирургическая коррекция наружных гениталий [7]. У девочек с высокой степенью вирилизации (по Прадеру ≥ 3) клиторальную и промежностную реконструкции рекомендуется проводить в младенчестве (традиционный подход) и выполнять опытным хирургом. Решение об операции принимается консилиумом специалистов (детский хирург, уролог, детский эндокринолог, генетик, психиатр) после обсуждения проблемы с членами семьи. Нет рандомизированных контролируемых исследований, которые бы рекомендовали лучший возраст или лучшие методы феминизирующих операций.
К сожалению, в рассматриваемом примере родителями пациентки было принято решение об отказе от оперативного вмешательства на наружных половых органах. Во взрослом возрасте пациентка не только не могла жить половой жизнью, но и испытывала огромный психологический стресс в течение всей жизни из-за неправильного строения наружных половых органов. Безграмотность хирурга частной клиники привела к неоправданному хирургическому вмешательству (лабиопластика и ушивание клитора в кожную складку промежности, которая со временем расформировалась из-за расхождения швов).
Отдельного обсуждения требует обнаружение у пациентки рудиментарной парауретральной железы (или железы Скина), и дальнейшая лечебная тактика. Парауретральная железа является рудиментарным органом, гомологичным предстательной железе у мужчин и, как показано в ряде публикаций, на фоне избытка андрогенов может развиваться в ткань, гистологически идентичную мужской простате [8, 9]. Несмотря на очевидную взаимосвязь между гиперандрогенией, обусловленной адреногенитальным синдромом, и пролиферативной активностью парауретральных железистых клеток, в настоящий момент пока не изучены ключевые причины развития ее гиперплазии: на каких сроках эмбриогенеза происходит начало гиперпластических процессов, каков критический уровень андрогенов для этого, есть ли взаимосвязь с видом мутации при ВДКН [10].
Случаи, демонстрирующие наличие ткани простаты у пациенток, в том числе с адреногенитальным синдромом, крайне редки. В мировой медицинской литературе опубликовано лишь несколько статей, документирующих развитие ткани предстательной железы у пациенток с ВДКН [10–19].
В одном из вышеприведенных исследований показано, что, согласно данным МРТ, у 5 из 32 пациенток (15,6%) с классическими формами дефицита 21-гидроксилазы выявлена ткань предстательной железы. Необходимо отметить, что у всех этих женщин уровень простатспецифического антигена был выше 0,1 нг/мл [16].
К сожалению, всегда есть онкологическая настороженность при выявлении рудиментарной простатической ткани у женщин, так как андрогены выполняют роль триггера диспластических процессов. Контроль уровня простатспецифического антигена может быть полезен у данной группы пациенток [8, 20–23].
Описываемое в настоящей статье клиническое наблюдение является еще одной демонстрацией столь редкого феномена развития простатоподобных клеток у пациентки с кариотипом 46, ХХ. В данном случае парауретральную железу решено было не оперировать из-за особенности топического расположения, а также из-за относительно нормального уровня простатспецифического антигена, как показателя степени гиперплазии.
Несмотря на то, что в литературе не удалось найти описания случая редуцирования парауретральной гиперплазированной железы на фоне интенсификации заместительной терапии глюкокортикоидами, и достижения компенсации ВДКН, высоковероятно, что при достижении целевых уровней андрогенов пролиферативные процессы в парауретральной железе могут замедлиться.
Заключение
В представленном клиническом наблюдении описаны практически все трудности, с которыми сталкиваются детские эндокринологи (несоблюдение рекомендаций родителями больных детей) и взрослые специалисты: решение вопросов заместительной терапии, направление пациенток на реконструктивные операции на наружных половых органах, которые должны были быть проведены в детском и подростковом возрасте, решение психологических проблем пациенток. Отдельный вопрос – это квалификация специалистов частных клиник и отсутствие государственного контроля за их деятельностью.
Сложность клинической картины заболевания, нарушения стероидогенеза в надпочечниках, требующие пожизненной заместительной терапии, определяют важность динамического наблюдения за взрослыми пациентами с ВДКН и подбора оптимальной схемы терапии, особенно с учетом степени выраженности гормональных изменений, образа жизни и наличия осложнений.
Информированное согласие
Пациентка N. подписала информированное согласие на публикацию своих данных.



