Бесплодие, по данным ВОЗ, занимает пятое место (после алкоголизма, депрессии, травм и нарушений зрения) среди заболеваний у населения в возрасте до 60 лет [1]. Мужской фактор является причиной бесплодного брака практически в 50% случаев [2, 3] как в сочетанном, так и в изолированном виде [4]. В России частота первичного бесплодия составляет от 2 до 3%, вторичного – более 13% в популяции. За последние 20 лет выявляемость мужского бесплодия увеличилась с 30 до 50% бесплодных браков, и по различным прогнозам, к 2019 гг. мужское бесплодие вырастет на 6,6% [5, 6], что отрицательно повлияет на демографическую ситуацию. Непрерывное совершенствование методов вспомогательных репродуктивных технологий (ВРТ) позволило значительно расширить возможности лечения различных форм как женского, так и мужского бесплодия. Так как успех оплодотворения и последующего развития эмбриона зависит от параметров ядерной и цитоплазматической компетентности как женской, так и мужской половой клетки, при проведении программы ЭКО необходим тщательный отбор гамет. С внедрением методики оплодотворения ооцитов методом ИКСИ (интрацитоплазматическая инъекция сперматозоида в ооцит) появилась перспектива решения проблемы мужского бесплодия. Однако визуальная оценка лишь по таким критериям, как морфология и подвижность может допустить отбор единичного сперматозоида, несущего разного рода патологии, что подчеркивает особую важность селекции сперматозоидов для ИКСИ.
Метод селекции сперматозоидов по способности связываться с гиалуроновой кислотой (ГК) – основным компонентом ооцит-кумулюсного комплекса (физиологическая ИКСИ, ПИКСИ) является современной модификацией ИКСИ.
ГК в качестве «физиологического селектора», применима на практике in vitro и может служить для улучшения вклада отцовского генома в развитие эмбриона при искусственном оплодотворении и, таким образом, оказать положительное влияние на клинические исходы при лечении бесплодия.
В ряде крупных исследований отмечена положительная тенденция в отношении качества полученных эмбрионов [7, 8] и частоты наступления беременности. Имеются публикации, которые демонстрируют статистически значимое снижение частоты самопроизвольных абортов после ИКСИ связанными с ГК сперматозоидами в сравнении с теми, что были отобраны лишь посредством визуальной оценки. Данные клинические результаты подтверждают выводы, полученные в проведенных ранее исследованиях биохимических и молекулярных маркеров функциональной зрелости сперматозоидов человека [8].
Кроме того, использование для ИКСИ сперматозоидов, отобранных при помощи ГК, увеличивает показатель частоты имплантаций [7].
Эти результаты свидетельствуют об отсутствии негативных последствий, оказываемых на ооциты-реципиенты и преимплантационный эмбриогенез при использовании ГК для отбора сперматозоидов в циклах ИКСИ. Улучшение качественных характеристик сперматозоидов, способных связываться с ГК, подтверждено рядом исследований. Так, было продемонстрировано отсутствие фрагментации ДНК в ядре сперматозоидов, связавшихся с ГК [9]. Кроме того, была доказана эффективность селекции сперматозоидов, связывающихся с ГК, в снижении частоты анеуплоидий как при олигозооспермии, так и при нормальной концентрации половых клеток. При этом наблюдается существенное уменьшение частоты дисомий и диплоидий хромосом [10].
Благодаря полному отсутствию токсичности ГК, а также возможности снижать частоту возникновения генетических осложнений, применение методики ПИКСИ в качестве альтернативы традиционному ИКСИ позволит существенно улучшить характеристики преимплантационного эмбриогенеза и, в конечном счете, увеличить количество благоприятных исходов ВРТ.
Жизненно важная роль передачи генетически полноценного материала заставила ученых сосредоточиться на исследовании эффективности различных методик селекции мужских половых клеток для оплодотворения in vitro [11–17].
На сегодняшний день в нашей стране определение значимости «физиологической» селекции сперматозоидов в исходах программы ЭКО и отработка показаний к ее использованию представляется актуальным и перспективным.
Цель исследования: определить связь между различными методиками отбора сперматозоидов перед проведением программы ЭКО, эмбриологическими параметрами (процент оплодотворения ооцитов, процент бластуляции) и клиническими исходами в программах ВРТ.
Материал и методы исследования
 На базе отделения вспомогательных технологий в лечении бесплодия и лаборатории цитологии ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России проведено проспективное исследование случай-контроль.
На базе отделения вспомогательных технологий в лечении бесплодия и лаборатории цитологии ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России проведено проспективное исследование случай-контроль.
В процессе лечения были применены различные методики оплодотворения ооцитов (стандартное ЭКО, ИКСИ, ПИКСИ), были оценены эмбриологические параметры (процент оплодотворения ооцитов; процент бластуляции, процент имплантации), клинические исходы в программах ВРТ при использовании различных методик отбора сперматозоидов.
В исследование были включены 196 супружеских пар, соответствовавших следующим критериям: возраст пациентки 18–38 лет, возраст супруга 18–50 лет, женское бесплодие трубного происхождения, регулярный менструальный цикл, мужской фактор бесплодия при отсутствии тяжелой патозооспермии, требующей проведения TESA, MESA, PESA для получения сперматозоидов.
Критериями не включения в исследование были эндокринный фактор бесплодия, эндометриоз III–IV степени распространения, генетические аномалии, пороки развития половых органов, некрозооспермия, необходимость выполнения TESA, MESA, PESA для получения сперматозоидов, необходимость использования донорской спермы и др. Супружеские пары были разделены на 3 группы в зависимости от типа оплодотворения: I группа – 32 пары, которым производилось стандартное ЭКО, II группа – 105 пар, которым производилось оплодотворение методом ИКСИ, III группа – 59 пар, которым производилось оплодотворение ооцитов методом ИКСИ с предварительной селекцией сперматозоидов по способности связываться с ГК (ПИКСИ).
Пациенткам проводилась стимуляция суперовуляции со 2–3-го дня менструального цикла препаратами гонадотропинов по протоколу с антагонистом гонадотропин-рилизинг гормона.
Отбор сперматозоидов для ИКСИ производился по морфологическим параметрам (стандартная ИКСИ) либо согласно способности связываться с ГК (ПИКСИ).
После этого производилась оценка эмбриологических параметров развития (процент оплодотворения ооцитов; процент бластуляции и имплантации эмбрионов). Морфологическая оценка качества эмбрионов была произведена согласно классификации, принятой Istanbul consensus workshop on embryo assessment (ESHRE, 2011) («модифицированная» классификация D. Gardner) [17].
Исследование было одобрено комитетом по этике ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ. Статистическая обработка данных выполнена при помощи пакета прикладных программ SPSS Statistics 22.0. Для оценки значимости межгрупповых различий по данным, имеющим нормальное распределение, применяли однофакторный метод ANOVA для 3 независимых выборок. При непараметрическом распределении данных сравнение между двумя группами проводилось методом Краскала–Уоллиса, в случае наличия достоверных различий использовали метод Манна–Уитни. Достоверность различий по частоте встречаемости качественных признаков определяли по критерию χ2.
Статистически значимыми считались различия при р<0,05. Отношение шансов (ОШ) приведено с 95% доверительным интервалом. Данные с ненормальным распределением представлены в виде медианы в интервале 25–75 процентилей.
Результаты исследования
Анализ возрастных характеристик пациенток, включенных в исследование, не выявил статистически значимых различий. Средний возраст женщин в I группе составил 33 года (30–36 лет); во II – 33 года (29–36 лет); в III – 33 года (29–37 лет).
Однако средний возраст мужчин в I группе составил 33 года (30–36 лет); во II – 35 лет (31–39 лет), в III группе – 36 лет (30–40 лет). Отмечалась явная тенденция к более высоким цифрам среднего возраста супругов в группах, где использовалась методика ИКСИ и ПИКСИ (p=0,65), что обусловлено ухудшением качества половых гамет с возрастом и необходимостью использования дополнительных методик отбора клеток (по критерию χ2=4,914).
Пациентки в исследуемых группах были сопоставимы по параметрам овариального резерва (уровень ФСГ, АМГ и количество антральных фолликулов в раннюю фолликулярную фазу по данным ультразвукового исследования органов малого таза). Не было выявлено статистически значимых различий в частоте встречаемости гинекологических и экстрагенитальных заболеваний между группами. При оценке репродуктивной функции женщин было выявлено, что случаи первичного и вторичного бесплодия встречались с одинаковой частотой в исследуемых группах.
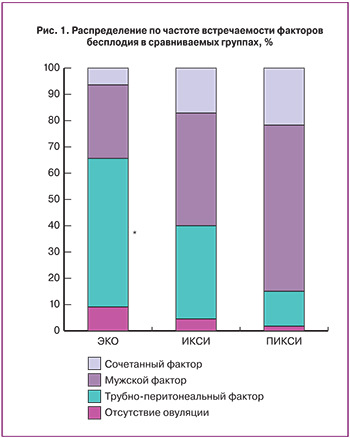
Были выявлены статистически значимые различия в исследуемых группах по фактору бесплодия. Представляются логичными полученные нами данные по преобладанию трубно-перитонеального фактора бесплодия в группе с применением стандартного ЭКО и мужского фактора в группах ПИКСИ и ИКСИ. Также в группе ПИКСИ значимо преобладало количество пациентов с сочетанным фактором бесплодия по сравнению с группой ЭКО (рис. 1), что объясняло выбор методики оплодотворения в данных группах.
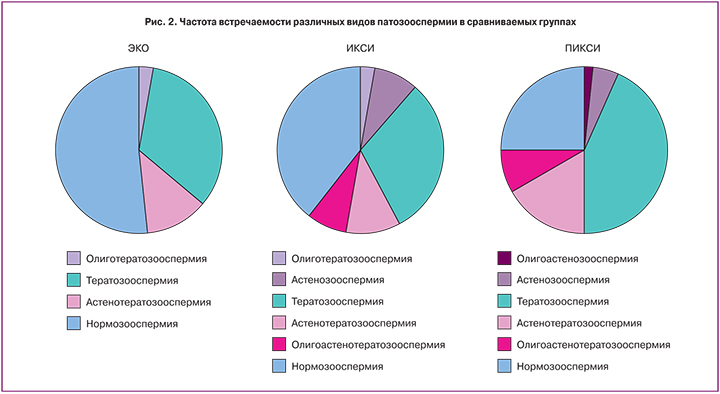
В исследуемых нами группах среди мужчин встречались различные формы патозооспермии (рис. 2).
Согласно полученным нами данным, не было достоверных различий по проценту оплодотворения ооцитов и проценту бластуляции в сравниваемых группах, однако имелись достоверные различия по частоте имплантации между II и III группами (по критерию χ2=6,0; P=0,014). В первой группе процент имплантации составил 40,5%, во второй – 33,1%, в III – 50%, что демонстрирует прямую зависимость качества эмбрионов от генетического вклада мужского генома.
 В результате проведенного нами исследования в исследуемых группах отмечена статистически значимая ассоциация частоты наступления клинической беременности и методики оплодотворения ооцитов пациентки (тест Манна–Уитни, р=0,28). Она выше в группе, где перед проведением процедуры ИКСИ производилась селекция сперматозоидов по способности к связыванию с гиалуронатом. Частота наступления клинической беременности в I группе (стандартное ЭКО) – 40,6% (13 пациенток), во II группе (ИКСИ) – 38,1% (40 пациенток), в III группе, в которой проводилась ПИКСИ – 59,3% (35 пациенток).
В результате проведенного нами исследования в исследуемых группах отмечена статистически значимая ассоциация частоты наступления клинической беременности и методики оплодотворения ооцитов пациентки (тест Манна–Уитни, р=0,28). Она выше в группе, где перед проведением процедуры ИКСИ производилась селекция сперматозоидов по способности к связыванию с гиалуронатом. Частота наступления клинической беременности в I группе (стандартное ЭКО) – 40,6% (13 пациенток), во II группе (ИКСИ) – 38,1% (40 пациенток), в III группе, в которой проводилась ПИКСИ – 59,3% (35 пациенток).
Далее нами проводился анализ частоты неразвивающейся беременности и процента живорождения у супружеских пар после проведения программы ЭКО, ИКСИ и ПИКСИ. В I группе (стандартное ЭКО) доля неразвивающейся беременности составила 7,7%, тогда как в группах ИКСИ и ПИКСИ – 31 и 11% соответственно.
Полученные данные подтверждают принципиальную роль физиологического отбора сперматозоидов при стандартном оплодотворении (ЭКО) и использовании ГК как «селектора» гамет (ПИКСИ).
Проводился анализ по частоте живорождения на количество наступивших беременностей и частоте живорождения на перенос 1 эмбриона в полость матки в программе ВРТ. Данные представлены на рис. 3. Обнаружены значимые различия по проценту живорождения на количество наступивших беременностей после проведения программ ВРТ в пользу I группы с использованием стандартного ЭКО и III группы с применением методики «физиологический» селекции мужских гамет для ИКСИ по сравнению со II группой, где проводилась ИКСИ (рис. 3). Однако следует принимать во внимание, что в I группе значительно преобладал трубно-перитонеальный фактор бесплодия и более молодой возраст супруга в паре, что указывает на изначально хорошее качество половых гамет.
Также отмечалось статистически значимое различие в сравниваемых группах относительно частоты живорождения на перенос эмбриона в полость матки: в I группе (стандартное ЭКО) – 36,4% из расчета на 1 эмбрион, тогда как во II группе (ИКСИ) – 27,6%, а в III группе с выбором сперматозоидов по способности связываться с ГК – 53,30% (рис. 3) (по критерию χ2=6,206; P=0,045).
Обсуждение
На сегодняшний день имеющиеся в литературе данные относительно эффективности физиологической селекции сперматозоидов (ПИКСИ) противоречивы.
В ряде крупных исследований отмечена положительная тенденция относительно улучшения качества полученных эмбрионов [11] и частоты наступления беременности. Имеется ряд исследований, которые демонстрируют статистически значимое снижение частоты самопроизвольных абортов после ИКСИ связанными с ГК сперматозоидами в сравнении с теми, что были отобраны лишь посредством визуальной оценки. Данные клинические результаты подтверждают выводы, полученные в проведенных ранее исследованиях биохимических и молекулярных маркеров функциональной зрелости сперматозоидов человека [12]. Кроме того, использование для ИКСИ сперматозоидов, отобранных при помощи ГК, увеличивает показатель частоты имплантаций [11].
Результаты этих исследований свидетельствуют об отсутствии негативных последствий, оказываемых на ооциты-реципиенты и преимплантационный эмбриогенез при использовании ГК для селекции сперматозоидов в циклах ИКСИ. Улучшение качественных характеристик сперматозоидов, способных связываться с ГК, подтверждено рядом исследований. Так, было продемонстрировано отсутствие фрагментации ДНК в ядре сперматозоидов, связавшихся с ГК [13]. А влияние фрагментации ДНК сперматозоидов на результативность программ ЭКО, в частности на привычное невынашивание беременности, исследовалось неоднократно [18, 19].
Кроме того, была доказана эффективность селекции сперматозоидов, связывающихся с ГК, в снижении частоты анеуплоидий как при олигозооспермии, так и при нормальной концентрации половых клеток. При этом наблюдается существенное уменьшение частоты дисомий и диплоидий хромосом [10, 11].
Результаты ранее проведенных исследований также продемонстрировали существенную связь методики селекции мужских половых гамет для ИКСИ и клинической эффективностью программы ВРТ [20, 21]. Были приведены убедительные доказательства того, что «физиологический» отбор сперматозоидов для ИКСИ значительно улучшает качество эмбрионов, существенно уменьшая степень фрагментации эмбрионов 3-го дня, способствуя формированию бластоцист хорошего качества, что увеличивает частоту имплантации и частоту наступления клинической беременности [16, 22].
На способности связываться с ГК отражается и морфологическая целостность ядра сперматозоида. При помощи микроскопии высокого увеличения (MSOME) было обнаружено, что количество гамет с нормальным ядром (согласно критериям MSOME) среди сперматозоидов, связавшихся с ГК, существенно выше, чем среди сперматозоидов, погруженных в поливинилпирролидон (14,5 и 11% соответственно) [7]. Использование феномена связывания сперматозоидов с гиалуронатом способствует селекции единичного зрелого, функционально компетентного сперматозоида с целостной ДНК, снижая, таким образом, потенциальные риски возникновения побочных эффектов, оказываемых вкладом отцовского генома в развитие эмбриона [8].
Показано, что при индексе связывания сперматозоидов с ГК ≤65% селекция сперматозоидов с использованием гиалуроната приводит к статистически значимому снижению частоты спонтанных абортов [8, 23].
Явная тенденция к более высоким цифрам среднего возраста супругов в группах, где использовалась методика ИКСИ и ПИКСИ (p=0,65) по результатам нашего исследования, обусловила ухудшение качества половых гамет обратно пропорционально возрасту. Возраст мужчины может сильно влиять на репродуктивную способность [24–26], несмотря на что, с 1980 г. рождаемость от пожилых мужчин выросла на 30%. Возраст как важный фактор риска невынашивания беременности приобрел самостоятельное клиническое значение [27–31]. С одной стороны, старший отцовский возраст не является специфическим фактором риска для наступления и течения беременности, так как его трудно отделить от влияния на беременность материнского возраста, но с другой стороны, проводимые исследования свидетельствуют о том, что частота бесплодия коррелирует с возрастом, как женщин, так и мужчин [32]. Возможно, тенденция снижения рождаемости и предрасположенности к генетическим рискам берет начало после 40 лет [32, 33], но пороговый эффект возрастает линейно, а не появляется в каком-то конкретном возрасте. Возраст мужчины становится существенным фактором, когда возраст женщины достигает 35 лет и больше. По другим данным, критический возраст для мужской фертильности колеблется в диапазоне 35–68 лет [34], в связи с чем необходима адекватная оценка функциональной пригодности мужского материала и правильной селекции гамет для оплодотворения ооцитов пациентки в программе ЭКО.
Существенную связь методики селекции мужских половых гамет для ИКСИ и клинической эффективностью программы ВРТ продемонстрировали и результаты ранее проведенных исследований [35–40].
Таким образом, благодаря значительному снижению степени фрагментации ДНК и нарушений морфологии ядра, ИКСИ сперматозоидами, связанными с ГК, ведет к значительному улучшению показателей оплодотворения и качества эмбрионов и, как следствие, увеличивает вероятность наступления беременности.
Вместе с тем, в ряде публикаций приводятся сведения об отсутствии различий в частоте оплодотворения и наступления беременности после введения гиалуронат-связанных сперматозоидов, что может быть обусловлено малой выборкой пациентов, участвовавших в данных исследованиях [35–42].
Заключение
В группе, где перед проведением процедуры ИКСИ производилась селекция сперматозоидов по способности связывания с гиалуронатом, обнаружены статистически значимо более высокие цифры по частоте наступления клинической беременности (тест Манна–Уитни, р=0,28): в I группе – 40,6% (13 пациенток), во II – 38,1% (40 пациенток), в III – 59,3% (35 пациенток).
Анализ частоты неразвивающейся беременности и живорождения у супружеских пар после проведения программы ЭКО, ЭКО/ИКСИ и ЭКО/ПИКСИ продемонстрировал значимые различия по проценту живорождения на количество наступивших беременностей после проведения программ ВРТ в пользу I группы с использованием стандартного ЭКО и III группы с применения методики «физиологической» селекции мужских гамет для ИКСИ, по сравнению с группой II, где проводилась ИКСИ. Однако следует принимать во внимание, что в I группе значительно преобладал трубно-перитонеальный фактор бесплодия и более молодой возраст супруга в паре, что указывает на изначально хорошее качество половых гамет. В I группе пациентов (стандартное ЭКО) частота неразвивающейся беременности составила 7,7%, тогда как в группах ИКСИ и ПИКСИ – 31 и 11% соответственно.
Согласно полученным нами данным, имелись достоверные различия по частоте имплантации между II и III группами (по критерию χ2=6,0; P=0,014): в I группе – 40,5%, во II – 33,1%, в III – 50%, что демонстрирует прямую зависимость качества эмбрионов от генетического вклада мужского генома.
Также отмечалось статистически значимое различие в сравниваемых группах относительно частоты живорождения на перенос эмбриона в полость матки: в I группе (стандартное ЭКО) – 36,4% из расчета на 1 эмбрион, тогда как во II группе (ИКСИ) – 27,6%, а в III группе с выбором сперматозоидов по способности связываться с ГК – 53,30% (по критерию χ2=6,206; P=0,045).
Накопленные на сегодня данные подтверждают перспективность изучения значимости различных современных методик селекции мужских половых клеток в целях дифференциального подхода к лечению супружеских пар. Проведенные исследования демонстрируют обнадеживающие результаты, которые могут быть применены в клинической практике не только для оптимизации выбора методики оплодотворения, но и расширения объема обследования перед проведением программы ЭКО.



