Определенную роль в формировании осложнений беременности, приводящих к увеличению количества преждевременных родов, перинатальных осложнений и перинатальных потерь, играют гиперкоагуляционные состояния, в том числе связанные с тромбофилией.
Наследственная тромбофилия – это нарушение свертывания крови, при котором доказано увеличение риска венозной тромбоэмболии (ВТЭ). Наследственные тромбофилии связаны и с неблагоприятными исходами во время беременности. Тем не менее существует ограниченное количество данных, позволяющих проводить скрининг и лечение этих состояний во время беременности. Различные виды тромбофилий обусловливают неоднозначный риск тромбоза у матери и неблагоприятные исходы беременности, поэтому также неоднозначны показания к скринингу для выявления этих состояний [1, 2].
Неблагоприятные исходы при беременности включают как ранние (привычное невынашивание), так и поздние опосредованные сосудистые проблемы плаценты (антенатальная гибель плода, преэклампсия, отслойка плаценты и задержка внутриутробного роста). Simcox L.E. et al. говорят: «Существует мало убедительных доказательств связи неблагоприятных исходов беременности с тромбофилией во время беременности» [3].
В течение последних десятилетий многократно обсуждается вопрос, необходимо ли обследование беременных на наследственные тромбофилии в виде повсеместного скрининга, что привело бы к значительным материальным затратам, или тестирование отдельных групп населения с высоким предполагаемым риском осложнений беременности на основании анамнестических данных.
Тестирование на тромбофилию однозначно рекомендовано у пациенток с венозным тромбозом или эпизодами тромбоза у близких родственников в анамнезе [4]. По мнению Dłuski D. et al., тесты на тромбофилию следует проводить у женщин с неблагоприятными исходами беременности в анамнезе, которые планируют беременность, чтобы начать антикоагулянтную профилактику [5].
Однако необходимость применения антикоагулянтной терапии у беременных с тромбофилией с целью улучшения исходов и профилактики осложнений беременности также относится к вопросам неоднозначным и нерешенным [6].
Метаанализ рандомизированных контролируемых исследований от 2016 г., сравнивающих применение низкомолекулярного гепарина (НМГ) у женщин с наследственной тромбофилией и предшествующим невынашиванием беременности, утверждает, что не было значительных различий в показателях числа живорождений в зависимости от наличия или отсутствия терапии НМГ (относительный риск (ОР) 0,81; 95% доверительный интервал (ДИ) 0,55–1,19; Р=0,28) [7].
В обзоре 2019 г. исследуются доказательства влияния наследственной тромбофилии на привычное невынашивание и другие осложнения беременности; обсуждается вопрос, может ли антитромботическое лечение изменить исход беременности. Основной вывод – обследование на наследственную тромбофилию не требуется при привычном невынашивании беременности или осложнениях на поздних сроках беременности [8].
Ранняя диагностика и своевременная коррекция гиперкоагуляционных изменений, вероятно, могли бы оказать определенное влияние на предупреждение развития грозных осложнений, в том числе приводящих к неблагоприятным перинатальным исходам. В настоящее время клинические рекомендации по тромбофилии предусматривают диагностические мероприятия в ряде конкретных ситуаций: пациентки с эпизодом ВТЭ в анамнезе, ассоциированной с наследственной или приобретенной тромбофилией высокого риска, относятся к группе очень высокого риска последующих ВТЭ [9, 10].
В других клинических ситуациях обследование показателей свертывающей системы крови не предусмотрено. Для проведения дорогостоящих исследований нужны отдельные показания, которые могут не проявляться при даже тщательном клиническом наблюдении беременной в рамках существующего протокола. В ранее проведенном ретроспективном исследовании нами была показана корреляция структурных изменений плаценты с частотой выявления наследственной тромбофилии и гиперкоагуляции, а также с частотой неблагоприятных перинатальных исходов в анамнезе. Было предложено считать массивные структурные изменения плаценты в виде расширения межворсинчатых пространств (МВП) маркером гиперкоагуляции при данной беременности [11]. Вторая часть исследования представляет собой проспективный анализ клинических наблюдений пациенток, у которых в течение настоящей беременности при ультразвуковом исследовании (УЗИ) выявлены массивные расширения МВП плаценты.
Цель исследования: проследить течение и исходы беременности у пациенток с массивными структурными изменениями плаценты в виде расширения МВП в зависимости от коррекции гиперкоагуляции.
Материалы и методы
В исследование включены 139 беременных с впервые выявленными структурными изменениями плаценты во время первого посещения, ранее не обследованных на полиморфизм генов тромбофилии и без лабораторных подтверждений гиперкоагуляции на момент первого посещения.
Пациентки 1-й группы (n=64) либо не получали антикоагулянтную терапию по разным причинам, либо получали ее короткими эмпирическими курсами без тщательного лабораторного контроля.
Пациентки 2-й группы (n=75) после первого посещения обследованы на полиморфизм генов тромбофилии, получали антикоагулянтную или антиагрегантную терапию согласно рекомендациям гематолога на протяжении всей беременности под лабораторным контролем до достижения нормокоагуляции.
Критерии включения: 1. Выявление при первом УЗИ массивных структурных изменений плаценты в виде расширения МВП. За массивные расширения принимали выявление в структуре плаценты гипоэхогенных неоднородных зон неправильной или условно треугольной формы с нечеткими контурами, расположенными произвольно или между котиледонами плаценты, в ряде случаев – с обнаруживаемым током крови в пространствах (общий размер участков расширения МВП превышал 1/3 от площади сечения плаценты). Округлые анэхогенные зоны в центре котиледонов не рассматривались как расширения МВП. Ретрохориальные и ретроамниальные гематомы рассматривались как осложнения беременности. 2. Информированное согласие пациентки.
Критерии исключения: другие структурные изменения плаценты; срок беременности более 38 недель (нецелесообразно для лабораторного обследования и коррекции состояния).
Методы исследования: 1) анамнестический, с анализом осложнений предыдущих беременностей и течения настоящей беременности до момента консультации в институте; 2) УЗИ: фетометрия с перцентильной оценкой полученных данных. Применялись перцентильные шкалы ВОЗ проекта INTERGROUS-21. Оценка роста плода и диагностика задержки роста проводились по международным стандартам DELFI. УЗИ плаценты проведены на аппарате Samsung WS 80A или Voluson E 10.
 Плацентометрия включала в себя измерение толщины в проекции корня пуповины (при возможности). При неравномерной толщине плаценты указывались крайние значения измерений – максимальные. При наличии технических возможностей определялись линейные размеры плаценты в двух взаимно перпендикулярных срезах. При массивных расширениях МВП в заключении УЗИ было указано с пометкой для лечащего врача: «Структурные изменения более характерны для тромбофилии» и рекомендовано соответствующее лабораторное обследование (рис. 1).
Плацентометрия включала в себя измерение толщины в проекции корня пуповины (при возможности). При неравномерной толщине плаценты указывались крайние значения измерений – максимальные. При наличии технических возможностей определялись линейные размеры плаценты в двух взаимно перпендикулярных срезах. При массивных расширениях МВП в заключении УЗИ было указано с пометкой для лечащего врача: «Структурные изменения более характерны для тромбофилии» и рекомендовано соответствующее лабораторное обследование (рис. 1).
Оценку параметров свертывающей системы крови проводили с помощью стандартных коагулологических тестов: активированного частичного тромбопластинового времени, протромбинового времени, тромбинового времени, антитромбина III, фибриногена на автоматическом коагулометре Sysmex СS-2000i.
Для оценки патогенетической роли тромбофилий пациенткам проводилось молекулярно-генетическое типирование по следующим полиморфизмам: F5 169 G>A, F2:20210 G>A, MTHFR:677C>T, PAI1 SERPINE1 PAI-1): -675 5G>4G. Для выделения ДНК из цельной крови использовались наборы DiatomTM DNA Prep 200. Постановка осуществлялась наборами фирмы «ДНК-Технология» в режиме реального времени (Real-Time) амплификатором ДТ Prime 5 фирмы «ДНК-Технология».
Статистический анализ
Методы статистической обработки данных: данные беременных обеих групп были упорядочены, закодированы и внесены в таблицы в программе Microsoft Excel 2016. Эти данные включали сведения о возрасте, паритете, сроке беременности на момент проведения обследования, данные анамнеза, общеклинического обследования, данные УЗИ – фетометрию и плацентометрию; данные о состоянии свертывающей системы крови кодировались по принципу: гиперкоагуляция «1», нормокоагуляция «0». В основу математической обработки материала были положены непараметрические методы математической статистики с вычислением медианы и квартильных значений для показателя толщины плаценты.
Статистический анализ включал в себя оценку критерия Стьюдента (при нормальном распределении выборки); критерий Манна–Уитни использовался для оценки различий между двумя независимыми выборками по уровню количественных признаков; критерий Уилкоксона использовали для проверки различий между двумя выборками парных измерений.
Для каждого исследуемого признака с нормальным распределением определялись среднее арифметическое значение (M) и его ошибка (m), среднее квадратическое отклонение. Достоверность полученных материалов анализировалась с использованием t-критерия Стьюдента.
Результаты
В 1-й группе под наблюдением находились 64 беременных, которым суммарно было выполнено 117 исследований. Кратность УЗИ в институте за время наблюдения составила от 1 до 7 исследований. Средний возраст беременных составил 33,4 (5,8) года. В 18 наблюдениях беременность была первой, из них в 10 случаях наступила после экстракорпорального оплодотворения (ЭКО).
Во 2-й группе под наблюдением находились 75 беременных, которым суммарно было выполнено 161 исследование. Кратность УЗИ в институте за время наблюдения составила от 2 до 5. Средний возраст беременных был 31,6 (6,1) года. В 23 наблюдениях беременность была первой, из них в 12 случаях наступила после ЭКО.
Статистически значима разница по количеству эпизодов венозных тромбозов в анамнезе, по другим параметрам различий не выявлено (табл. 1).
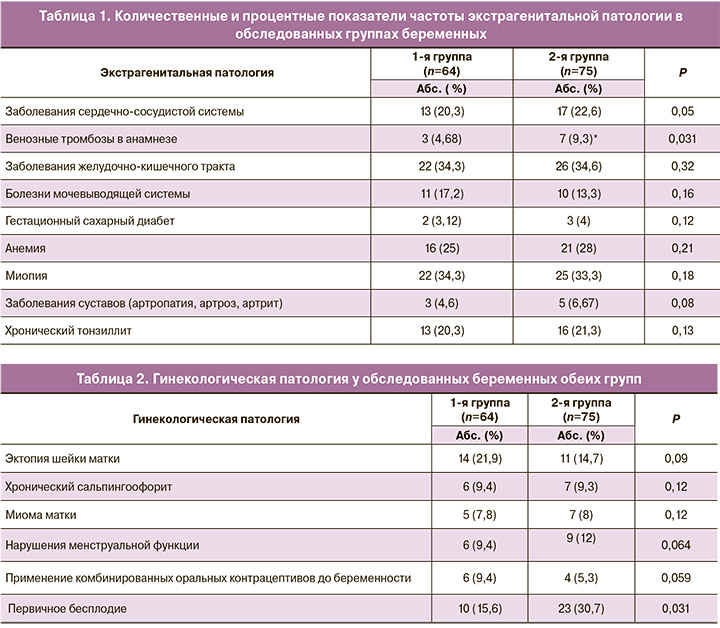
По гинекологическому анамнезу значимые различия выявлены только в показателях первичного бесплодия во 2-й группе (табл. 2). Особого внимания заслуживает акушерский анамнез.
Характеристика акушерского анамнеза 1-й группы
В 46 наблюдениях беременность была повторной. Анализ предыдущих беременностей в данной группе пациенток представляет большой интерес. У 31 (67,4%) пациентки беременность была второй. В анамнезе: преждевременная отслойка нормально расположенной плаценты – 2 (4,3%) случая, хорионангиома – 1 (2,2%) случай, задержка внутриутробного роста плода (ЗВУР) – 4 (8,6%) случая, неразвивающаяся беременность – 4 (8,6%) случая, антенатальная гибель плода – 2 (4,3%) случая, интранатальная гибель плода – 1 (2,2%) случай. В 48% наблюдений имелся отягощенный акушерский анамнез, в 52% наблюдений предыдущая беременность закончилась рождением здорового ребенка.
В 12 наблюдениях беременность была третьей. В анамнезе: антенатальная гибель плода – 2 (16,7%) случая, интранатальная гибель плода – 1 (8,3%) случай, преждевременное оперативное родоразрешение по поводу тяжелой преэклампсии – 6 (50%) случаев; у 6 (50%) беременных в анамнезе были только неразвивающиеся беременности. То есть из 24 реализованных беременностей только в 10 случаях беременность закончилась родами и только в 4 случаях – срочными родами здоровыми детьми, что составило 16,6%.
У 1 пациентки беременность была четвертой (2 неразвивающиеся беременности и 1 преждевременные роды в анамнезе), у 1 – пятой (2 неразвивающиеся беременности и 2 преждевременных родов) и у 1 – седьмой (4 неразвивающиеся беременности и 2 антенатальные гибели плода – в 27 и 32 недели). Из 68 повторных беременностей в 1-й группе 34 (50%) завершились рождением живого ребенка, 34 (50%) имели абсолютно неблагоприятный исход.
Сроки обращения в МОНИИАГ составили от 5 до 38 недель. В I триместре беременности до проведения первого пренатального скрининга обратились 10 (15,6%) пациенток, в сроке 11–14 недель для проведения скрининга – 5 (7,8%) беременных; во II триместре, в сроке от 15 до 26 недель, – 38 (59,4%) беременных, в III триместре – 11 (17,2%) беременных.
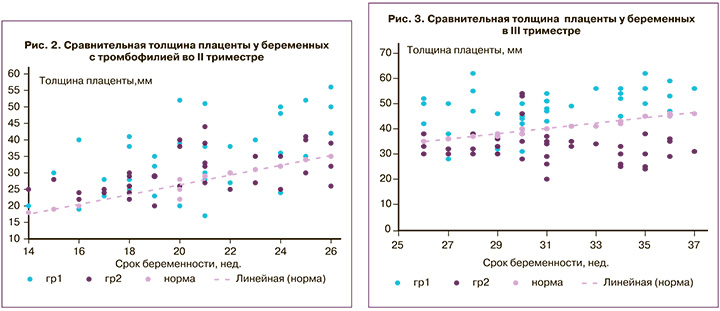
Не были обследованы на полиморфизм генов тромбофилии 6 (9,4%) пациенток, обследованы – 58 (90,6%). Тромбофилия не выявлена у 2 (3,1%) пациенток с гестационным сахарным диабетом. В 96,9% выявлены различные варианты полиморфизма генов гемостаза, которые представлены в таблице 3. Две (3,1%) пациентки из группы отказались от лечения по религиозным мотивам. В одном случае, по мнению лечащего врача, терапия не требовалась. 53 (82,8%) беременные получали терапию короткими курсами с периодической отменой антикоагулянтов. Среди пациенток, не получавших терапию или получавших нерегулярное лечение, с перерывами, без должного лабораторного контроля в течение беременности выявлено раннее старение плаценты в 5 (9,4%) наблюдениях, гипоплазия плаценты – в 3 (5,6%). При повторных исследованиях в данной группе пациенток изменений структуры плаценты в сторону нормализации не выявлено (рис. 2, 3). В 2 (3,6%) случаях отмечено прогрессирование процесса с формированием массивного субхориального тромбоза (МСХТ), по-видимому, послужившего причиной преждевременной отслойки плаценты и преждевременных родов (в 28 недель с массой плода 640 г и в 26 недель с массой плода 820 г). Исходы беременности у пациенток 1-й группы представлены в таблице 4.

Характеристика акушерского анамнеза 2-й группы
Во 2-й группе под наблюдением находились 75 беременных. В 52 (69,33%) наблюдениях беременность была повторной, в 46 (61,3%) – второй, у 6 (8%) пациенток – третьей. Среди 52 повторнобеременных неблагоприятный акушерский анамнез имели 32 (61,5%) беременные: неразвивающаяся беременность – у 19 (36,5%); отслойка нормально расположенной плаценты во II триместре беременности с антенатальной гибелью плода – у 4 (7,6%); отслойка нормально расположенной плаценты в III триместре беременности, потребовавшая экстренного кесарева сечения, – у 4 (7,6%); рождение детей с ЗВУР – у 5 (9,6%). Таким образом, из 58 реализованных беременностей в данной подгруппе только 50% закончились срочными неосложненными родами.
В I триместре структурные изменения хориона были выявлены у 8 (10,7%) пациенток; впервые обратились во II триместре 54 (72%) пациентки, в начале III триместра – 13 (17,3%) пациенток. У пациенток, обратившихся в I триместре, от 5 до 14 недель, в 7 (87,5%) наблюдениях из 8 была выявлена угроза прерывания беременности в виде отслойки плодного яйца с формированием ретрохориальной гематомы.
При первичном обследовании в сроки от 15 до 26 недель у всех беременных было выявлено диффузное утолщение плаценты с максимальным значением 46 мм, массивные структурные изменения в виде расширения МВП. В 4 (7,4%) наблюдениях обнаружена отслойка плаценты с формированием ретроплацентарных гематом. В 2 (3,7%) наблюдениях выявлено маловодие, в 11 (20,3%) – ранняя ЗВУР плода. Среди 8 пациенток, впервые обратившихся в III триместре с характерной структурой плаценты, у 3 (37,3%) беременных диагностирован гестационный сахарный диабет, у 2 (25%) – ЗВУР.
Из 75 пациенток 2-й группы 72 (96%) были обследованы на полиморфизм генов тромбофилии. Результаты представлены в таблице 3.
Как видно из таблицы 3, статистически значимая разница отмечена только в двух параметрах – в частоте выявления антифосфолипидного синдрома у пациенток 1-й группы и PAI 1 – у пациенток 2-й группы. В ранее проведенном нами исследовании было показано, что коэффициент корреляции между выявлением расширения МВП плаценты и диагностикой тромбофилии составил 0,63, между изменениями в плаценте и формой мутации – 0,18, то есть имелась очень слабая положительная корреляция [11].
У 72 (96%) пациенток с выявленной тромбофилией отмечались изменения в стандартных коагулологических тестах по типу гиперкоагуляции, что послужило показанием к назначению антикоагулянтной или антиагрегантной терапии под динамическим лабораторным и ультразвуковым контролем.
При динамическом наблюдении на фоне проводимой терапии не отмечено изменений в структуре плаценты у 10 (13,9%) пациенток; увеличение толщины плаценты и увеличение площади МВП отмечено у 12 (16,7%) пациенток, уменьшение толщины и нормализация структуры – у 50 (69,4%) беременных (рис. 3).
Нормализация структуры плаценты, по-видимому, служит отражением нормализации внутриплацентарного кровотока, что ведет к значимому снижению неблагоприятных акушерских исходов. Сравнительные данные представлены в таблице 4.
Заключение
Эхоструктура плаценты может быть использована в качестве дополнительного диагностического признака, позволяющего выделить при эхографии группу беременных, наиболее угрожаемых по развитию тяжелых гестационных осложнений, хотя и не может быть критерием для постановки клинического диагноза. Логично предположить, что адекватная антикоагулянтная терапия может приводить к изменению структуры МВП, улучшению внутриплацентарной гемодинамики. Эти процессы имеют свое отражение в ультразвуковой картине плаценты в виде уменьшения толщины и нормализации структуры, что демонстрирует исследование 72 пациенток 2-й клинической группы. В свою очередь, нормализация функции плаценты позволяет снизить количество неблагоприятных перинатальных исходов, связанных с гиперкоагуляцией. Бесспорно, нужны дальнейшие исследования в этом направлении, но уже сейчас можно предложить нормализацию эхоструктуры плаценты как один из критериев адекватности антикоагулянтной терапии.



