Миома матки (лейомиома) представляет собой наиболее распространенное доброкачественное новообразование женщин репродуктивного возраста, частота которого возрастает по мере увеличения возраста [1, 2]. Хотя течение заболевания у большинства женщин протекает бессимптомно, клинические проявления миомы включают в себя нарушения менструального цикла и репродуктивной функции [3]. Во время беременности интрамуральные миомы могут быть причиной выкидышей [4], а крупные миомы могут вызывать нарушение развития плода и сократимости миометрия [5, 6]. До недавнего времени не существовало единого мнения о причинах развития миомы матки. Обычно выделяли несколько факторов, способствующих развитию миомы матки: нарушение выработки половых гормонов; хронические воспалительные заболевания женской половой сферы (хронический сальпингоофорит, инфекции, передающиеся половым путем); аборты, внутриматочные контрацептивы; заболевания эндокринных желез (щитовидной железы, надпочечников и др.). Среди этих факторов также обычно фигурирует «генетическая предрасположенность к возникновению миомы матки», что подтверждается наличием «семейных форм» данного заболевания у 5–10% больных, однако конкретных механизмов такой предрасположенности до недавнего времени описано не было [7]. Наряду с этим установлено, что в очагах роста лейомиом обнаружено большое количество таких характерных для воспаления клеточных элементов, как макрофаги и тучные клетки, по сравнению с более отдаленным миометрием [8].
Можно предположить, что такая избыточная пролиферация воспалительных, гладкомышечных и соединительнотканных клеточных элементов, которая наблюдается при миоме матки, является следствием утраты контроля над нормальным течением процессов клеточного деления и дифференцировки, которые во многом контролируются системой ростовых и цитокиновых регуляторных факторов. Суммарная выраженность провоспалительной, проангиогенной и активирующей склерогенез способности семейства таких регуляторных факторов компенсируется наличием семейства цитокинов с противовоспалительной и иной супрессирующей клеточную активность способностью.
Анализ суммарной концентрации наиболее активных представителей этого семейства цитокинов в сыворотке крови стал основной целью настоящего исследования. Его отличительной особенностью является использование принципов мультиплексного анализа, позволяющего одномоментно в одной пробе сыворотки крови определять концентрации большого числа биологически активных факторов, используя технологию xMAP, лицензированную Luminex, созданную с использованием двух флуоресцентных красителей при различных соотношениях для обеспечения исследования до 100 различных анализов в рамках одного образца. В данном сообщении представлены результаты определения таких основных факторов с выраженной противовоспалительной активностью, как интерлейкин (IL)-4, IL-10, IL-13 и природный антагонист рецептора IL-1β – IL-1ra.
Материал и методы исследования
Под наблюдением находились 36 пациенток с верифицированным диагнозом миомы тела матки, которым проводилось оперативное лечение в объеме лапароскопической миомэктомии. Возраст пациенток составил от 23 до 54 лет. Средний возраст составил 41,13±6,68 года. Среди них пациенток с избыточной массой тела и с ожирением (индекс массы тела >24.99) было 35,89%. Нарушение менструального цикла по типу полименорреи выявлено у 20 пациенток. Предшествующие роды отмечены у 28 пациенток. Искусственное прерывание беременности было в анамнезе у 25 женщин. Спонтанные выкидыши выявлены у 8 пациенток. У 5 пациенток в анамнезе беременностей не было. Жалобы на тянущие боли внизу живота предъявили 28 пациенток, на кровотечение – 23 пациентки. Размеры миоматозных узлов, выявленных по данным ультразвукового исследования органов малого таза, составили от 5 до 180 мм. Средний размер – 106,5±41,05 мм. По передней стенке матки располагались узлы у 19 пациенток, по задней – у 7 пациенток; атипическое расположение (забрюшинные, перешеечные узлы) – у 2, сочетанное расположение – у 10 пациенток. При выполнении предоперационной гистероскопии по данным гистологического исследования у 7 пациенток диагностирован полип эндометрия, у 6 – простая гиперплазия эндометрия.
Для определения цитокинов однократно замороженную сыворотку крови размораживали перед исследованием до комнатной температуры. Для удаления осадка проводили центрифугирование сыворотки при 4°C 10 000 об./мин 10 минут. Концентрацию 27 цитокинов определяли с использованием набора фирмы Bio-Rad (США) – Bio-Plex Pro Human Cytokine 27-plex Assay методом проточной флюориметрии на двухлучевом лазерном анализаторе Bio-Plex 200, производства Bio-Rad (США). В сыворотке одномоментно определялись концентрации IL-1β, IL-1ra, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12 (p70), IL-13, IL-15, IL-17, Basic FGF, Eotaxin, G-CSF, GM-CSF, IFN-γ, IP-10, MCP-1 (MCAF), MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α и VEGF после построения калибровочной кривой по соответствующим стандартам. Для обработки данных применялось программное обеспечение Bio-Plex Manager Software version 4.1. Концентрация цитокинов выражалась в пг/мл.
Статистическую обработку проводили с помощью специализированных пакетов прикладных программ StatSoft Statistica 10.0 и IBM SPSS Statistics 23 (США). Проверку гипотезы о нормальном распределении количественных параметров проводили с использованием критерия Шапиро–Уилка и критерия Колмогорова–Смирнова с поправкой Лиллиефорса. Для анализа данных использовали параметрические (t-критерий Стьюдента для независимых выборок с учетом выполнение двух ограничивающих условий: нормальность распределения и равенство генеральных дисперсий для групп сравнения) и непараметрические (U-тест Манна–Уитни, ранговая корреляция Спирмена) методы статистики. Данные представлены в виде среднего значения±ошибка средней (M±m), медианы (Me). Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты исследования
Необходимо отметить, что при сравнении количественных характеристик исследованных цитокинов обращает на себя внимание, во-первых, значительная дисперсия практически всех регуляторных факторов в сыворотке крови обследованных женщин. Это заключение подтверждается как значениями минимальных и максимальных показателей, представленных в табл. 1, так и значительными различиями в показателях средних величин и медианных критериев для всех исследованных цитокинов.
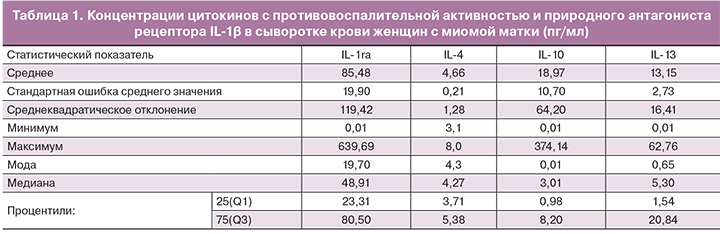
Переходя к вопросу о сопоставлении полученных результатов со значениями исследованных показателей у здоровых женщин мы обратились к нормативным значениям, полученным на значительной выборке здоровых женщин европеоидного происхождения, полученных лабораторией, сотрудничающей с фирмой-разработчиком используемых нами тест-систем «27-plex kit from Bio-Rad» [9]. В этих исследованиях проведен тщательный анализ результатов исследования цитокинов в сыворотке крови в зависимости от пола, возраста, этнической принадлежности обследованных лиц, от времени исследования и даже от использования различных пластиковых планшетов при исследовании полученного образца сыворотки крови. Результаты этих исследований, статистический анализ которых проведен с помощью программного обеспечения «Bio-Plex Manager software version 6.2.», признаны пригодными в качестве нормативных значений для здоровых женщин европеоидного происхождения. Несмотря на то, что результаты исследования 25 из 27 цитокинов (за исключением MCP-1 и TNF-α) не выявили гендерных различий, для сопоставления нами использованы данные исследования сывороток группы из 94 здоровых женщин европеоидного происхождения.
Проведенное исследование выявило резкое снижение концентрации в сыворотке крови женщин с миомой матки такого ключевого цитокина с противовоспалительной активностью, как IL-4. Функции IL-4 достаточно разнообразны и связаны с переключением синтеза В-клетками IgG1, IgG4 и IgE, активацией макрофагов и воздействием на клетки эпителия и гладкой мускулатуры, подавлением синтеза IL-1β, IL-6, TNF-α, IL-8. Этот регуляторный белок, наряду с IL-15 и IL-13, относится к семейству цитокинов, продуцируемых Th2 и ILC2s клетками, экспрессирующими транскрипционный фактор GATA3 [10, 11]. Рецептор интерлейкина-4 также связывается с IL-13, что может способствовать многим перекрывающимся функциям этого цитокина и IL-13. Их согласованная продукция оказывает воздействие на процессы отложения коллагена и фиброзирования тканей, отмечающихся при развитии миомы матки [12]. IL-13 конвертирует дифференцировку макрофагов в М2 фенотип, не обладающий воспалительной активностью клеток с фенотипом M1 [13].
Концентрация IL-4 в сыворотке крови женщин с миомой матки оказалась достоверно сниженной и составила 4,66±0,77 пг/мл по сравнению с 36,0±2,27 пг/мл, выявленных в группе здоровых женщин европеоидного происхождения (p<0,000001). Наряду с этим концентрация IL-13 в сопоставляемых группах женщин оказалась практически идентичной – 13,15±2,73 и 14,1±1,85 пг/мл соответственно (p=0,757). Сходные данные получены нами и при исследовании тем же методом концентрации IL-13 в сыворотке крови здоровых женщин (15,01±1,98 пг/мл).
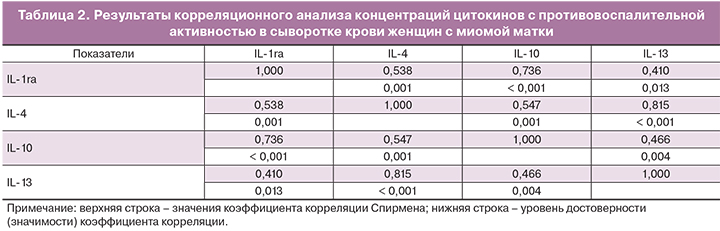
Как следует из табл. 2, концентрации этих двух цитокинов оказываются в сильной прямой корреляционной зависимости (коэффициент корреляции Спирмена равен 0,815, р<0,0001).
Значительно сниженной при миоме матки оказалась и концентрация сывороточного антагониста рецептора IL-1 (IL-1ra), который связываясь с рецепторами к IL-1α и IL-1β, значительно снижает их провоспалительную активность. Все семейство IL-1 состоит из 11 членов, включая 7 провоспалительных агонистов (IL-1α, IL-1β, IL-18, IL-33, IL-36α, IL-36β, IL-36γ) и 4 определенных или предполагаемых антагонистов (антагонист IL-1r (IL-1ra), IL-36ra, IL-37 и IL-38), оказывающих противовоспалительную активность [14].
В нашем исследовании концентрация белка IL-1ra в сыворотке крови женщин с миомой матки составила 85,49±19,83 пг/мл при концентрации этого фактора в сыворотке крови здоровых женщин 305,5±45,76 пг/мл (p=0,00002). Можно предположить, что недостаточный уровень продукции этого регуляторного фактора может привести к повышению провоспалительной активности самого IL-1β, несмотря на то, что, согласно нашим данным, его концентрация в сыворотке крови женщин с миомой матки (2,31±0,42 пг/мл) также ниже, чем у здоровых женщин (4,3±0,59 пг/мл, p=0,006).
В пользу заключения о неоднозначности выявленных данных снижения концентраций сывороточных цитокинов с противовоспалительной активностью при миоме матки свидетельствуют и полученные нами данные о тенденции к повышению концентрации в сыворотке крови больных женщин IL-10. Его содержание в крови здоровых женщин составляет 2,70± 0,64 пг/мл, тогда как нами установлены средние значения этого показателя для женщин с миомой матки 18,98± 10,7 пг/мл (р=0,13).
IL-10 представляет собой цитокин с сильными противовоспалительными свойствами, который играет центральную роль в ограничении иммунного ответа организма на чужеродные антигены, тем самым предотвращая гипериммунный ответ и поддержание нормального тканевого гомеостаза. IL-10 продуцируется различными клетками, включая T-хелперные клетки, моноциты, макрофаги, дендритные клетки, В-клетки, цитотоксические Т-клетки, NK-клетки, нейтрофилы и эозинофилы эпителиальные клетки и кератиноциты, а также опухолевые клетки.
Иммунодепрессивная активность IL-10 опосредуется гетеродимерным рецептором IL-10 (IL-10R1, IL-10R2). Хотя рецепторный комплекс IL-10 экспрессируется в различной степени во многих иных типах клеток, моноциты и макрофаги, по-видимому, являются основной мишенью IL-10. Лигирование рецепторов активирует сигнализацию JAK/STAT, приводя к большим изменениям в профиле экспрессии иммуномодулирующих генов, которые, по сути, служат для ингибирования высвобождения провоспалительных медиаторов и одновременного усиления ингибирующей функции этих клеток. Кроме того, посредством высвобождения таких противовоспалительных молекул, как антагонист рецептора интерлейкина-1 (IL-1ra), растворимый рецептор TNF и интерлейкин-27, IL-10 может усиливать суммарный противовоспалительный эффект [15, 16].
Обсуждение
Подводя итоги полученным результатам можно прийти к заключению, что при миоме матки в сыворотке крови выявляются разнонаправленные изменения в содержании цитокинов с противовоспалительной активностью. Главным образом это относится к значительному снижению концентрации IL-4 и природного антагониста рецептора IL-1β. Концентрации двух других исследованных цитокинов со сходной по воздействию на воспалительные процессы регуляторной активностью IL-10 и IL-13 близка к показателям, характерным для здоровых женщин, хотя и имеет некоторые тенденции к изменениям как в сторону снижения, так и в сторону повышения. Их корреляция выражена гораздо слабее – коэффициент корреляции составляет лишь 0,46 (р=0,04).
Противовоспалительная активность IL-10 и других цитокинов с антивоспалительной направленностью делает их перспективными в качестве потенциальных лекарственных препаратов для лечения заболеваний с выраженной воспалительной или гиперреактивной компонентой. Однако на этом пути необходимо соблюдать значительную осторожность, о чем свидетельствует развитие острых колитов при нормальной кишечной флоре у нокаутных по гену IL10 мышей [17]. Вместе с тем, клинические наблюдения выявили возрастание уровня IL-10 в сыворотке крови женщин в результате проведенного лечения миомы матки [18].
Более разработаны подходы к терапевтическому использованию IL-1ra. В эксперименте его введение улучшает результаты инсульта у молодых и старых коморбидных крыс. Кроме того, IL-1ra не только увеличивает пролиферацию стволовых клеток, но также значительно усиливает миграцию нейробластов и число новорожденных нейронов после церебральной ишемии, что свидетельствует о том, что системное введение IL-1ra улучшает исход и способствует нейрогенезу после экспериментального инсульта, еще раз подчеркивая терапевтический потенциал этого препарата [19]. На его основе в рекомбинантной форме создан и разрешен к клиническому применению лекарственный препарат Аnakinra (Kineret), показавший высокую эффективность в лечении ревматоидного артрита и других системных воспалительных заболеваний [20].
В нашем случае мы имеем дело лишь с относительным снижением содержания IL-1ra в сыворотке крови женщин с миомой матки, патогенетическое значение которого предстоит выяснить. Наряду с этим описан редкий генетический синдром – дефицит антагониста рецептора IL-1 (DIRA), который представляет собой опасное для жизни системное заболевание, характеризующееся воспалением, асептическим мультифокальным остеомиелитом и пустулезом [21].
Заключение
Таким образом, как показали наши исследования, значительные изменения содержания цитокинов с противовоспалительной активностью и антагониста к одному из рецепторов к ним могут носить неблагоприятный характер в процессах пролиферации и дифференцировки тканей матки. Данное обстоятельство служит основанием для проведения дальнейших исследований этой проблемы с целью создания ясных представлений как о возможной патогенетической значимости выявленных изменений, так и о необходимости терапевтической коррекции этих нарушений нормального функционирования цитокиновой сети.



