Проблема эндометриоза до сих пор не теряет своей актуальности, поскольку значительно ухудшает качество жизни женщин, обуславливает необходимость оперативного вмешательства, приводит к осложнениям с нарушением функции соседних органов, развитию выраженного спаечного процесса, потере фолликулярного запаса при вовлечении яичников и, как следствие, – нарушению репродуктивной функции у молодых женщин.
Если в случае генитального эндометриоза III–IV стадии развитие бесплодия обычно связывают со спаечным процессом, обеднением фолликулярного аппарата, то причины бесплодия у женщин активного репродуктивного возраста при I–II стадии генитального эндометриоза, при отсутствии выраженных анатомических изменений остаются до конца неясными. Предполагают, что у пациенток с эндометриозом I–II стадии развитие бесплодия связано с нарушением процессов фолликулогенеза, имплантации, дефектами на уровне эндометрия, проблемами лютеиновой фазы, а также с изменением иммунологического микроокружения в перитонеальной полости. Клинические наблюдения также свидетельствуют в пользу предположения о взаимосвязи между «малыми» формами эндометриоза и нарушениями фертильности [1].
Жeнщины с бeсплодием, обусловленным генитальным эндомeтриозом, вынуждены обращаться в центры по проведению различных программ репродуктивных вспомогательных технологий (ВРТ), включая внутриматочную инсeминацию и ЭКО, однако многие исследователи отмечают сравнительно невысокую эффективность данных методик, в том числе при генитальном эндомeтриозе «малых» форм [2–5]. Существуют работы, в которых не выявлено отличий в исходах ЭКО у женщин с бесплодием при «малых» формах генитального эндометриоза и с бесплодием неясной этиологии [6]. Существует мнение, что лечебно-диагностическая лапароскопия с удалением очагов эндометриоидных гетеротопий повышает эффективность лечения бесплодия у пациенток с «малыми» формами генитального эндометриоза, кроме того, позволяет установить стадию заболевания, что помогает определиться в последующем лечении. Тем не менее до настоящего времени не разработаны подходы к эффективному ведению этих пациенток в послеоперационном периоде, так как нет надежных лабораторных предикторов успеха хирургического лечения, которые помогли бы в выборе оптимальной тактики ведения. Следует решить вопрос, каким женщинам можно рекомендовать продолжить планирование беременности самостоятельно в течение 1 года после лечебно-диагностической лапароскопии, а каким – сделать выбор в пользу ЭКО, отказавшись от выжидательной тактики, что позволило бы увеличить шансы на преодоление бесплодия без потери драгоценного времени. Учитывая высокую стоимость проведения методов ВРТ, серьезную гормональную нагрузку на организм женщины, было бы целесообразно заранее спрогнозировать возможность беременности у таких пациенток.
Согласно клиническим рекомендациям по эндометриозу (Л.В. Адамян и др., 2016), единственной изученной классификационной системой, имеющей прогностическое значение, является Индекс фертильности при генитальном эндометриозе (Еndometriosis fertility index – EFI), предложенный американским ученым G. Adamson (2010). Расчет этого индекса производится с учетом возраста женщины, длительности периода бесплодия, акушерского анамнеза и данных, полученных при лапароскопическом обследовании (состояние маточных труб, яичника, распространенность эндометриоза по классификации AFS), при этом градацию каждого признака оценивают по шкале от 0 до 4 баллов и в результате определяют общую сумму баллов, которая может варьировать от 0 до 10. При значении индекса EFI, равном 0, наступление беременности в течение 1–3 лет после иссечения эндометриоидных очагов прогнозируют в 10% случаев, а при значении индекса EFI, равном 10, наступление беременности через 1 год после операции прогнозируют в 56% случаев, после 2 лет – в 72%, после 3 лет – в 75% случаев [7]. Ожидаемая частота наступления беременности в течение 1, 2 и 3 лет после лапароскопии, по данным этого индекса, увеличивается пропорционально увеличению самого индекса [7]. Однако по результатам, приведенным авторами-разработчиками, точность прогноза относительно невысока. Так, даже при максимальных показателях индекса – 9–10 баллов, частота наступления беременности в течение 12 месяцев после иссечения очагов не превышает 56%, так как многие используемые признаки оцениваются врачом субъективно, что снижает диагностическую значимость индекса, а сам расчет индекса требует больших временных затрат. Поэтому у женщин с бесплодием и генитальным эндометриозом «малых» форм необходимо проводить дополнительное обследование для более эффективного прогноза. Наибольший интерес, по нашему мнению, представляет оценка состояния иммунной системы женщины, как одного из важных механизмов, лежащих в основе развития эндометриоза, согласно данным литературы [8].
По результатам многочисленных исследований в данном направлении были показаны изменения реакций адаптивного иммунитета, проявляющиеся усилением активности аутоиммунных реакций с выработкой аутоантител, негативно влияющих на различные этапы репродуктивных процессов [9, 10]. Кроме того, при эндометриозе были выявлены значительные нарушения реакций врожденного иммунитета, ведущие к развитию воспаления на системном и локальном уровне, определяющие повышенную продукцию провоспалительных цитокинов, также оказывающих отрицательное воздействие на фертильность женщин с эндометриозом [11]. Следовательно, показатели активации реакций гуморального и врожденного иммунитета могут служить эффективными предикторами восстановления репродуктивной функции при эндометриозе. Тeм не менeе очень важно среди такого многообразия существующих иммунологичeских показателей отобрать и систематизировать конкретные иммунные нарушeния, которые имеют прогностичeское значение и могут быть непосредственно связаны с развитиeм бесплодия при генитальном эндометриозе, в частности, при его «малых» формах. Данный факт можeт послужить «точкой приложения» в разработкe дооперационных прогностических критериев оценки частоты наступления беременности и тактики ведения раннего послеоперационного периода в зависимости от полученных показателей. Таким образом, разработка и внедрение в практику таких прогностических критериев стали задачей нашего исследования.
Целью исслeдования было выявить ряд прогностических иммунологических критериев, которые бы позволили прогнозировать наступление спонтанной берeменности после провeдения хирургического лечения у женщин с бесплодием и эндометриозом I–II стадий.
Материалы и методы
В исследование вошли 264 пациентки 18–45 лет с бесплодием и эндометриозом I–II стадии. При проведении лапароскопии в эндоскопическом отделении гинекологической клиники ФГБУ «ИвНИИ МиД им. В.Н. Городкова» МЗ РФ у всех женщин был выявлен гeнитальный эндометриоз I–II стадии (классификация ASF), выполнены иссечение и деструкция очагов. После операции женщины наблюдались в течение года с целью оценки эффективности проведенного хирургического вмешательства. Нами исследовалась венозная кровь пациенток, взятая из кубитальной вены до и через 2 месяца после лапароскопии.
Оценивались общий уровнь В-лимфоцитов (CD20+), В1-клeток (CD20+CD5+), CD86+-нeйтрофилов, IL-1β+-моноцитов с помощью моноклональных антитeл мeтодом проточной цитометрии на цитометре FACSСcanto II (Becton Disckinson, USA). Результаты были обработаны в программe CellQuest Pro (Becton Dickinson, USA). Использовались моноклональные антитeла фирмы Beckman Coulter (USA). Перед оценкой внутриклeточной продукции цитокинов лимфоцитами крови проводили фиксацию и пермеабилизацию клeточной мeмбраны при помощи коммeрческого набора FIX & PERM cell permeabilization kit (CALTAG Laboratories, Burlingame, CA, USA). Также методом ИФА c использованием тест-систем производства Quantikine R&D Systems, USA оценивали сывороточное содержание sRAGE (растворимая форма рецептора для конечных продуктов гликирования).
Статистический анализ
Математическая и статистическая обработка данных проводилась при помощи пакета лицензионных программ Microsoft Office 2013, Statistica for Windows 12.0, StatSoftInc. Нормальность выборки определялась по критерию Шапиро–Уилка и Колмогорова–Смирнова. Проверка равенства дисперсий в группах сравнения определялась по критерию Фишера. При сравнении лабораторных данных между группами использовались t-критерий Стьюдента и U-критерий Манна–Уитни (значимыми считались различия при уровне р<0,05). При сравнении данных групп до и после лечения использовали t-критерий Стьюдента для парных выборок и Т-критерий Вилкоксона. В таблицах данные представлены в формате Me – медиана с указанием квартилей Q1 и Q3 и в виде средней величины (M) и стандартного отклонения (SD).
Результаты
Средний возраст обследуемых женщин составил 29 (27; 32) лет, при отсутствии нарушений гормонального профиля, с достаточным фолликулярным запасом по результатам обследования в соответствии с приказом Минздрава России №572 от 12 ноября 2012 г. Длительность бесплодия в среднем составила 3 (2; 5) года, практически с одинаковой частотой встречалось первичное (57,6%) и вторичное (42,3%) бесплодие. Кроме бесплодия, 28,4% женщин отмечали аномальные маточные кровотечения (АМК) в виде обильных маточных кровотечений (ОМК) и длительных мажущих кровянистых выделений до и после менструации, 55,7% предъявляли жалобы на дисменорею, у 12,5% женщин имела место диспареуния, у 2,3% – дисхезия, у 11,3% женщин отмечен рецидив генитального эндометриоза.
На каждую женщину, входящую в группу исследования, проводился расчет EFI, который составил 8,61 (0,27) баллов с частотой наступления спонтанной беременности 28,7% в течение 1 года. Однако, согласно графику расчета EFI, частота наступления спонтанной беременности у данной категории женщин должна была составить 45%, что еще раз подтверждает невысокую прогностическую точность данной системы, о чем и упоминали авторы данной методики. Учитывая результаты исследований по иммунным механизмам развития генитального эндометриоза и связанного с ним бесплодия, полученные в нашей лаборатории за последние 20 лет [11], мы сосредоточились на наиболее прогностически значимых показателях гуморального и врожденного иммунитета: содержании общего количества В-лимфоцитов (CD20+), В1-клеток (CD20+CD5+), CD86+-нейтрофилов, IL-1β+-моноцитов и сывороточном уровне sRAGE.
Нами выявлено, что женщины, забеременевшие в течение года после лапароскопии, имели отличия в иммунологических показателях от пациенток, которые не смогли забеременеть. Беременность наступила у женщин, которые характеризовались сниженными значениями CD20+, CD20+CD5+-лимфоцитов, CD86+-нейтрофилов и повышенными показателями – IL-1β+-моноцитов в крови (табл. 1, 2). А пациентки, характеризовавшиеся высокими показателями sRAGE в сыворотке крови перед проведенным лечением, в течение 1 года после лапароскопии не сумели забеременеть (табл. 2).
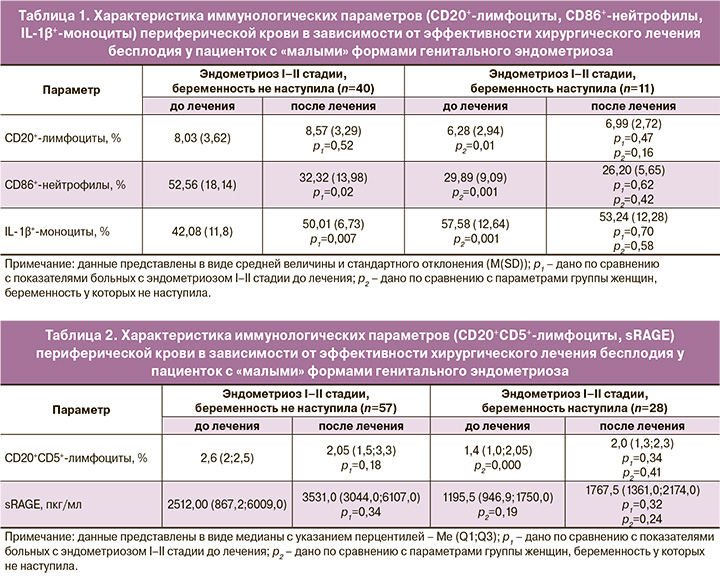
Был выполнен ROC-анализ данных иммунологических показателей с целью использования их в дальнейшем для прогноза наступления беременности после хирургического лечения. Данные, характеризующие площадь под кривой, а также чувствительность и специфичность оцениваемых показателей, представлены в таблице 3 и на рисунках 1–3.
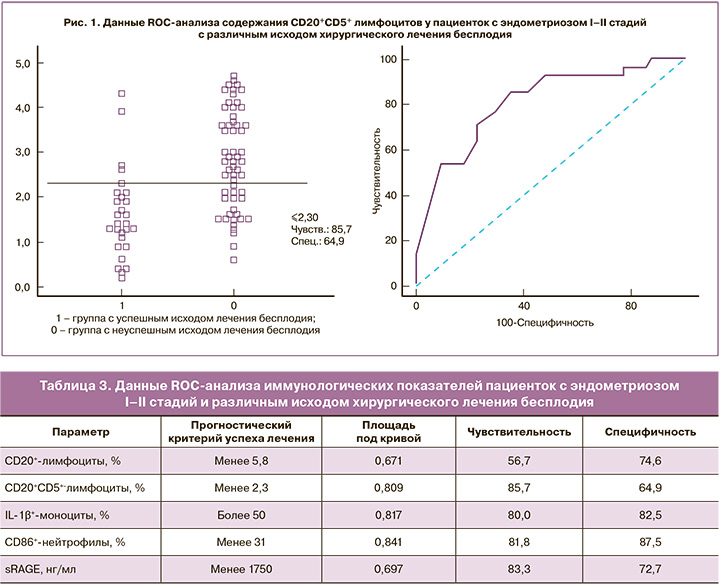
Как видно из полученных результатов, такие параметры, как уровень CD20+-лимфоцитов и sRAGE в периферической крови, обладают низкой прогностической значимостью с достаточно низкой чувствительностью (56,7%). Однако показатели содержания В1-лимфоцитов (CD20+CD5+), которые являются одними из основных продуцентов аутоантител, IL-1β+-моноцитов и CD86+-нейтрофилов, свидетельствующие о наличии системных воспалительных реакций и гиперактивации фагоцитов, обладают высокой чувствительностью и специфичностью.
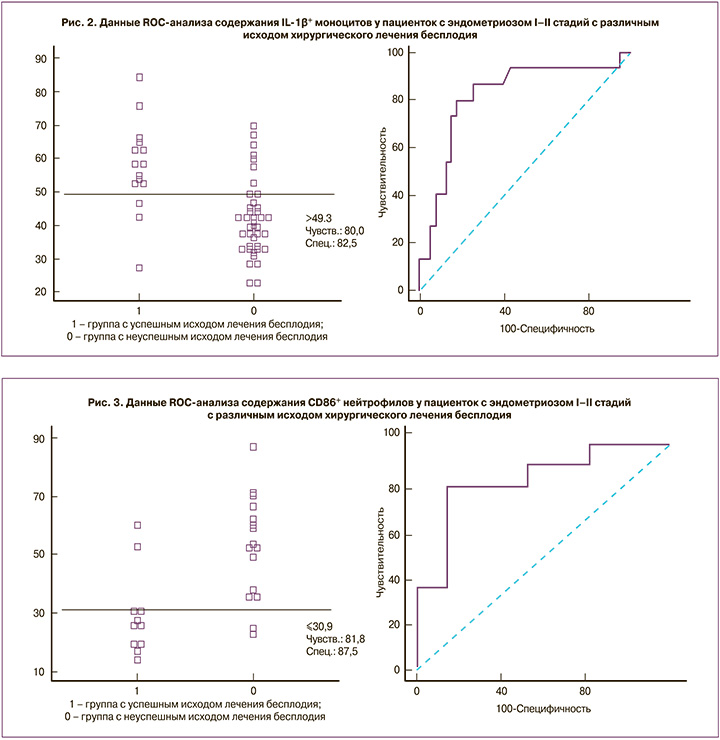
В соответствии с данными ROC-анализа, нами был выбран прогностический порог для показателя CD20+CD5+-лимфоцитов – 2,3% (Патент №2291439 от 10.01.2007 г.), для CD86+-нейтрофилов – 31% (Патент №2613313 от 15.03.2017 г.) и для IL-1+-моноцитов – 50% (Патент №2557923 от 30.06.2015 г.). Данная триада показателей и легла в основу прогнозирования эффективности хирургического лечения бесплодия у пациенток активного репродуктивного возраста с «малыми» формами генитального эндометриоза еще на дооперационном этапе.
В тех случаях, когда у пациенток до проведения лапароскопии относительное содержание CD20+CD5+-лимфоцитов было равно или менее 2,3%, CD86+-нейтрофилов – равно или менее 31% и IL-1+-моноцитов – равно или более 50%, прогнозируется успех хирургического лечения генитального эндометриоза и спонтанное наступление беременности в течение года после лапароскопии. Напротив, при отклонениях от прогностических значений хотя бы одного показателя прогнозируется отсутствие успеха хирургического лечения генитального эндометриоза и бесплодия с точностью прогноза 79,2%.
Обсуждение
Полученные нами данные позволяют говорить об увеличении сывороточного содержания sRAGE, что может служить маркером усиления воспалительного ответа при «малых» формах генитального эндометриоза и бесплодия [10]. Доказано, что при данном заболевании происходит активация реакций адаптивного иммунитета, на что указывает повышение уровня нейтрофилов, экспрессирующих костимуляторные молекулы CD86, которые являются индукторами развития Т-хелперов 2 типа и иммунного ответа с повышением интенсивности гуморальных реакций. Этому соответствует и повышение уровня В1-лимфоцитов с усилением продукции аутоантител [12].
Известно, что система интерлейкина-1β играет важную роль в регуляции репродуктивных процессов, в частности, в обеспечении рецептивности эндометрия [13], способствует успешному наступлению беременности [14], в том числе у пациенток, участвующих в программе ЭКО [15]. Сниженная внутриклеточная продукция IL-1β моноцитами крови у женщин с бесплодием при I–II стадии генитального эндометриоза может быть причиной нарушения процессов имплантации [11]. В настоящее время считается, что основные иммунологические составляющие генитального эндометриоза: усиленная системная продукция провоспалительных цитокинов, дефект функции моноцитов, активация В-лимфоцитов с избыточной выработкой аутоантител, направлены на поддержку хронического воспаления. Данные изменения могут напрямую влиять на фертильность при эндометриозе [11].
Заключение
Успех хирургического лечения по восстановлению репродуктивной функции у пациенток с «малыми» формами генитального эндометриоза во многом зависит от исходного иммунологического фона.
Триада показателей содержания в периферической крови В1-лимфоцитов, IL-1β+-моноцитов и CD86+-нейтрофилов позволяет прогнозировать эффективность в течение 1 года хирургического лечения бесплодия у пациенток активного репродуктивного возраста с данной патологией еще на дооперационном этапе.
Своевременное прогнозирование эффективности хирургического лечения на основании иммунологических критериев позволит выбрать оптимальную тактику ведения таких пациенток без потери драгоценного времени.



