В настоящее время задержка роста плода (ЗРП) остается одной из актуальных проблем современного акушерства, а ее частота не имеет тенденции к снижению, составляя 5–18% [1–3]. Несмотря на вариацию частоты ЗРП среди различных популяций, согласно эпидемиологическим исследованиям, она ассоциирована с неизменно высокой перинатальной заболеваемостью и смертностью. Вместе с тем отсутствие единой системы прогностических и диагностических критериев ЗРП приводит к недостаточной эффективности ее антенатального выявления [4–6].
В последние годы перспективным неинвазивным маркером для прогнозирования и своевременной диагностики различных осложнений беременности является изучение внеклеточной фетальной ДНК (вфДНК), выделение которой в материнский кровоток происходит преимущественно за счет процессов дифференцировки трофобласта [7–9]. Особое значение отводится определению данного маркера при ЗРП, так как последняя относится к плацента-ассоциированным осложнениям беременности [10, 11]. Концепция о плацентарном происхождении вфДНК является общепринятой и находит подтверждение во многих исследованиях [12–15]. К основным механизмам ее происхождения в настоящее время относят, помимо апоптоза, сопровождающего нормальное развитие плаценты, высвобождение вфДНК в материнский кровоток за счет процессов некроза и апонекроза клеток, прямого переноса ДНК через плаценту или амниотические оболочки [16, 17]. Среди причин изменения ее содержания указывают как усиление процессов высвобождения нуклеиновых кислот в материнский кровоток, так и снижение их клиренса. Проведенные исследования по изучению вфДНК при ЗРП неоднозначны и часто противоречивы.
Так, D. Morano et al. [18] установили различия в содержании вфДНК при ранней и поздней формах ЗРП и получили взаимосвязь низких концентраций вфДНК с малой массой плаценты и плацентарной недостаточностью. Вместе с тем до настоящего времени открытым остается вопрос о причинах изменения содержания вфДНК при данном осложнении беременности.
Таким образом, интерес представляет определение прогностической и диагностической значимости вфДНК при ЗРП с изучением взаимосвязи с морфологическими особенностями плаценты, что позволит не только уточнить механизмы развития данного осложнения беременности, но и выделить новый неинвазивный маркер.
Цель исследования: изучить взаимосвязь изменения уровня вфДНК с морфологическими особенностями плаценты при ЗРП с определением ее прогностической значимости.
Материалы и методы
Согласно критериям включения и невключения, в исследование вошли 93 беременные. Из них основную группу (I) составили 48 беременных с ЗРП (23 – с ранней и 25 – с поздней формой), а группу II (сравнения) – 45 пациенток, у которых беременность протекала без осложнений.
Критериями включения в исследование для обеих групп являлись возраст пациенток от 18 до 45 лет, одноплодная беременность в сроке 22–40 недель, наличие добровольного информированного согласия, одобренного этическим комитетом. Для основной группы – беременность, осложнившаяся ЗРП. Критерии исключения: тяжелая экстрагенитальная патология, многоплодная беременность, наступившая после донации ооцита, пороки развития плода, генетические заболевания матери и плода, острая фаза или обострение хронических инфекционных заболеваний у матери, миома матки больших размеров.
Всем пациенткам, включенным в исследование, был выполнен стандартный набор обследования согласно приказу Министерства здравоохранения Российской Федерации от 01 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология” (за исключением использования вспомогательных репродуктивных технологий)». Были изучены клинико-анамнестические данные, особенности течения беременностей и родоразрешения, а также состояние плодов и новорожденных.
Специальные методы исследования включали полимеразную цепную реакцию в режиме реального времени с целью определения вфДНК в плазме материнской крови, гистохимическое исследование c применением метода терминального дезоксиуридинового мечения концов (TUNEL) и иммунофлуоресцентный анализ для исследования плацент.
Статистический анализ
Для статистического анализа и построения графиков использовались пакеты статистических программ Statistica 10 и OriginPro 8.5 (США). Для проверки гипотезы о нормальном распределении использовался критерий Шапиро–Уилка, для проверки равенства дисперсий – критерий Левина. При несоблюдении условий нормального распределения статистический анализ проводился с помощью непараметрических критериев Манна–Уитни и коэффициента ранговой корреляции по Спирмену. Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Для оценки диагностической эффективности исследуемого метода использовался ROC-анализ. Данные ROC-анализа представлены в виде площади под кривой с 95% доверительным интервалом (ДИ). Для всех видов анализа статистически значимыми считали значения p<0,05.
Результаты и обсуждение
Все беременные, вошедшие в исследование, были сопоставимы по основным клинико-анамнестическим показателям. Средний возраст составил 34 (29;35) и 32 (29;34) года соответственно по группам. Статистически значимых различий в структуре соматических и гинекологических заболеваний выявлено не было. Следует отметить более высокую частоту угрозы прерывания беременности и маловодия при ЗРП.
 Учитывая данные о том, что уровень вфДНК увеличивается со сроком беременности, пациентки были включены в исследование по методу подбора пар с учетом гестационного срока. Таким образом, медиана сроков в исследуемых группах была сопоставима, что позволило в дальнейшем оценить полученные результаты.
Учитывая данные о том, что уровень вфДНК увеличивается со сроком беременности, пациентки были включены в исследование по методу подбора пар с учетом гестационного срока. Таким образом, медиана сроков в исследуемых группах была сопоставима, что позволило в дальнейшем оценить полученные результаты.
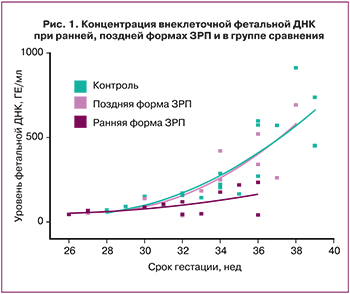
Концентрация вфДНК в зависимости от срока беременности при ранней и поздней формах ЗРП, а также в группе сравнения представлена на рисунке 1.
Уровень вфДНК при ранней форме ЗРП составил 89,03 (44,52;178,32) ГЕ/мл и был статистически значимо ниже показателей при поздней форме ЗРП – 244,14 (145,23;422,47) ГЕ/мл и группы сравнения – 211,05 (133,64;567,81) ГЕ/мл (p<0,001). При этом статически значимых различий между поздней формой ЗРП и группой сравнения получено не было (p>0,05). Результаты исследования представлены на рисунке 2.
Принимая во внимание данные литературы о взаимосвязи между уровнем вфДНК и массой плаценты, а также полученные результаты, указывающие на статистически значимое снижение уровня вфДНК только при ранней форме ЗРП, следующим этапом исследования было определение взаимосвязи между уровнем вфДНК и клиническими критериями с использованием непараметрического метода ранговой корреляции по Спирмену. В качестве порога значимости использовали значение p-value <0,05 (таблица).

Масса плацент в группе ранней формы ЗРП составила 248 (228;307) г, что было статистически значимо ниже данного показателя в группе поздней формы ЗРП – 335 г (305;380; p<0,05) и в группе сравнения – 432 г (340;471; p<0,001). Анализ установил прямую сильную корреляционную связь между уровнем вфДНК, массой плаценты (r=0,79; p<0,001), массой (r=0,72; p<0,001) и длиной (r=0,71; p<0,001) новорожденного в группе ранней формы ЗРП.
Особый интерес представлял анализ взаимосвязи с перинатальными исходами. Сильная обратная корреляционная связь была получена с врожденной пневмонией (r=-0,73; p=0,03), внутрижелудочковыми кровоизлияниями (r=-0,74; p=0,03), некротизирующим энтероколитом (r=-0,72; p=0,03) и асфиксией тяжелой степени (r=-0,75; p=0,03).
С целью оценки диагностической эффективности количественного определения вфДНК для ранней формы ЗРП был проведен ROC-анализ, который продемонстрировал, что измерение концентрации вфДНК в плазме материнской крови при пороговом значении вфДНК 119,11 ГЕ/мл позволяет с высокой чувствительностью (73,1%) и специфичностью (79,3%) (AUC=0,81; 95% ДИ 0,63–0,98) диагностировать раннюю форму ЗРП и предсказывать вероятность развития таких осложнений раннего неонатального периода, как врожденная пневмония, внутрижелудочковые кровоизлияния, некротизирующий энтероколит и асфиксия тяжелой степени у новорожденных с ранней формой ЗРП (рис. 3).
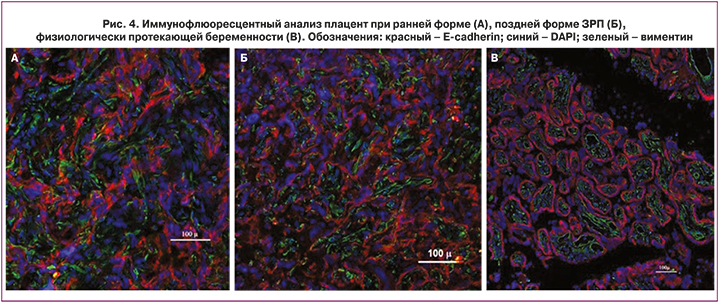
Для расширения представления о механизмах, лежащих в основе полученных изменений, следующим этапом исследования явился иммунофлуоресцентный анализ плацент при ранней и поздней формах ЗРП (рис. 4). При ранней форме ЗРП было выявлено отсутствие нормальной архитектоники. Отмечались тесно расположенные по отношению друг к другу промежуточные незрелые ворсины и промежуточные зрелые ворсины с доминированием стромального компонента и гипоплазией капилляров. Избыточное отложение перивиллезного фибриноида, по-видимому, приводило к формированию афункциональных зон и уменьшению объема межворсинчатого пространства. Также обнаружены хаотичные склерозированные ворсины с увеличенным количеством стромальных клеток и единичными микрососудами. Описанные изменения гипоплазии дистальных отделов ворсин ассоциированы с неполной гестационной трансформацией спиральных артерий и являются проявлением материнской мальперфузии (рис. 4А). Исследование плацент при поздней форме ЗРП показало сохранение дифференцировки ворсин. В зрелых ворсинах были выражены компенсаторно-приспособительные реакции. Повышение активности синцитиотрофобласта приводило к образованию крупных синцитиальных узлов, которые располагались на ножке и состояли из плотно расположенных ядер синцитиотрофобласта, а также к увеличению объема капилляров. При этом были зафиксированы небольшие фокусы фибриноида, которые не приводили к снижению интервиллезного объема. Было отмечено небольшое количество промежуточных незрелых, промежуточных зрелых и хаотичных склерозированных ворсин (рис. 4Б). Плаценты в группе контроля характеризовались преобладанием терминальных и зрелых промежуточных ворсин, а также свободных от инкрустирующих депозитов фибриноида. Было отмечено, что доля терминального ворсинчатого эндотелия превосходила стромальный компонент (рис. 4В).
Полученные результаты указывают на наличие прямой корреляционной связи между уровнем вфДНК с массой плацент и послужили одним из косвенных подтверждений плацентарного происхождения вфДНК, что перекликается с рядом исследователей. Кроме того, обнаруженные при проведении иммунофлюоресцентного анализа особенности архитектоники плаценты в виде преобладания процессов фиброза и формирования обширных зон фибриноида, с одной стороны, объясняют снижение вфДНК, с другой – обосновывают развитие плацентарной перфузии и, как следствие, – формирование ЗРП.
В настоящее время оценка прогностической и диагностической ценности вфДНК как одной из наиболее изученных неинвазивных биомолекул остается важной задачей современного акушерства, что во многом связано с изменением уровня данного маркера до клинической манифестации различных осложнений беременности.
Заключение
Таким образом, результаты проведенного исследования установили диагностически значимые уровни вфДНК, позволяющие верифицировать формы ЗРП и свидетельствующие о различных механизмах их формирования. Определение вфДНК позволяет прогнозировать риск рождения детей с низкими массо-ростовыми показателями. Полученные данные о высокой диагностической значимости вфДНК в отношении ранней формы ЗРП обосновывают перспективность применения вфДНК в качестве важного прогностического маркера.



