Исследования Центра демографии и экологии человека свидетельствуют о том, что самая быстрорастущая категория населения – женщины старше 65 лет [1]. Долголетие сопровождается развитием связанных с возрастом дегенеративных изменений, среди которых особое внимание специалистов в последнее время привлекает саркопения [2]. По мнению Американского центра по контролю и профилактике заболеваний (CDС), саркопения – один из пяти факторов риска заболеваемости и смертности в группе лиц старше 65 лет. Согласно мета-анализу 17 исследований, риск смерти в 4 раза выше, а инвалидность в 3 раза чаще возникает у людей с саркопенией, чем в том же возрастном периоде при ее отсутствии [3].
Термин «саркопения» произошел от греческих слов «sarx» – тело и «penia» – потеря; заболевание представляет собой дегенеративный процесс, который характеризуется постепенным уменьшением функциональных мышечных волокон [4]. Атрофия мышц, связанная с возрастом, описана еще Гиппократом, однако вплоть до начала XX столетия данная проблема не была широко обсуждаемой. Первой статьей, посвященной саркопении, была опубликованная в 1931 г. в журнале Lancet работа английского невролога Critchley M., в которой ассоциированные с возрастом преобразования мышечной ткани получили термин «сенильная атрофия» [5]. В 1970-х гг. была представлена серия исследований, посвященных возрастной трансформации мышечной ткани, возглавляемая Shock N. [6]. В 1989 г. профессор Rosenberg I. (США) впервые дал определение саркопении, как возрастному снижению массы и силы скелетных мышц. В настоящее время определение и критерии диагностики саркопении разработаны тремя сообществами: ESPEN-SIG (Европейское общество по клиническому питанию и обмену веществ), IWGS (Международная рабочая группа по саркопении) и EWGSOP (Европейская рабочая группа по саркопении у пожилых людей). Дефиниция саркопении, принятая Первым консенсусом в 2010 г., была пересмотрена в 2018 г. и определяет ее как «синдром, характеризующийся прогрессирующей и генерализованной потерей скелетной мышечной массы и силы, который приводит к повышению риска развития таких неблагоприятных событий, как физическая нетрудоспособность, низкое качество жизни и смерть» [7]. Критериями диагностики саркопении являются уменьшение мышечной силы, снижение мышечной массы и ограничение функциональной способности мышц [4, 8]. Представленный синдром, как правило, редко бывает изолированным и часто регистрируется совместно с остеопорозом, саркопеническим ожирением или обоими нарушениями состава тела [9, 10]. Кроме того, здоровье пациентов с саркопенией характеризуется повышением частоты инсулинорезистентности, сахарного диабета 2 типа и кардио-васкулярных заболеваний [11–13].
В 2016 г. саркопения, как самостоятельная нозологическая единица, включена в международную классификацию заболеваний; в МКБ-10 саркопения имеет код М62.5 − истощение и атрофия мышц, не классифицированные в других рубриках.
Частота саркопении в популяции зависит от возрастной когорты и составляет от 4,3 до 73,3% [14]. По данным исследований, расцвет мышечной ткани у женщин приходится на 25 лет. Уменьшение мышечной массы происходит с 30 лет − 0,5–1% в год, а начиная с 50 лет эта цифра возрастает до 1–2%.
Выделяют две формы саркопении: первичную и вторичную. Первичная связана с возрастными дегенеративными изменениями мышечной ткани, а вторичная формируется в результате заболеваний и патологических состояний (сахарного диабета второго типа, гиподинамии, злокачественных новообразований), применения некоторых лекарственных средств.
Патогенез саркопении
Функциональной единицей скелетной мышцы является «нейромоторная единица». Она состоит из совокупности мышечных волокон и двигательного нейрона. Каждая мышца представлена множеством нейромоторных единиц, что приводит к ее сокращению не общей массой, а фрагментами, в зависимости от зоны иннервации. Выделяют два типа мышечных волокон: медленный и быстрый. Первый (медленный) тип участвует в движениях, не требующих серьезных усилий, в частности, в поддержании позы; в этих волокнах содержится большое количество митохондрий с высокой ферментативной активностью. Второй тип мышечных волокон (быстрый), реализует кратковременные быстрые движения, например, подъем со стула; им присуща высокая активность ферментов гликолиза [15]. В процессе старения потери наблюдаются со стороны мышечных волокон обоих типов, но преимущественно, волокон второго (быстрого) типа [16, 17].
Зрелые мышечные волокна представлены многоядерными клетками, не способными к делению; их рост и регенерация происходит за счет клеток-сателлитов, расположенных на поверхности миоцитов. Количество этих клеток-сателлитов при саркопении уменьшено, так же, как и число волокон второго типа, что ограничивает совершение быстрых, рывковых движений [7]. Гиподинамия и детренированность мышц, сопровождающиеся снижением адекватного биогенеза митохондрий миоцитов, приводят к более раннему старению мышечной ткани. При увеличении воздействия окислительного стресса постоянно возрастает митохондриальная дисфункция мышечной ткани, которая из функциональной превращается в морфологическую [18]. Независимый механизм метаболической ауторегуляции, имеющийся в мышечной ткани, функционирует при условии совершения человеком умеренных ежедневных физические нагрузок, которые способствуют секреции миокинов.
 Исходя из современных знаний о мышечной ткани, ее можно рассматривать как эндокринный орган в силу того, что она способна вырабатывать множество биологически активных веществ, именуемых миокинами (рис. 1) [19].
Исходя из современных знаний о мышечной ткани, ее можно рассматривать как эндокринный орган в силу того, что она способна вырабатывать множество биологически активных веществ, именуемых миокинами (рис. 1) [19].
Миокины (каковых на сегодняшний день известно несколько десятков), продуцируемые мышечными клетками, обладают эндокринными паракринными и аутокринными свойствами. Именно воздействием миокинов можно объяснить положительное влияние физических нагрузок на костную и жировые ткани, сердце, мозг, печень и почки [21].
Мышечная ткань находится под контролем гормонов – в миоцитах обнаружены рецепторы к половым, тиреоидным, надпочечниковым гормонам, соматотропному гормону (СТГ), инсулину [22]. Увеличение концентрации кортизола, происходящее с возрастом, усугубляет окислительный стресс и возраст-ассоциированное снижение тиреоидных гормонов, что оказывает негативное влияние на функции митохондрий миоцитов [23]. Играет роль и возрастной дефицит дегидроэпиандростерона сульфата (ДГЭА-С), который имеет место у женщин старше 30 лет [24]. СТГ обладает анаболическим эффектом в отношении мышечной ткани, стимулируя продукцию инсулиноподобного фактора роста-1, участвующего в регуляции метаболизма митохондрий [3]. Снижение секреции СТГ происходит в результате увеличения возраста, уменьшения уровня тиреоидных гормонов, мелатонина, а также при гипергликемии и ожирении [25].
Особый интерес представляет наличие связи между состоянием мышечной ткани и уровнем половых гормонов. Известно, что тестостерон обладает протекторным действием в отношении митохондрий и снижает продукцию интерлейкинов (ИЛ)-1, ИЛ-6, обладающих катаболическим влиянием на мышечную ткань [26]. Влияние эстрогенов может сопровождаться анаболическим эффектом на мышечное волокно через β-эстрогеновые рецепторы (ЭР), а также вследствие конверсии в тестостерон [27]. Кроме того, эстрогены оказывают действие на продукцию СТГ, инсулиноподобного фактора роста-1, выработку провоспалительных цитокинов, играют важную роль в регулировании углеводного и липидного обмена [28]. Сниженные уровни половых стероидов, статистически значимо связаны с развитием инсулинорезистентности – одного из важных механизмов формирования саркопении, приводящей к ускорению деградации мышечных белков за счет нарушения утилизации глюкозы в мышечной ткани [23].
Роль витамина D в формировании саркопении является предметом дискуссий. С одной стороны, имеются данные, что снижение его концентрации на 10 нг/мл увеличивает частоту саркопении в 1,5 раза на протяжении 5 лет. С другой стороны, исследований, имеющих высокую доказательную силу, недостаточно, чтобы подтвердить значимую роль витамина D в развитии саркопении [29]. Имеются сведения о роли дефицитов других микронутриентов (кальций, омега, левокарнитин) в генезе саркопении [30].
Старение связано с повышением уровня провоспалительных цитокинов: фактора некроза опухоли-α, ИЛ-6, ИЛ-1 и С-реактивного белка, свидетельствующих о наличии системного характера воспаления [31]. В качестве патогенетических механизмов развития саркопении также рассматриваются возрастные нейродистрофические процессы в мышечной ткани, образ жизни (рацион питания и физическая активность), подчеркивается значение фетального программирования [32, 33]. Генетическая предрасположенность к саркопении доказана взаимосвязями ряда генов, кодирующих ангиотензин-превращающий фермент, ИЛ-6, рецептор витамина D, с функциональным состоянием мышечной ткани. Наследственная предрасположенность к саркопении, по данным некоторых исследований, приближается к 80,0% [34].
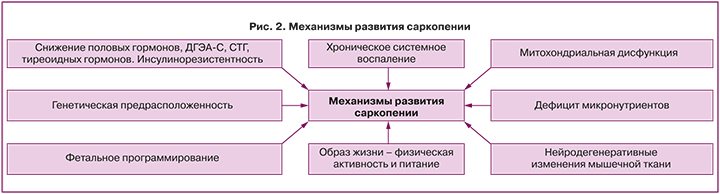
Саркопению сегодня рассматривают, как полиэтиологическое заболевание со сложным патогенезом, основные механизмы которого представлены на рисунке 2.
Клиника
Клинически саркопения манифестирует снижением объема и силы мышц, а также уменьшением физической активности пациента. Страдающие саркопенией имеют трудности при выполнении простых функциональных действий: при подъеме со стула, передвижении по лестнице или восстановлении осанки после нарушения равновесия.
Диагностика саркопении
Диагностика саркопении проводится с помощью специальных тестов и измерения мышечной силы и массы. По данным EWGSOP (2018), главным критерием в постановке диагноза является оценка мышечной силы, а не мышечной массы. Для диагностики саркопении применяются различные анкеты-опросники Sarcopenia and Quality of Life – качество жизни при саркопении (SarQol) и Strength, Assistance with walking, Rise from a chair, Climb stairs and Falls (SARC-F) [3]. Стандартный метод диагностики саркопении, согласно рекомендациям EWGSOP, – оценка скорости ходьбы на расстояние 4 м. Скорость менее 0,8 м/с свидетельствует о наличии саркопении. Определение мышечной силы проводится с помощью кистевых динамометров, а мышечная масса исследуется посредством денситометрии (двухэнергетической рентгеновской абсорбциометрии, DXA) и биоимпедансного анализа [35]. Индекс тощей массы (ИТМ) скелетных мышц рассчитывается по формуле: аппендикулярная мышечная масса (АММ, полученная как сумма тощей массы рук и ног), деленная на квадрат роста пациента в метрах, то есть АММ/рост², и измеряется в кг/м². Снижение ИТМ более чем на 2 стандартных отклонения (ИТМ у женщин – менее 5,5–5,75 кг/м²) является критерием диагностики саркопении [36].
Терапия саркопении
Терапия базируется на трех составляющих: физические упражнения, потребление белка, применение медикаментозных средств. Конечной целью воздействия является возрастание продукции белка и замедление его распада. На сегодняшний день лекарственных средств, которые были бы зарегистрированы для лечения саркопении, не существует. Регулярные физические упражнения способствуют образованию мышечного белка; их выполнение приводит к увеличению мышечной силы и массы. Рекомендации по выполнению физических упражнений различны − от 20 минут 3 раза в неделю до 40 минут 3–6 раз в неделю. Позитивное воздействие физической активности на мышечную массу у пожилых пациентов зарегистрировано в 82,8% [37]. Белковая пища является фактором положительного влияния на регуляторные молекулы и факторы роста, способствует лучшей абсорбции кальция, подавляющего избыточную секрецию паратгормона. Согласно рекомендациям ESPEN (Европейского общества клинического питания и обмена веществ), оптимальный уровень потребления белка для пожилых людей должен составлять 1–1,5 г на кг массы тела в день; также целесообразно применение витамина D, который позитивно влияет на состояние мышц и костей, снижает риск падений и переломов. Вопрос об оптимальной дозе ежедневного приема витамина D до сих пор не определен. По рекомендациям ESCEO прием витамина D (800 МЕ/сутки) должен сочетаться с потреблением кальция (1000 мг/сутки) и регулярной физической активностью 3–5 раз в неделю [38].
Результаты исследований по использованию гормонов при саркопении противоречивы. Согласно одним исследованиям, прием половых гормонов − эстрогенов и тестостерона не оказывал существенного действия на мышечную силу; данные канадского систематического обзора и мета-анализа, проведенного в 2019 г., не показали взаимосвязи гормонотерапии с увеличением мышечной массы [39]. Также другое исследование показало, что лечение эстрадиолом в периоде постменопаузы не приводило к увеличению силы и массы мышц, однако было отмечено, что использование тестостерона и прогестерона наполовину увеличивает синтез мышечных белков [40].
Ряд научных публикаций свидетельствует о том, что менопаузальная гормональная терапия защищает женщин от потери мышечной ткани. Например, в ходе WHI (Women’s Health Initiative trial) при изучении композиционного состава тела женщины, получавшие комбинированную эстроген-гестагенную терапию, не теряли мышечную массу по сравнению с участницами, получавшими плацебо [28]. В исследовании Park Y.M. et al. при сравнении биоптатов мышечной ткани, полученных у женщин в ранней постменопаузе и в поздней постменопаузе обнаружено: (1) снижение экспрессии ЭРα и ЭРβ в ядрах клеток скелетных мышц у женщин в поздней постменопаузе, по сравнению с ранней постменопаузой; (2) кратковременное лечение эстрадиолом не приводило к изменению экспрессии ядерных ЭРα или ЭРβ, но снижало число ЭРα в цитоплазме, поэтому пропорция ЭРα в ядрах клеток скелетных мышц имела тенденцию к повышению, по сравнению с цитоплазмой; (3) назначение эстрадиола повышало экспрессию ключевых регуляторов клеточных биоэнергетических путей, таких, как коактиватор 1 альфа гамма-рецептора-активатора пролиферации пероксисом, регулирующий гены, связанные с энергетическим обменом; и клеточную протеинкиназу, контролирующую энергетический баланс клетки, у женщин в ранней постменопаузе, но не в поздней постменопаузе [41]. Представленные результаты позволяют предположить, что экспрессия ЭР уменьшается пропорционально длительности постменопаузы и что назначение эстрадиола регулирует энергетический гомеостаз только у женщин в ранней постменопаузе. Исследование Kim S.-W. et al. (2018) продемонстрировало положительное влияние продолжительной менопаузальной гормонотерапии на возрастную потерю массы мышц [42].
Ряд авторов свидетельствуют о положительном воздействии терапии ДГЭА на силу и длину мышечных волокон у женщин. Однако доказательная база отсутствует. Применение СТГ для лечения саркопении показало минимальную результативность или ее отсутствие в различных исследованиях [43].
Перспективы фармакотерапии саркопении включают использование нестероидных анаболических препаратов, в частности, левокарнитина (аминокислота, являющаяся корректором энергетического обмена). Для борьбы с саркопенией оцениваются потенциальные возможности селективных модуляторов андрогенных рецепторов, ингибиторов миостатина, ангиотензин-превращающего фермента, грелина и эйкозапентаеновой кислоты [44].
Заключение
Таким образом, саркопению следует рассматривать, как атрибут постменопаузы, снижающий качество жизни и уменьшающий ее продолжительность. В связи с этим требуется дальнейшее изучение механизмов развития этого заболевания, разработка и внедрение в клиническую практику лечебно-диагностических методик, направленных на профилактику и терапию саркопении в постменопаузе. Реализация таких программ реально возможна в рамках междисциплинарного взаимодействия акушеров-гинекологов, терапевтов, эндокринологов, неврологов и специалистов восстановительной медицины. Помимо поддержания оптимального белкового обмена и регулярных умеренных физических упражнений необходимо оценить роль персонифицированной менопаузальной гормональной терапии для сохранения адекватного метаболизма мышечной ткани и профилактики саркопении.



