Уровень рождаемости в промышленно развитых странах неуклонно падает на протяжении последних 40 лет [1]. Помимо социально-экономических факторов, рождаемость ограничивает ухудшение репродуктивного здоровья населения. По оценке ВОЗ, порядка 80 млн пар неспособны зачать ребенка без медицинской помощи, из них 5 млн – в России, что составляет 15% населения репродуктивного возраста. Согласно мировой статистике, около 40% случаев бесплодия связаны с мужским фактором [2]. Мужское бесплодие может быть связано с различными врожденными и приобретенными состояниями: урогенитальные инфекции, генетические нарушения, крипторхизм, варикоцеле, гипогонадизм, эякуляторные нарушения, общие и системные заболевания, иммунологические факторы, идиопатическое бесплодие. Немаловажными факторами являются также образ жизни и влияние вредных факторов окружающей среды. Согласно докладу ВОЗ (2013) и Программе ООН по окружающей среде, производство и воздействие химических веществ могут повлечь за собой серьезные нарушения работы эндокринной системы человека, что, соответственно, влечет за собой падение фертильности [3]. Так, например, три крупных банка спермы в Китае сообщили о резком снижении качества спермы доноров из городов, которые претерпели сильнейшее загрязнение в связи с промышленным ростом [4].
Успешное внедрение в программы экстракорпорального оплодотворения технологии интрацитоплазматической инъекции сперматозоида в цитоплазму ооцита, к сожалению, смещает акцент от выявления этиологии бесплодия у мужчин и оценки их фертильности к улучшению эмбриологических аспектов вспомогательных репродуктивных технологий (ВРТ). Между тем многочисленные клинические и научные вопросы репродуктивной андрологии остаются без ответа; в частности, отсутствует какой-либо реальный прогресс в разработке надежных методов для анализа спермы. Базовый анализ спермы обладает ограниченной ценностью для прогнозирования как достижения естественной беременности, так и результатов использования методов ВРТ [5]. Зачастую мужчины с нормальными показателями спермограммы остаются бесплодными. Именно поэтому необходимо расширять возможности тестирования функциональных характеристик эякулята. Анализ фертильности мужчин должен представлять собой комплексный процесс, включающий оценку образа жизни, психологического состояния, общего здоровья репродуктивной системы, показателей спермограммы и дополнительных критериев оценки семенной жидкости. Для обработки такого количества клинических данных пациентов и выявления закономерностей необходима разработка систем анализа качества спермы на основе алгоритмов машинного обучения. Подобная система была описана Abdulkerim М. Yibre (2021), однако она пока широко не востребована в силу своей сложности [6]. Важной задачей является разработка простых в использовании объективных методов анализа спермы и тест-систем, в том числе для предварительной диагностики, облегчающих работу лабораторному персоналу, ускоряющих процедуру анализа и постановку диагноза, а также позволяющих мужчинам следить за состоянием своего здоровья. Наиболее перспективным техническим решением для такого рода задач является использование волоконно-оптических датчиков на базе микроструктурных волноводов, благодаря анализу малых объемов проб, высокой точности и специфичности [7].
Недавно опубликована работа, которая посвящена использованию искусственного интеллекта (ИИ) и нейронных сетей (НС) для предварительной оценки характеристик спермы и прогнозирования результатов анализа спермы на основе основной анкеты пациента [8]. Были описаны две модели НС, разработанных на основе анкеты пациента, которая включала в себя 11 вопросов. Одна из моделей направлена на прогнозирование общих показателей спермы, а вторая — на оценку концентрации спермы. Точность НС в тестовом образце составила 80,95 и 85,71% соответственно. Аналогичное исследование показано профессором Ma J. et al. в 2018 г. [9]. На основе данных о состоянии здоровья и привычках 100 добровольцев и их анализах спермы была сопоставлена эффективность НС различных архитектур. Как показали авторы, НС с обратным распространением ошибки имела наибольшую точность для определения качества спермы.
Таким образом, НС в настоящее время успешно используются в системах медицинской диагностики, прогноза заболевания, разработки индивидуальных рекомендаций на основе специфических характеристик пациентов и других клинических проблем. Однако в репродуктивной медицине НС и ИИ пока не получили должного распространения. В настоящей работе сделана попытка использовать ИИ и волоконно-оптические методы в диагностике параметров эякулята мужчин с нормозооспермией, найти различия в спектральных характеристиках спермы при одинаковых классических показателях спермограммы, тем самым выявить дополнительные критерии оценки мужской фертильности.
Целью данной работы было установление закономерностей в спектре пропускания микроструктурных волноводов, заполненных спермой и семенной плазмой мужчин с нормозооспермией, сопоставление с данными объективного контроля и построение на данной основе НС.
Материалы и методы
Первый этап исследования был посвящен проверке того, может ли НС на основе опросника образа жизни быть инструментом для предварительной оценки и прогнозирования профиля спермы. Критериями включения были мужчины в возрасте 18–61 лет, которые обращались в отделение ВРТ (ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» МЗ РФ) для выполнения спермограммы. Результаты анализа были получены у 345 мужчин, проходящих плановое обследование по причине бесплодия. Средний возраст пациентов составил 34,7±6 лет, средний период полового воздержания до сдачи анализа – 4,1±1 сутки. В исследовании использовали следующие категории оценки спермы: нормозооспермия и любая патология (олигозооспермия (концентрация менее 13×106/мл), астенозооспермия (% прогрессивно-подвижных сперматозоидов менее 32%) и тератозооспермия (морфологически нормальных сперматозоидов менее 4%)). После сдачи эякулята до момента замораживания образцов проходило от 15 до 60 минут в зависимости от скорости разжижения эякулята. Методом простого центрифугирования (300 g в течение 10 минут) выделяли фракцию семенной плазмы и сперматозоидов. Образцы отдельно помещали в пробирки типа Эппендорф и хранили при температуре -20°С (300 μл) до изучения спектральных характеристик.
На первом этапе каждый из участников заполнил анкету с оценкой следующих параметров (в скобках приведены исходные переменные анкеты и их преобразование в ряд нормализаций входных параметров): возраст, потребление кофе, употребление алкоголя, курение, факторы, влияющие на сперматогенез (горячая ванна, сильнодействующие препараты, радиация, работа в опасных производствах), образ жизни (сидячий образ жизни), сопутствующие хронические заболевания и хирургические вмешательства.
Второй этап исследования был посвящен анализу спектральных характеристик фракции сперматозоидов и семенной плазмы с использованием оптических датчиков. Именно оптические датчики были выбраны как наиболее оптимальные, так как они имеют высокую чувствительность и разрешение при обнаружении и количественном анализе химических веществ и биологических процессов. Действие этих датчиков основано на оптических явлениях: поглощение света, отражение случайного света, люминесценция, резонанс поверхностного плазмона и эффект «фотонные зазоры полосы». В качестве сигнала оптического биосенсора были использованы параметры изменения длины волны, интенсивности, фазы и поляризации света в зависимости от концентрации определяемых веществ и влияния на них окружающей среды [10]. В настоящей работе были применены оптические датчики на базе микроструктурных волноводов с полой сердцевиной c описанными ранее характеристиками [11]. Для измерения спектральных характеристик жидких биологических образцов были использованы волноводы типа PdSh. Диаметр полой сердцевины составляет 180 микрон, оболочка состоит из каналов диаметром 17 микрон и 43 микрона. Спектр пропускания пустого волновода представлен на рис. 1.
Образцы семенной плазмы размораживали при комнатной температуре (24–26°С) в течение 20–30 минут. 10 мкл образцового супернатанта смешивали со 140 мкл воды для инъекций. Сразу после разбавления тестовым образцом в количестве 30 μл был заполнен микроструктурный волновод, установленный в измерительном блоке. В течение 1–3 минут происходило полное заполнение каналов и сердцевины волновода, после чего фиксировался спектр.
Образцы с выделенной фракцией сперматозоидов оттаивали также при комнатной температуре в течение 20–30 минут. По 30 мкл каждого образца смешивали с 300 мкл воды для инъекций. Под воздействием воды происходило гипотоническое разрушение мембраны мужских половых клеток, ДНК сперматозоидов оказывалась в растворе. Весь образец тщательно перемешивали, гомогенизировали, а затем центрифугировали при 3000 g со скоростью вращения 5000 об./мин в течение 5 минут. Для каждого полученного образца отбирали 30 мкл надосадочной жидкости и заполняли ей микроструктурный волновод, установленный в измерительный прибор. В течение 1–3 минут ожидали полного заполнения каналов волновода, после чего фиксировали спектр излучения.
Для построения моделей машинного обучения в качестве входных параметров были использованы спектральные характеристики образцов семенной плазмы и сперматозоидов человека, полученные при помощи микроструктурных волноводов. Обработку данных выполняли в несколько этапов. На первом этапе происходит базовая математическая обработка спектров – сглаживание, удаление шумов и пр. На втором этапе определяли специфичные диапазоны длин волн, на которых наиболее четко прослеживается различие образцов «нормы-патологии». Для измерения спектральных характеристик использовался спектроанализатор OceanOptics HR 4000, в качестве источника излучения использовалась галогеновая лампа, спектр которой представлен на рисунке 2.
По результатам спермограммы образцы спермы и семенной плазмы были разделены на две группы: «норма» (концентрация сперматозоидов 15 млн/мл и более, прогрессивно подвижных 32% и более, морфологически нормальных сперматозоидов 4% и более) и «патология» (любой из оцениваемых параметров эякулята и/или несколько сразу выходят за границы референсных значений). В таблице показано разделение образцов. Всего были изучено 345 образцов сперматозоидов и 209 образцов семенной плазмы.
Анализ данных осуществлялся на языке программирования Python 3.7, который является одним из самых популярных и имеет значительное количество доступных библиотек машинного обучения.
Результаты построения нейронных сетей и оценка спектральных характеристик эякулята
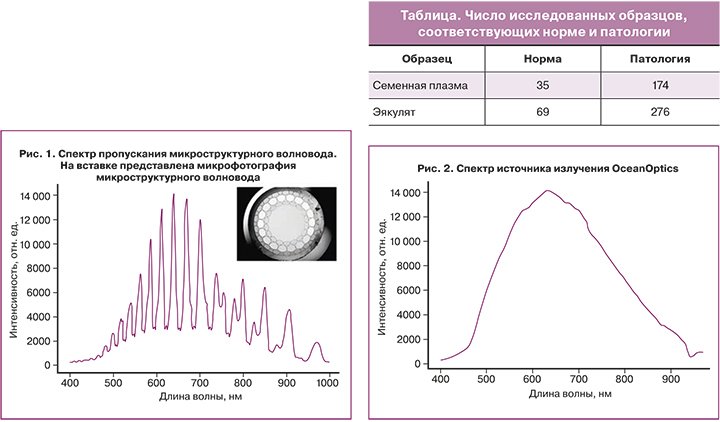
На рисунке 3 показаны средние спектральные характеристики эякулята, соответствующие нормальным значениям спермограммы и спектральным характеристикам эякулята с патологией: тератозооспермия и азооспермия.
Как было показано на рисунке 3, для таких характеристик, как морфология и подвижность, наблюдается слабая положительная корреляция. Этого оказалось достаточно для построения модели классификатора на основе метода k-ближайших соседей. Применительно к тестовой выборке модель демонстрирует достоверность около 85% и 87% для образцов семенной плазмы и эякулята соответственно. Несмотря на полученную достаточно высокую точность, данный метод имеет свои недостатки. В качестве входных характеристик для каждого образца используется его спектральная характеристика, которая представляет собой одномерный массив данных в количестве 710 элементов. Каждая точка обучающего набора имеет очевидное влияние на прогнозы, и предсказанные значения проходят через все точки данных. Увеличение числа соседей приводит к получению более сглаженных прогнозов, но при этом снижается правильность приближения к обучающим данным. Для обработки такого значительного количества признаков стоит использовать другие методы машинного обучения, например НС, для получения лучшего результата [12].
Ввиду отсутствия четких алгоритмов выбора наиболее оптимальной топологии искусственных НС и вариантов их обучения, в работе построение данных моделей осуществляли путем автоматизированного подбора топологии со следующими настройками: тип НС – многослойный перцептрон; число скрытых слоев — 4, число нейронов в скрытых слоях – 128, 20, 10, 2; функция активации нейронов скрытого слоя – сигмоидная и линейный выпрямитель. Для решения проблемы переобучения использовали метод прореживания. На рисунке 4 показана архитектура разработанный НС.
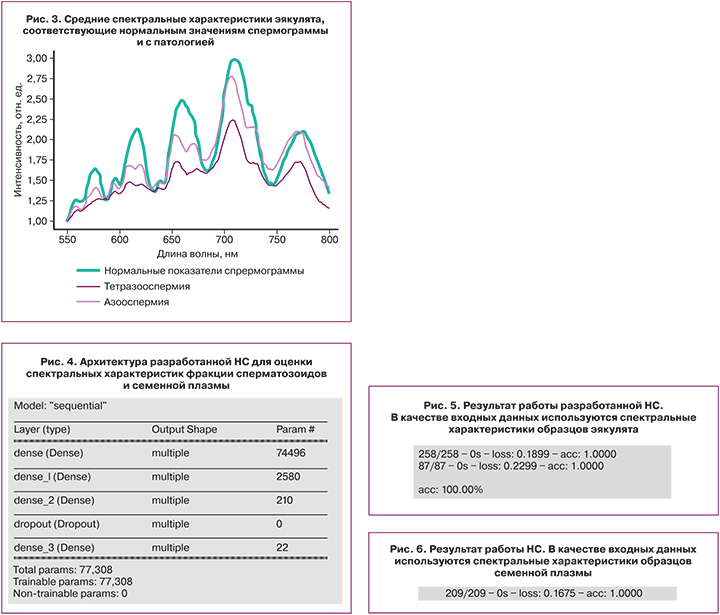
В процессе настройки НС подбирали внутренние параметры таким образом, чтобы на выходе получался ряд значений, максимально соответствующий матрице желаемых результатов для обучающего множества [13, 14]. В связи с этим наиболее распространенным критерием качества работы НС служила оценка ошибки обучения, то есть оценка разности между желаемым результатом и выходными значениями. В данной работе в качестве характеристики ошибок разработанной сети использовали среднеквадратическую ошибку. В роли критерия качества работы сети выступала доля правильно классифицированных объектов тестовой выборки. Оба выбранных критерия позволяли количественно оценить качество работы разработанной НС.
В результате обучения разработанной НС по набору спектральных характеристик как по тренировочному (258 образцов), так и по тестовому набору (87 образцов) НС показала 100% точность (рис. 5).
Интересно, что если передать обученной НС в качестве входных данных спектральные характеристики образцов семенной плазмы, то НС также покажет 100% точность предсказаний (рис. 6). Это говорит о высокой корреляции между образцом семенной плазмы и эякулята, прошедшим необходимую пробоподготовку, с точки зрения классификации «норма-патология».
Менее эффективной оказалась сеть, разработанная для оценки характеристики спермы на основе базовых данных анкеты об образе жизни. Ставка правильных ответов составила 88% для тестового набора характеристик и 84% для контрольного набора. Тем не менее эта искусственная НС может быть использована для предварительной оценки и прогнозирования профиля спермы по результатам анкетирования пациента.
Заключение
В данном исследовании было проанализировано 345 образцов эякулята и 209 образцов семенной плазмы от пациентов в возрасте от 18 до 61 года с помощью построения искусственной НС, которая анализирует спектральные характеристики биологических жидкостей. При помощи микроструктурных волноводов с полой сердцевиной и разработанной НС, анализирующей получаемые спектры, удалось добиться высочайшей точности в определении фертильного статуса мужчин. Применение точных диагностических тестов, подобных описанному, позволит снизить субъективность, зависящую от оператора, при оценке стандартной спермограммы и даст более точный диагностический критерий.
Следует подчеркнуть, что НС пока не сможет заменить стандартное диагностическое обследование; ИИ может быть полезным инструментом для оценки состояния пациента во время исследования фертильности потенциально бесплодной пары, а также для предварительного отбора доноров спермы. Однако разработанный метод имеет огромные перспективы для диагностики мужского бесплодия. Дальнейшие исследования оценки мужской фертильности будут направлены на построение всеобъемлющей системы, которая будет включать в себя анализ образа жизни пациента, анамнеза, спермограммы и спектральных характеристик эякулята/семенной плазмы.



