Демографическая ситуация в России вызывает беспокойство, данные статистики характеризуются снижением рождаемости, увеличением количества беременностей с осложненным течением, высоким уровнем врожденных пороков развития. Все вышеперечисленное в дальнейшем приводит к неблагоприятным перинатальным исходам и в целом негативно влияет на здоровье будущего поколения [1, 2]. Снижение детской смертности и улучшение состояния здоровья матерей - одна из важнейших задач XXI в., которая была провозглашена Организацией объединенных наций (ООН) и поддержана Всемирной организацией здравоохранения (ВОЗ) [3]. В 2010 г. для улучшения здоровья женщин и детей инициирована глобальная стратегия «Каждая женщина, каждый ребенок» [4]. Деятельность международных организаций дала импульс к поддержке и разработке национальных проектов с целью улучшения репродуктивного здоровья в области здравоохранения многих стран.
Установлено, что фолаты и витамин В12 необходимы для полноценного эмбрионального развития и физи-ологического течения беременности. Исследования, направленные на определение распространения дефицита фолатов, подтверждают, что распространенность дефицита фолатов у женщин репродуктивного возраста составляет более 20% во многих странах с низким уровнем дохода и менее 5% в странах с более высоким уровнем дохода [5], дефицит витамина В12 зафиксирован в 22,7% [6]. Доказано, что уровень фолатов в эритроцитах выше 400 нг/мл (906 нмоль/л) у будущей матери соответствует наименьшему риску развития дефектов нервной трубки (ДНТ): частота ДНТ, связанная с этим порогом, составляет 0,8 (95% ДИ 0,4-1,5) на 1000 рождений [7]. Однако этот вид исследования финансово затратен, технически сложно выполним и сопряжен с большой вероятностью ошибок [8], поэтому в рутинной клинической практике чаще оценивают уровень фолатов плазмы крови. Согласно данным ВОЗ, уровень фолатов в эритроцитах 906 нмоль/л соответствует уровню фолатов 7 нг/мл плазмы крови [7]. Клиническими рекомендациями МЗРФ 2020 г. установлены нормативные концентрации витамина В12 периферической крови, значение менее 140 пг/мл рассматривается как дефицит [9].
К сожалению, несмотря на широкое внедрение различных программ дотации фолатов результативность далека от желаемой. Одна из причин, которая активно изучается, — это особая роль генов, кодирующих ферменты фолатного цикла, поскольку дефицит метильных групп напрямую связан с полиморфизмом данных генов. Полиморфизм генов MTHFR, MTRR и MTR обусловливает снижение функциональной активности ферментов фолатного цикла и может привести к снижению уровней витаминов группы В, повышению гомоцистеина в организме [6, 10—14].
Полиморфизмы гена метилентетрагидрофолатредуктазы (MTHFR-677C>T и MTHFR-1298A>C). MTHFR является ключевым и наиболее изученным ферментом фолатного цикла, восстанавливает 5,10-метилентетрагидрофолат до 5-метилтетрагидрофолата. Изучены два полиморфизма: С677Т и А1298С. Замена в 677 позиции гена (677С>Т, rs1801133) цито-зина (C) на тимин (T) приводит к замене аминокислотного остатка аланина на валин (Ala222Val) и снижает активность фермента MTHFR. Установлено, что у лиц с генотипом MTHFR-677CT при гетерозиготном носительстве редкого аллеля Т отмечается снижение активности фермента примерно до 35%, у гомозигот MTHFR-677TT - до 70% [14]. Замена в 1298 позиции гена (1298А>С, rs1801131) аденина (А) на цитозин (С) вызывает замену глутаминовой кислоты на аланин в регуляторном домене фермента Glu429Ala и снижает активность MTHFR [15-18].
Полиморфизмы гена В12-зависимой метионин-синтазы (MTR). Кодирует фермент, осуществляющий метилирование гомоцистеина, - обратное превращение гомоцистеина в метионин. Замена в 2576 позиции гена (2756A>G, rs1805087) аденина (А) на гуанин (G) вызывает замену аспарагиновой кислоты на глицин в домене фермента Asp919Gly и снижает его активность [19].
Полиморфизмы гена метионин-синтаза-редуктазы (MTRR). Необходим для восстановления активности метионин-синтазы (MTR).
Замена в 66 позиции гена (66A>G, rs 1801394) аденина (А) на гуанин (G) вызывает замену аминокислоты изолейцина на метионин и снижает активность фермента MTRR [18].
По мнению ряда исследователей, полиморфизмы MTHFR, MTRR и MTR могут рассматриваться как факторы риска развития целого ряда осложнений беременности и должны учитываться при прогнозировании рисков акушерских осложнений [16-18, 21-24, 26]. Развитие фармакогенетики позволяет учитывать генетические особенности женщин для микронутри-ентной поддержки при прегравидарной подготовке.
Цель исследования: изучить распределение геноти-пов основных генов, контролирующих функции ферментов фолатного цикла: MTHFR-677C>T, MTHFR- 1298A>C, MTR-2756A>G, MTRR-66A>G, в российской популяции, проанализировать их взаимосвязь с уровнем фолатов, гомоцистеина, витамина В12 плазмы крови.
Материалы и методы
В программе участвовали 194 женщины европео-идной расы в возрасте от 20 до 38 лет включительно, планирующие беременность и обратившиеся с целью прегравидарного консультирования. У пациенток собирали анамнез: предшествующие и сопутствующие экстрагенитальные, гинекологические заболевания, оперативные вмешательства, наличие вредных привычек, лекарственной терапии. Выполняли объек-тивное обследование с оценкой антропометрических показателей, артериального давления (АД), частоты сердечных сокращений (ЧСС), частоты дыхательных движений (ЧДД). Проводили лабораторные исследования: анализ генов ферментов фолатного цикла MTHFR-677C>T, MTHFR-1298A>C, MTR-2756A>G, MTRR-66A>G, клинический анализ крови, общий анализ мочи, биохимический анализ крови, анализ уровней фолатов, витамина В12, гомоцистеина крови.
Методика определения генетического полиморфизма генов фолатного цикла. Анализ полиморфных локусов MTHFR-677C>T, MTHFR-1298A>C, MTR-2756A>G, MTRR-66A>G проведен с помощью полимеразной цепной реакции с анализом кривых плавления (Амплификатор «ДТ-96», ООО «ДНК-Технология», Москва) с использованием комплекта реагентов «Генетика метаболизма фолатов» (ООО «ДНК Технология», Москва). Исследуемый материал - цельная кровь с ЭДТА (этилендиаминтетраацетатом). Забор крови из локтевой вены проводился утром, натощак, после 8-14-часового голодания, требуемый объем цельной крови 3 мл. Образцы хранили до проведения определения при температуре -20°С.
Методика определения гомоцистеина - хеми- люминисцентный иммунный анализ на микрочастицах. Использован иммунохимический анализатор Architect i2000 с хемилюминисцентной технологией Chemiflex (Abbott Laboratories S.A., США). Исследуемый материал - гепаринизированная плазма. Референсные значения для женщин старше 19 лет 4,44-13,56 мкмоль/л. У пациенток забор крови проводился из локтевой вены утром, натощак, после 8-14-часового голодания. Кровь помещалась в вакуумную пробирку с зеленой крышкой, гелем и гепарином австрийской компании Vacuette, сразу центрифугировалась в стандартном режиме: 3900 об./мин. в течение 10 минут. Требуемый объем цельной крови — 4 мл. Температура хранения до про-ведения определения -20°С.
Методика определения уровня фолатов и витамина В12 (цианокобаламин) — хемилюминисцентный иммунный анализ на микрочастицах. Использован иммунохимический анализатор Architect i 2000 с хемилюминисцентной технологией Chemiflex (Abbott Laboratories S.A., США). Исследуемый материал - сыворотка крови, референсные значения: для фолиевой кислоты - 3,0-20,5 нг/мл, для витамина В12 - 187,0-883,0 пг/мл [17, 18]. У пациенток забор крови проводился из локтевой вены утром, натощак, после 8-14-часового голодания. Кровь помещалась в вакуумную пробирку с красной крышкой и гелем австрийской компании Vacuette. Для получения сыворотки пробирка с кровью оставлялась в вертикальном положении на 30 минут при комнатной температуре, затем кровь центрифугировались в стандартном режиме: при 3900 об./мин. в течение 10 минут. Требуемый объем цельной крови - 4 мл. Температура хранения до проведения определения - -20°С.
Пациентки были распределены на 4 группы в зави-симости от исследуемого полиморфизма: MTHFR- 677C>T; MTHFR-1298A>C; MTR-2756A>G; MTRR- 66A>G. В каждой группе было выделено 3 подгруппы в соответствии с генотипом: 1-я подгруппа - женщины с нормальным (распространенным) генотипом, не имеющие носительства редкой аллели; 2-я подгруппа - с гетерозиготным вариантом носительства редкой аллели: MTHFR-677CT/MTHFR-1298AC/MTR- 2756AG/MTRR-66AG; 3-я подгруппа - с гомозиготным вариантом носительства редкой аллели: MTHFR- 677TT/MTHFR1298CC/MTR-2756GG/MTRR-66GG.
Статистический анализ
Анализ полученных результатов проведен с исполь-зованием статистических и аналитических методов исследований. Для сравнения распределений частот генотипов в выборках использовали критерий х2 Пирсона. Значения считали статистически значимыми при р<0,05. Среднее содержание фолатов, витамина В12, гомоцистеина представлено в виде средней арифметической со среднеарифметической ошибкой (М±т), для сравнения количественных признаков парной выборки применяли t-критерий Стьюдента. Статистическая обработка результатов проводилась с помощью программного пакета IBM SPSS Statistics версии 26 и среды разработки R-studio версии 1.0.143 для языка программирования R (версия R 3.6.2.)
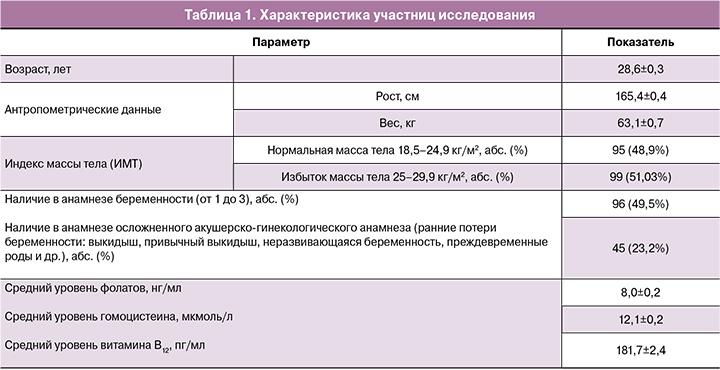
Характеристика пациенток, включенных в исследование
В исследовании приняли участие 194 женщины в возрасте от 20 до 38 лет. Нормальная масса тела зарегистрирована в 48,9% случаев, у остальных женщин индекс массы тела (ИМТ) был повышен. 49,5% пациенток при сборе анамнеза указали на наличие от 1 до 3 беременностей (закончившихся срочными и/или преждевременными родами, самопроизвольными и/или искусственными абортами). В исследование не включались женщины с персональным анамнезом ДНТ, семейным анамнезом ДНТ (первой степени родства); пациентки, принимающие лекарственные препараты, влияющие на уровень фолатов в плазме крови (карбамазепин, вальпроевая кислота, фенитоин, фенобарбитал, метформин, метотрексат, сульфасалазин, триметоприм); пациентки, страдающие воспалительными заболеваниями ЖКТ или имеющие в анамнезе оперативные вмешательства на ЖКТ; пациентки с сахарным диабетом, ожирением, онкологическими заболеваниями, тяжелыми нарушения со стороны сердечно-сосудистой, мочеполовой или дыхательной систем; пациентки, не принимавшие фолаты и витамин В12 в течение последних 6 месяцев.
АД, ЧСС находились у пациенток в пределах нормы. Значения лабораторных показателей участниц программы (общий анализ крови: СОЭ, мм/ч; гемоглобин, г/л; эритроциты, 1012/л; тромбоциты, 109/л; лейкоциты, 109/л; нейтрофилы палочкоядерные, сегментоядерные, %; эозинофилы, %; базофилы, %; моноциты, %; лимфоциты, %; общий анализ мочи: pH; относительная плотность; био-химический анализ крови: АЛТ, Ед/л; АСТ, Ед/л; щелочная фосфатаза, Ед/л; креатинин, мкмоль/л; билирубин общий, мкмоль/л; белок общий, г/л; холестерин, ммоль/л; глюкоза, ммоль/л) были в пределах нормативных значений. Средние ариф-метические концентрации фолатов, витамина В12 и гомоцистеина в пределах нормативных значений. Характеристика участниц исследования представлена в таблице 1.
Результаты
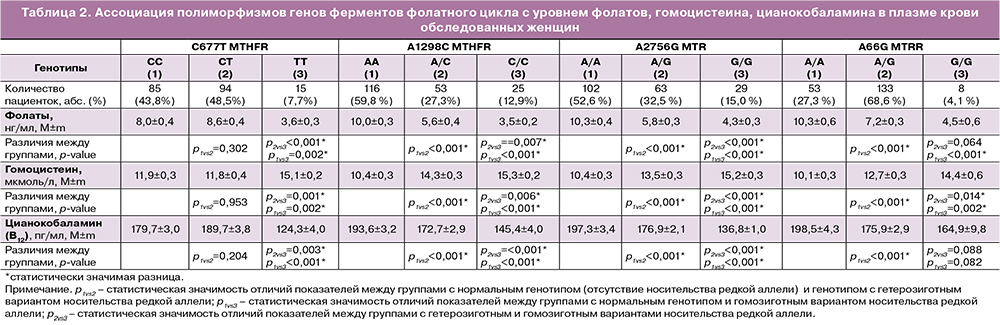
Генотип MTHFR-677CT выявлен у 94 пациенток (48,5%), генотип MTHFR-677 ТТ - у 15 женщин (7,7%).
Генотип MTHFR-1298AC выявлен у 53 пациенток (27,3%), генотип MTHFR-1298 СС - у 25 женщин (12,9%).
Генотип MTR-2756 AG выявлен у 63 пациенток (32,5%), генотип MTR-2756 GG - у 29 женщин (15%).
Генотип MTRR-66 AG выявлен у 133 пациенток (68,6%), генотип MTRR-66 GG - у 8 женщин (4,1%).
У женщин с генотипом MTHFR-677 TT стати-стически значимо выявлены более низкие средние уровни витамина В12 - 124,3±4,0 пг/мл и фолатов - 3,6±0,3 нг/мл, более высокий средний уровень гомо-цистеина - 15,1±0,2 мкмоль/л по сравнению с гено-типами MTHFR-677CC и MTHFR-677CT.
У женщин с генотипом MTHFR-1298 CC стати-стически значимо выявлен более низкий средний уровень витамина В12 - 145,4±4,0 пг/мл и фолатов - 3,5±0,2 нг/мл, более высокий средний уровень гомоцистеина - 15,3±0,2 мкмоль/л в сравнении с генотипами MTHFR-1298AA и MTHFR-1298AC.
У женщин с генотипом MTR-2756GG, статистически значимо отмечается более низкий средний уровень витамина В12 - 136,8±1,0 пг/мл и фолатов - 4,3±0,3 нг/мл, более высокий средний уровень гомоцистеина - 15,2±0,3 мкмоль/л в сравнении с генотипами MTR-2756AA и MTR-2756AG.
У женщин с генотипом MTRR-66GG статистически достоверно отмечается более низкий средний уровень витамина В12 - 164,9±9,8 пг/мл и фолатов - 4,5±0,6 нг/мл и более высокий средний уровень гомоцистеина - 14,4±0,6 мкмоль/л в сравнении с генотипами MTRR-66AA и MTRR-66AG. Все полученные результаты представлены в таблице 2.
Обсуждение
Наличие полиморфизмов генов ферментов фолатного цикла представляет собой самостоятельную группу причин, затрудняющую достижение целевых значений фолатов, и тем самым предрасполагает к развитию акушерской патологии. При проведении наблюдения обнаружены в исследуемой популяции все искомые полиморфизмы в гомо- и гетерозиготном состоянии.
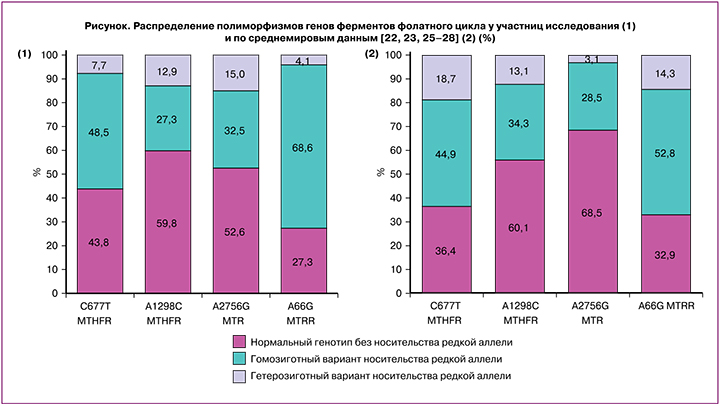
При детальном изучении полиморфизмов MTHFR-677C>T выявлено, что нормальный генотип и генотип с гетерозиготным вариантом носи-тельства редкой аллели Т встречались с сопоставимой частотой, соответственно 43,8 и 48,5% (х2 =0,281; р=0,596). Доля женщин с генотипом MTHFR-677TT составила 7,7%. В ходе исследования установлено, что большинство женщин (59,8%) имели генотип MTHFR-1298AA, частота выявления генотипа MTHFR-1298AC с гетерозиготным вариантом редкой аллели С и генотипа MTHFR-1298CC с гомозиготным вариантом редкой аллели С была статистически значимо ниже в 2,2 и 4,6 раза и составила 27,3% (х2=43,07; р<0,001) и 18,9% (х2=7,694; р=0,006) соответственно. Генотип MTR-2756AA был выявлен у 52,6% женщин, генотип MTR-2756AG с гетерозиготным вариантом редкой аллели G встречался у 32,5% женщин (х2=6,034; р=0,014). Доля женщин с генотипом MTR-2756GG была статистически значимо ниже частоты генотипа MTR-2756AA и генотипа MTR-2756AG в 3,5 и 2,2 раза и составила 15%. При исследовании распространенности полиморфизмов MTRR-66A>G выявлено, что частота носительства генотипа MTRR-66AG превышала таковую для генотипа MTRR-66GG и генотипа MTRR-66AA в 2,5 и 8,5 раза соответственно. Так, распространенность генотипа MTRR-66AA составила 27,3%, генотипа MTRR-66AG - 68,6% (х2=22,85; р<0,001), генотипа MTRR-66GG - 4,1% (х2=25,507; р<0,001).
Проанализирована мировая статистика распространения полиморфизмов генов ферментов фолатного цикла, результаты представлены на рисунке. Графики 1 и 2 демонстрируют, что полученные данные распределения полиморфизмов генов ферментов фолатного цикла у участниц исследования аналогичны распределению по данным зарубежных авторов [22, 23, 25-28].
Статистически значимо установлено, что генотипы MTHFR-677TT, MTR 2756-GG ассоциированы с низкими средними уровнями фолатов (3,6±0,3; 4,3±0,3 соответственно), витамина В12 (124,3±4,0; 136,8±1,0 пг/мл соответственно) и высоким средним уровнем гомоцистеина (15,1±0,2 мкмоль/л; 15,2±0,3 мкмоль/л соответственно); генотипы MTHFR-1298CC, MTHFR-1298AC, MTR-2756AG, MTRR-66GG ассоциированы с низким уровнем фолатов (3,5±0,2; 5,6±0,4; 5,8±0,3; 4,5±0,6 нг/ мл соответственно) и повышенным уровнем гомоцистеина (15,3±0,2; 14,3±0,3; 13,5±0,3; 14,4±0,6 мкмоль/л соответственно).
Полученные данные могут учитываться как при прогнозировании рисков акушерских осложнений для каждого отдельно взятого генотипа, так и для разработки персонализированной программы прегравидарной подготовки с целью подбора индиви-дуальных режимов микронутриентной поддержки.
Заключение
Полученные данные распространения полимор-физмов генов ферментов фолатного цикла у участниц исследования аналогичны мировым общепопуляционным показателям. Статистически значимо установлено, что генотипы MTHFR-677TT, MTR-2756GG ассоциированы с повышенным уровнем гомоцистеина, пониженными уровнями фолатов и витамина В12; генотипы MTHFR-1298CC, MTHFR- 1298АС, MTR-2756AG, MTRR-66GG ассоциированы с пониженным уровнем фолатов и повышенным уровнем гомоцистеина, что увеличивает риски развития врожденных пороков, осложнений гестации. С точки зрения готовности к зачатию состояние таких женщин является неудовлетворительным. Представленные данные диктуют необходимость персонализации микронутриентной поддержки на основе генетических особенностей организма женщины.



