Доказано, что микронутриенты (витамины и минералы) абсолютно необходимы для нормального протекания обмена веществ и всех жизненных функций у человека. По данным ВОЗ, человечество в XXI в. испытывает метаболическую пандемию [1]. Более 2 млрд человек страдают «скрытым голодом» или дефицитом витаминов и других микронутриентов вследствие неправильного питания, малоподвижного образа жизни в совокупности с вредными привычками и факторами окружающей среды. Так, сочетанный дефицит трех и более витаминов наблюдается более чем у 70% женщин Российской Федерации [2].
Как известно, современная медицина задала курс на персонификацию методов лечения и профилактики заболеваний, что непосредственно касается и прегравидарной подготовки. Обеспеченность организма витаминами играет важную роль для поддержания репродуктивного здоровья пары – успешного зачатия, течения беременности и родов. В России отсутствуют широкомасштабные многоцентровые эпидемиологические исследования, оценивающие распространенность дефицита и недостаточности микроэлементов в различных географических широтах. В разных популяциях уровень микронутриентов может сильно отличаться из-за различий в климатических зонах, этнической принадлежности, культуры питания и соматических заболеваниях. Среди женщин с репродуктивными потерями и бесплодием в анамнезе проблема коррекции витаминного статуса изучена недостаточно.
Таким образом, цель нашего исследования – оценить частоту дефицитов микронутриентов (витамин D, омега-3 полиненасыщенные жирные кислоты (ПНЖК) и гомоцистеин) и их связь с иммунологическими параметрами (функциональная активность и уровень NK-клеток периферической крови, антитела (АТ) к кардиолипину, к β2-гликопротеину-1, волчаночный антикоагулянт, АТ к фосфатидилсерину, фосфатидилинозитолу, фосфатидиловой кислоте, антитела к аннексину V, к протромбину, содержание АТ к хорионическому гонадотропину (ХГЧ) (IgG)) у женщин, планирующих беременность, с бесплодием в анамнезе в Северо-Западном регионе России.
В настоящее время наиболее часто исследуемым и обсуждаемым в научном мире нутриентом является витамин D (25(ОН)D) – жирорастворимый стероидный гормон. 80% витамина D вырабатывается эндогенно кожей в ответ на ультрафиолетовые лучи класса В в результате превращения 7-дегидрохолестерина, а 20% – поступает в организм с продуктами питания. Наличие рецепторов витамина D (VDR) в овариальной ткани, эндометрии, фаллопиевых трубах, плаценте и гипофизе, позволяет предположить, что витамин D является важным регулятором репродуктивного здоровья женщины [3]. В репродуктивной системе витамин D выполняет несколько аутокринных и эндокринных функций. К ним относятся регуляция пролиферации эндометрия и экспрессии генов, участвующих в рецептивности эндометрия [4, 5]. Витамин D играет важную роль в механизме иммуномодуляции на границе мать-плод. Он в определенной степени изменяет соотношение Th1/Th2 и регуляторных T-клеток/Th17, а также влияет на активность NK-клеток и выработку цитокинов для снижения частоты повторных репродуктивных потерь. Кроме того, витамин D модулирует рекрутирование примордиальных фолликулов посредством регуляции выработки антимюллерова гормона [6, 7].
Дефицит витамина D эксперты оценивают как новую пандемию XXI в. [8]. Статус витамина D определяется путем оценки циркулирующих уровней 25(ОН)D в образцах сыворотки крови с помощью метода хемилюминесцентного иммуноанализа на микрочастицах.
Сыворотка классифицируется в соответствии с клинически принятыми диапазонами дефицита витамина D (<20 нг/мл), недостаточности (20–30 нг/мл) и насыщения (>30 нг/мл) [9]. Стандартные пороговые значения основаны на здоровье костей в общей популяции и могут не подходить для преконцепционного периода. По данным зарубежных авторов, уровень 25(ОН)D уже на этапе планирования беременности должен достигать 40–60 нг/мл для пар, столкнувшихся с проблемой бесплодия и невынашивания и сохраняться на таком уровне в течение всех триместров беременности [10]. В нашем исследовании критерием недостаточности выбран показатель 25(ОН)D <30 нг/мл.
Другим не менее популярным и наиболее известным своим протективным действием в профилактике сердечно-сосудистых осложнений нутриентом является омега-3 ПНЖК. Со дня открытия ПНЖК прошло почти полвека, а омега-3 и омега-6 остаются предметом пристального внимания исследователей. Доказано, что достаточное потребление омега-3 ПНЖК ассоциировано с низким риском ановуляции, увеличивает вероятность зачатия, уменьшает вероятность преэклампсии, положительно влияет на формирование иммунной системы и головного мозга плода, когнитивные функции ребенка в будущем. При этом по результатам независимого опроса в России, препараты омега-3 ПНЖК принимают не более 1% беременных [11]. Оценить уровень ПНЖК в организме человека позволяет омега-3 индекс.
Индекс омега-3 – это суммарный процент эйкозапентаеновой и докозагексаеновой кислот от общего количества жирных кислот в мембране эритроцита; определяется методом газовой хроматографии с масс-спектрометрией. По данным мировых исследований целевой диапазон индекса омега-3 при беременности составляет 8–11%, верхний предел определен в 11%, т. к. данный уровень существенно не снижает арахидоновую кислоту (омега-6) [12, 13]. Доказано, что дефицит арахидоновой кислоты связан с более высоким риском неонатальных заболеваний и смертности у недоношенных детей [14]. Таким образом, необходимо соблюдение баланса омега-3 к омега-6 в оптимальном соотношении от 1:5 до 1:10. В данной работе целевой индекс омега-3 ≥8%.
Третьим показателем, широко используемым в практике акушеров, является гомоцистеин, который отражает фолатный статус пациенток.
Гомоцистеин – это серосодержащая аминокислота, образующаяся при метаболизме незаменимой аминокислоты метионина, получаемой из ежедневного рациона. Гипергомоцистеинемия – мультифакториальная патология, обусловленная генетическими дефектами (мутация гена метилентетрагидрофолатредуктазы (MTHFR)), алиментарными факторами (недостаток потребления фолиевой кислоты, витаминов В6 и В12) и другой экстрагенитальной патологией. Было показано, что гипергомоцистеинемия связана с осложнениями беременности: привычный выкидыш, преэклампсия, преждевременные роды, отслойка плаценты, задержка роста плода и гестационный сахарный диабет [15]. По данным общепопуляционных исследований, нижний уровень гомоцистеина – 5 мкмоль/л, а значения, превышающие 15 мкмоль/л, определяются как гипергомоцистеинемия. При течении нормальной беременности уровень гомоцистеина более низкий, по сравнению с небеременными, что обусловлено гемодилюцией и частичным поглощением гомоцистеина плодом. Нормальные значения гомоцистеина во время беременности: 3,9–7,3 мкмоль/л – до 16-й недели; 3,5–5,3 мкмоль/л – между 20-й и 24-й неделями и 3,3–7,5 мкмоль/л – после 36-й недели беременности [16]. В 2021 г. были опубликованы результаты проспективного когортного исследования, показывающие достоверную связь между уровнем гомоцистеина в фолликулярной жидкости и качеством эмбрионов; уровень гомоцистеина <9,8 мкмоль/л был ассоциирован с эмбрионами хорошего качества [17].
Кроме того, было отмечено, что у пациенток с рецидивирующими репродуктивными потерями гомоцистеин сыворотки крови был статистически значимо выше, чем у здоровой группы контроля [18]. В недавнем исследовании американские авторы показали больший риск повторной потери беременности у женщин с репродуктивными потерями в анамнезе с концентрацией гомоцистеина в плазме крови по медиане 8,0 мкмоль/л, по сравнению с медианой популяции США 6,0 мкмоль/л (RR 1,43; CI 1,08–1,89). Следует отметить, что выборка была представлена женщинами на этапе планирования беременности, ежедневно принимающими 400 мкг фолиевой кислоты [19]. Учитывая результаты зарубежных коллег, целевой показатель гомоцистеина на этапе прегравидарной подготовки в нашей работе был отсечен на точке 7 мкмоль/л.
Материалы и методы
В исследование включены 299 женщин из базы отдела иммунологии и межклеточных взаимодействий и отделения вспомогательных репродуктивных технологий НИИ АГиР им. Д.О. Отта, Санкт-Петербург, в период с 2017 по 2022 гг., которые имели бесплодие в анамнезе. Данные пациенты были разделены на 2 группы в зависимости от репродуктивного анамнеза: 1-ю группу (n=131) составили женщины с первичным бесплодием, 2-ю группу (n=168) – с вторичным бесплодием (как со срочными родами в анамнезе, так и с одним и более случаем репродуктивной потери (самопроизвольный выкидыш, неразвивающаяся беременность)).
В общей когорте женщин с репродуктивными нарушениями (n=299) средний возраст составил 34,1 (4,4) года; индекс массы тела (ИМТ) – 22,3 (4,1) кг/м2. Частота гинекологической патологии у пациенток с репродуктивными нарушениями в анамнезе (первичное и вторичное бесплодие) составила: 94/299 (31,4%) – воспалительные заболевания органов малого таза, 91/299 (30,4%) – наружный генитальный эндометриоз и аденомиоз; 44/299 (14,4%) – синдром поликистозных яичников с/без ановуляции; 40/299 (13,3%) – железистые/железисто-фиброзные полипы эндометрия.
В группе женщин с вторничным бесплодием частота срочных родов составила: 20/168 (11,9%) – со срочными родами в анамнезе и 148/168 (88,1%) – с репродуктивными потерями в анамнезе, включая 116/148 (78,4%) – с неразвивающейся беременностью и 57/148 (38,5%) – с самопроизвольными выкидышами на сроках беременности до 12 недель.
Далее у женщин данных групп на этапе планирования беременности (за 3 месяца до предполагаемого зачатия) исследовали различные показатели микронутриентного статуса в плазме и сыворотке крови и иммунологического профиля в периферической крови.
Для исследования микронутриентного статуса были использованы: метод хемилюминесцентного иммуноанализа на микрочастицах для оценки циркулирующих уровней 25(ОН)D (витамина D) в образцах сыворотки крови; хемилюминесцентный иммуноанализ на микрочастицах для оценки гомоцистеина в плазме крови (лаборатория ФГБНУ «НИИ АГиР им. Д.О. Отта»); газовая хроматография с масс-спектрометрией для определения индекса омега-3 (лаборатория «Гемотест»).
Для исследования иммунологического профиля пациенток были определены: функциональная активность и уровень NK-клеток (NK% (CD3-CD(16+56)+, NKT% (CD3+CD(16+56)+, NK спонтанно активированные (CD107a), NK индуцировано активированные (CD107a)) методом проточной цитофлуориметрии; антифосфолипидные антитела: волчаночный антикоагулянт, АТ к кардиолипину, β2-гликопротеину, фосфатидилсерину, фосфатидиловой кислоте, фосфатидилинозитолу, аннексину, протромбину и содержание АТ к ХГЧ (IgG) методом иммуноферментного анализа (отдел иммунологии и межклеточных взаимодействий ФГБНУ «НИИ АГиР им. Д.О. Отта»).
Целевыми значениями для пациенток репродуктивного возраста были выбраны следующие значения: витамин D ≥30 нг/мл; гомоцистеин <7 мкмоль/л; индекс омега-3 ≥8%.
Также пациентки были обследованы в соответствии с приказом Министерства здравоохранения Российской федерации от 30.08.2012 г. N 107н и порядком оказания медицинской помощи по профилю «акушерство и гинекология» от 20.10.2020 № 1130.
Характеристика показателей пациентов с бесплодием представлена в таблице 1.

Статистический анализ
Статистическую обработку результатов осуществляли при помощи программы Statistica 10 (StatSoft, Inc.). Данные были проверены на нормальность распределения с помощью критерия Шапиро–Уилка. Для парного сравнения исследованных показателей был применен непараметрический U-критерий Манна–Уитни. H-критерий Крускала–Уоллиса и поправка Бонферрони для множественного сравнения использовались при сопоставлении трех выборок. Непрерывные переменные представлены как медианы и интерквартильный размах Me (Q1; Q3). Корреляционный анализ был выполнен с помощью оценки ранговой корреляции Спирмена (rs). Сила связи оценивалась согласно шкале Чеддока: очень слабая (0–0,3), слабая (0,3–0,5), средняя (0,5–0,7), высокая (0,7–0,9), очень высокая (0,9–1).
Для сравнения групп по качественному признаку использован тест χ² Пирсона, при малых выборках – χ² рассчитывался с поправкой Йейтса. Оценка связи проводилась с помощью вычисления отношения шансов (OR), для оценки значимости которого, рассчитывались нижняя и верхняя границы 95% доверительного интервала (95% CI). Значение р<0,05 было принято как статистически значимое.
Результаты
В группе женщин с первичным бесплодием уровень витамина D (n=55) составил 31,90 (20,65; 40,75) нг/мл, согласно референсным значениям медиана соответствует норме; тогда как в группе с вторичным бесплодием (n=74) – 24,70 (18,00; 34,00) нг/мл – она соответствует недостаточности. В обеих группах уровень гомоцистеина по медиане превысил целевые значения и составил (n=79) 7,7 (6,0; 9,0) мкмоль/л и (n=100) 7,3 (5,9; 3,6) мкмоль/л в 1-й и 2-й группе соответственно. Индекс омега-3 в группе женщин с первичным бесплодием (n=14) составил 6,5 (5,1; 7,6)%, с вторичным (n=42) – 5,2 (4,4; 5,9)%. Однако статической разницы между группами обнаружено не было (p<0,062). Уровни витамина D и гомоцистеина между двумя группами также статистически значимо не отличались. В связи с этим последующий анализ данных показателей проведен независимо от типа бесплодия, целиком в общей когорте пациентов.
Так, в общей когорте женщин с бесплодием частота дефицита витамина D (<20 нг/мл) составила 38/129 (29,46%), недостаточность (20–30 нг/мл) – 35/129 (27,13%), нормальный уровень – 56/129 (43,41%). Показано, что дефицит витамина D (менее 20 нг/мл) чаще наблюдался у женщин с наружным генитальным эндометриозом по сравнению с женщинами без данной патологии – 15/31 (48,39%) и 25/97 (25,77%) (χ²=8,516, p=0,014) соответственно. Целевой уровень гомоцистеина (менее 7 мкмоль/л) обнаружен у 79/179 (44,13%), а нецелевые значения (более 7 мкмоль/л) – у 100/179 (55,87%). Критически низкий индекс омега-3 (<4%) встречался у 5/56 (8,93%), недостаточный (4–8%) – у 46/56 (82,14%), а оптимальный (>8 %) – у 5/56 (8,93%) (табл. 2).
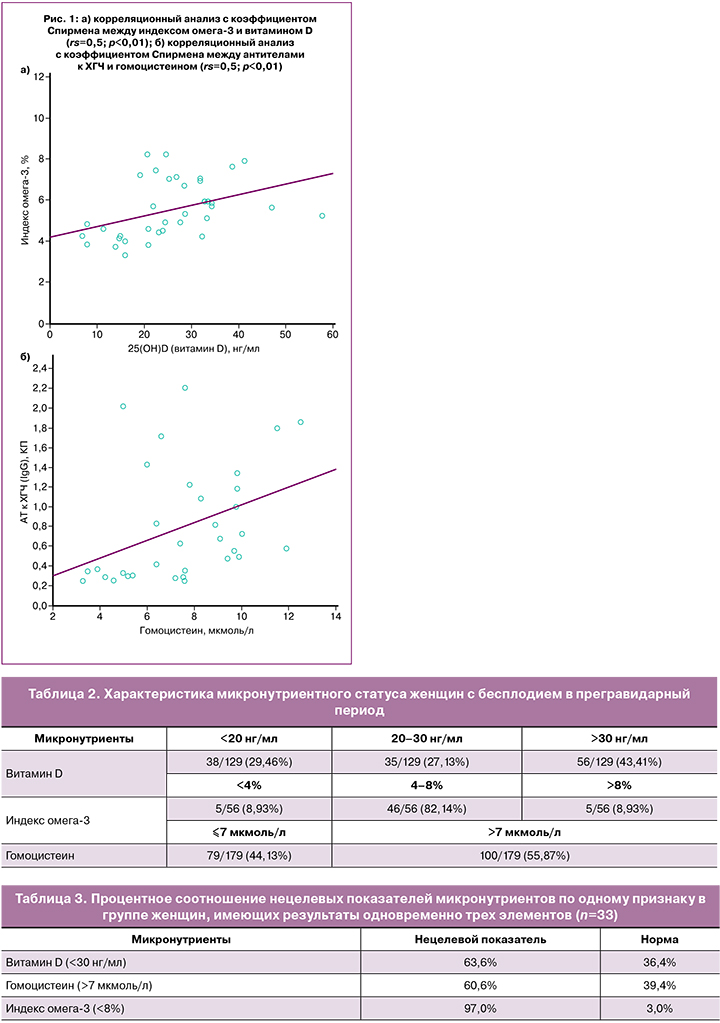
При корреляционном анализе была обнаружена прямая средняя взаимосвязь между показателями витамина D и индекса омега-3 (rs=0,5; p<0,01) и между уровнем гомоцистеина и АТ к ХГЧ (rs=0,5; p<0,01) (рис. 1), а также обратные взаимосвязи между витамином D и иммунными показателями: АТ к β2-гликопротеину (rs=-0,34; p=0,04), NK% (rs=-0,4; p=0,03) и индексом омега-3 и АТ к кардиолипину (rs=-0,47; p=0,03). Между остальными показателями значимых корреляционных связей обнаружено не было.
Показано, что значение индекса омега-3 изменяется в зависимости от уровня витамина D (H=12,5; p=0,002). Так, у женщин с дефицитом витамина D медианный уровень индекса омега-3 был самым низким и составлял 4,2 (3,8; 4,6)%, что статистически значимо ниже, чем у женщин с недостаточностью витамина D, где его уровень составил 5,5 (4,6; 7,1)% (p=0,012), и ниже, чем у пациентов с нормальным уровнем витамина D, где данный показатель был самым высоким и соответствовал 5,85 (5,2; 6,9)% (p=0,002). При уровне в сыворотке крови у женщин витамина D<20 нг/мл показан риск выявления критически низкого уровня омега-3 (OR=14,4 (1,23–168,51), p<0,05).
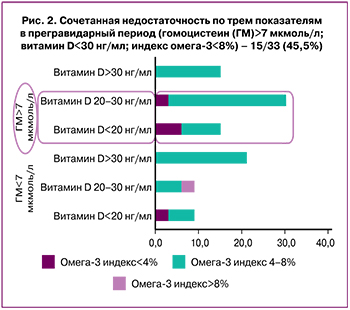
Из 299 исследуемых пациенток одновременно исследовали витамин D, индекс омега-3 и гомоцистеин у 33 женщины. Сочетанная недостаточность по трем показателям (витамин D <30 нг/мл; индекс омега-3 <8%; гомоцистеин > 7 мкмоль/л) выявлена у 15/33 (45,5%) (рис. 2); недостаточность по двум показателям – в 20/299 (60,6%) случаев. Нецелевые показатели одного признака обнаружены: по витамину D (<30 нг/мл) – у 21/33 (63,6%); гомоцистеину (>7 мкмоль/л) – у 21/33 (60,6%); индексу омега-3 (<8%) – у 32/33 (97,0%) (табл. 3).
Обсуждение
Наши результаты показали высокую частоту дефицита витамина D (≤30 нг/мл) – 56,5%, недостаточности эссенциальных жирных кислот (≤8%) – 91%, высокий уровень гомоцистеина (>7 мкмоль/л) – 55,87% у женщин, планирующих беременность, с бесплодием и повторными репродуктивными потерями в анамнезе в Северо-Западном регионе России. Сочетанная недостаточность по трем показателям встречалась в 45% случаев.
Следует отметить, что наиболее часто встречался выраженный дефицит витамина D (<20 нг/мл) среди женщин с отягощенным репродуктивным анамнезом – у 29,46%. Но, по сравнению с основной популяцией женщин Российской Федерации, у которых дефицит витамина D (по данным российского исследования 2021 г.) составляет 52,65% [20], частота дефицита витамина D в нашем исследовании оказалась ниже, скорее всего в связи с более широким применением добавок, содержащих витамин D в группе лиц, планирующих беременность.
Также, по нашим данным, наиболее часто дефицит витамина D ассоциировался с наружным генитальным эндометриозом – 43,39% (χ2=8,516; p=0,014). Иммунологические свойства витамина D и экспрессия VDR в репродуктивных тканях выносят на обсуждение данную гипотезу во многих исследованиях, но консенсуса по данному вопросу в настоящее время нет [21]. В систематическом обзоре 2020 г. указано, что из-за наличия множество фенотипов эндометриоза, связь между витамином D и подтипами эндометриоза должна быть исследована для каждого подтипа отдельно [22].
Нецелевой уровень гомоцистеина более 7 мкмоль/л имел место более чем у половины женщин с репродуктивными потерями и бесплодием – 55,87%.
Известно, что дефицит фолиевой кислоты, витаминов группы В и дефекты в генах фолатного цикла приводят к избыточному накоплению гомоцистеина в крови и нарушению процессов метилирования в клетке. Гомоцистеин обладает выраженным токсическим действием на эндотелиальную выстилку сосудов, что приводит к нарушению имплантации и целому ряду акушерских осложнений [23].
Недостаточный индекс омега-3 (<8%) определяется у 91% женщин. Полученные данные указывают на тотальную нехватку омега-3 жирных кислот среди пациенток с репродуктивными потерями и бесплодием. Медицинские сообщества рекомендуют увеличить потребление докозагексаеновой кислоты (омега-3) на 200 мг/сутки на этапе планирования беременности, корреляции между потреблением и полученным уровнями оставляет желать лучшего [24, 25].
В группе дефицита витамина D индекс омега-3 был самым низким и составлял 4,2%, что достоверно ниже, чем в группе с недостаточностью, и достоверно ниже, чем в группе с нормальным уровнем витамина D. А корреляционный анализ показал прямую среднюю взаимосвязь между показателями витамина D и индекса омега-3. Такую закономерность можно объяснить составом продуктов питания; в частности, рыбий жир содержит одновременно высокие дозировки омега-3 ПНЖК и витамина D, что показывает хорошую совместимость и усвояемость данных микроэлементов.
В ходе проведенного исследования была обнаружена средняя обратная взаимосвязь между микронутриентами и иммунными показателями: витамином D и АТ к β2-гликопротеину (rs=-0,34; p=0,04); витамином D и NK% (rs=-0,4; p=0,03) и индексом омега-3 и АТ к кардиолипину (rs=-0,47; p=0,03). Полученные результаты не противоречат данным зарубежных коллег. В январе 2022 г. авторами из США было опубликовано рандомизированное двойное слепое плацебо-контролируемое исследование, целью которого было оценить, может ли применение витамина D (2000 МЕ/сутки) и ПНЖК омега-3 (1000 мг/сутки) снизить риск развития аутоиммунных заболеваний (n=25 871 человек, включая 13 085 женщин старше 55 лет). Применение витамина D на протяжении 5 лет с или без омега-3 ПНЖК ассоциировано со снижением риска аутоиммунного заболевания на 22%, тогда как применение омега-3 с или без витамина D снижает этот риск на 15% по сравнению с отсутствием приема добавок [26].
У пациентов с антифосфолипидным синдромом витамин D оказывает подавляющее действие на экспрессию АТ к β2-гликопротеину, тем самым снижая риск тромбоза. Кроме того, в исследованиях in vitro доказано, что витамин D ингибирует экспрессию тканевого фактора, индуцированного антителами к β2-гликопротеину [27].
Неоднократно ученые сообщали о возможной регуляторной роли витамина D по отношению к периферическим NK-клеткам. Так, выявлены достоверные различия в уровнях CD56+NK-клеток крови и уровнями витамина D в группах менее 30 нг/мл и более 30 нг/мл у пациенток с повторными репродуктивными потерями. При недостаточном уровне витамина D было отмечено значительное повышение цитотоксичности периферических NK-клеток, что хорошо корректировалось приемом витамина D и имело дозозависимый эффект [28].
Широко известны иммуномодулирующие свойства омега-3, которые осуществляются посредством встраивания жирных кислот в структуру мембранных фосфолипидов и синтезом про- и противовоспалительных эйкозаноидов. Клеточная мембрана с высоким содержанием омега-3 ПНЖК имеет защитную, противовоспалительную и косвенно антиоксидантную функцию. Кроме того, действие жирных кислот проявляется опосредовано через рецепторы – активаторы пролиферации пероксисом, рецепторы, связанные с G-белками, и CD1-рецепторы. Было показано, что активация таких ядерных рецепторов снижает цитотоксичность NK-клеток за счет снижения секреции интерферона-гамма [29], а также ингибирует активность макрофагов, продукцию фактора некроза опухоли, интерлейкинов-1 и -6 [30].
Кроме взаимосвязей между витамином D и омега-3 с иммунологическими показателями в исследовании была обнаружена прямая средняя связь между гомоцистеином и АТ к ХГЧ (rs=0,5; p<0,01).
По некоторым данным, гипергомоцистеинемия является триггером развития аутоиммунных процессов, нарушающих нормальное течение беременности [31].
Таким образом, витамины и микронутриенты занимают значительное место в функционировании как врожденного, так и адаптивного иммунитета; являются кофакторами различных биохимических реакций; предупреждают развитие пороков плода и осложнения беременности.
Необходимо отметить ряд ограничений нашего исследования: выборка состояла только из женщин с репродуктивными потерями и бесплодием и не включала здоровую фертильную контрольную группу. Кроме того, не исследовалось потребление фолиевой кислоты, витаминов B6 и B12, которые могут изменять уровень гомоцистеина. Значительная часть женщин могла принимать фолиевую кислоту, витамин D, омега-3 ПНЖК, а также пренатальные мультивитамины, что могло искажать результаты работы.
Учитывая полученные данные и специфику пациентов с репродуктивными потерями и бесплодием, высокую частоту иммунных нарушений у данной группы пациентов, перспективу дальнейшего исследования мы видим в более подробном изучении микронутриентного статуса и иммунологических параметров в рандомизированных контролируемых исследованиях.
Заключение
У когорты женщин с репродуктивными неудачами и бесплодием, согласно данным нашего исследования, наблюдаются высокая частота дефицита витамина D, высокий уровень гомоцистеина и низкий индекс омега-3. Выявлены корреляции между показателями микронутриентного статуса и иммунологического профиля, которые могут быть факторами нарушения репродуктивной функции.



