Беременность у пациенток с хроническими заболеваниями почек (ХЗП) характеризуется высоким уровнем перинатальной смертности и патологическими изменениями плаценты с множественными ее поражениями [1]. Характер и патогенез нефрологических заболеваний отличаются выраженным разнообразием – это врожденные аномалии развития почек и мочевыводящих путей, хронические персистирующие инфекции, а также иммуновоспалительные системные поражения, гипертоническая болезнь (ГБ), сахарный диабет (СД) с вторичным вовлечением почки в патологический процесс. С учетом международного опыта создана концепция ХБП, что не отменяет необходимости установления индивидуального нозологического диагноза. Диагноз ХБП устанавливается на основании критериев, сохраняющихся более 3 месяцев: альбуминурии (экскреция альбумина с мочой ≥30 мг/сут), изменений осадка мочи, электролитных и других нарушений вследствие канальцевой дисфункции, гистологических изменений (нефробиопсия), структурных нарушений при визуализирующих методах исследования, трансплантации почки, снижении скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2. Стадия ХБП у беременных определяется на основании показателей СКФ при проведении пробы Реберга (табл. 1).
 В редких описаниях при патологии почек отмечается задержка роста плаценты, вероятно, вследствие патологии маточно-плацентарных сосудов и гипертензии. При заболеваниях почек, не сопровождающихся артериальной гипертензией (АГ), плацента может быть не изменена, хотя масса ее и плода часто снижены. При заболеваниях почек в сочетании с АГ наблюдается патология сосудов децидуальной ткани, как и при преэклампсии (ПЭ), но в меньшей степени выраженная. У 30% пациенток с трансплантацией почки развивается ПЭ, иногда в сочетании с отторжением трансплантата [1, 2]. Частота акушерских и перинатальных осложнений четко коррелирует со стадией ХБП, показателями артериального давления (АД) и протеинурией [3]. Из-за разнообразия данных при относительно ограниченном числе наблюдений цель нашего исследования состояла в изучении структурных особенностей плаценты при ХБП.
В редких описаниях при патологии почек отмечается задержка роста плаценты, вероятно, вследствие патологии маточно-плацентарных сосудов и гипертензии. При заболеваниях почек, не сопровождающихся артериальной гипертензией (АГ), плацента может быть не изменена, хотя масса ее и плода часто снижены. При заболеваниях почек в сочетании с АГ наблюдается патология сосудов децидуальной ткани, как и при преэклампсии (ПЭ), но в меньшей степени выраженная. У 30% пациенток с трансплантацией почки развивается ПЭ, иногда в сочетании с отторжением трансплантата [1, 2]. Частота акушерских и перинатальных осложнений четко коррелирует со стадией ХБП, показателями артериального давления (АД) и протеинурией [3]. Из-за разнообразия данных при относительно ограниченном числе наблюдений цель нашего исследования состояла в изучении структурных особенностей плаценты при ХБП.
Материалы и методы
Группы исследования были сформированы соответственно стадиям ХБП: ХБП1 – 70, ХБП2 – 14, ХБП3 – 22, ХБП4 – 5, контроль (физиологическое течение беременности) – 13, всего 124 плаценты в сроки 31–39 недель беременности. Морфологическое исследование плаценты проводили после фиксации в формалине и гистологической обработки. Макроскопически учитывали наличие аномалий пуповины и плацентарного диска, массу последнего оценивали на основании разработанных нами ранее перцентильных показателей массы плаценты жительниц Московской области [4]. При гистологическом исследовании определяли соответствие зрелости ворсин сроку беременности, состояние трофобласта, межворсинчатого пространства, плодовых сосудов и стромы ворсин. Иммуногистохимическое (ИГХ) исследование (49 фрагментов) проводили в полуавтоматическом аппарате Thermo LAB Vision 480S по стандартной методике, рекомендованной производителем антител Thermo scientific. Исследовали экспрессию Ki-67 – маркера клеточной пролиферации (кроличьи моноклональные антитела, клон SP6), CD31 (клон JC/70A) для изучения особенностей сосудистого компонента ворсин хориона. Количественную оценку результатов иммуногистохимических реакций выполняли с использованием системы визуализации на микроскопе AxioImager.M2, цифровой камеры AxioCam MRc5 и программы Zen. Определяли интенсивность пролиферации ворсинчатого цитотрофобласта и эндотелия капилляров путем подсчета позитивно окрашенных ядер в 100 ворсинах при общем увеличении микроскопа 400. Васкуляризацию ворсинчатого хориона оценивали путем подсчета количества капилляров и измерения площади среза каждого из них и суммарную в 50 ворсинах при увеличении 400 с применением морфометрической части программы. Проводили сопоставление структурных особенностей плаценты с клиническими данными – наличием АГ (у 41 пациентки), ПЭ (у 31 – средней тяжести, у 5 – тяжелой), стадией ХБП, весо-ростовыми показателями новорожденного.
Для статистического анализа нами были использованы критерии непараметрической статистики: критерий Смирнова для сравнения двух эмпирических функций распределения – каждой группы с контрольной; критерий хи-квадрат – для оценки значимости зависимости признаков, т.е. определения взаимосвязи клинико-морфологической маски и стадии ХБП; критерий множественного сравнения Краскела–Уоллиса – для более надежной констатации различия между группами; результаты оценивали как статистически значимые при p<0,05. Мы применяли и вариант нечисловой статистики [5], основанный на формализации врачебных утверждений в виде логических переменных, не имеющих численной природы, но влияющих на решение врача о причинах заболевания и методах лечения. Для анализа нечисловой статистики в настоящее время нет коммерческих стандартных пакетов, что заставляет пользоваться авторскими разработками [6]. Состояние каждого пациента представлено в виде набора (вектора) символов, называемых далее «логическими симптомами». Решение о принадлежности пациента к определенной группе принимается по совпадению вектора симптомов пациента с образцом, свойственным этой группе. Такой образец называется «маской» группы – это вектор трехзначных логических симптомов, характерных для группы. Ввиду обычной неполноты сведений в истории болезни и других документах используется числовая характеристика «неотличимость», близкая к обратному понятию для расстояния между двумя логическими векторами, аналогичному расстоянию Хэмминга. Неотличимость двух сравниваемых векторов есть отношение числа координат с совпадающими значениями к числу координат со всеми активными значениями, она принимает значения от 0,00 до 1,00. В работе использовали набор из 61 логического симптома: 35 – связанных с численными переменными и 26 – связанных с текстовыми заключениями врача. Математический метод моделирования клинической ситуации – метод логических симптомов, позволяет оценивать связи между частными заключениями и может указать характерные особенности структуры плаценты, присущие разным стадиям ХБП [7]. При обработке использованы пакеты LibreOffice Версия: 4.3.7.2 и R version 3.5.2 (2018-12-20).
Результаты и обсуждение
Клинико-морфологические показатели фетоплацентарного комплекса при хронической болезни почек
С возрастанием степени тяжести ХБП отмечено снижение перцентильной оценки массы плаценты, статистически значимое в стадиях ХБП3 и ХБП4 в сравнении с ХБП1. Снижение массы плаценты сопровождалось снижением массы и роста новорожденного (табл. 2). Массы плацентарного диска при ХБП1, ХБП2 и в контрольной группе не отличались.
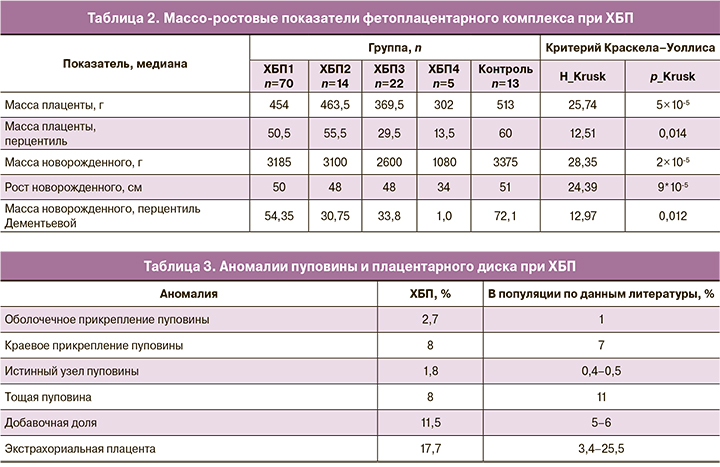
При ХБП аномалии пуповины и плацентарного диска отмечались несколько чаще, чем в популяции (табл. 3).
Большинство плацент – 78 (69,0%) по степени зрелости ворсинчатого дерева соответствовали сроку беременности. Преждевременное созревание ворсин отмечено в 13 (11,5%) случаях, незрелость к сроку гестации – в 22 (19,5%). Признаки хронической маточно-плацентарной ишемии имелись в ⅓ всех плацент: фиброз стромы ворсин – в 33 (29,2%), облитерационная ангиопатия – в 36 (31,9%), в том числе в 6 с внутрисосудистыми септами, многочисленные синцитиальные узлы – в 49 (43,4%) плацентах. Патология сосудов базальной пластинки (неполноценная гестационная трансформация) с тромбозом, кровоизлияниями и массивным фибриноидом в децидуальной ткани диагностирована в 6 (5,3%) случаях, в одном из них – с центральной отслойкой плаценты, в 10 (8,8%) – с немногочисленными мелкими инфарктами. Массивные интервиллезные отложения фибриноида с облитерацией межворсинчатого пространства и формированием псевдоинфарктов наблюдали в 27 (23,9%) плацентах, межворсинчатый тромбоз – в 14 (12,4%). Морфологические признаки плодовой тромботической васкулопатии отмечены в 7 (6,2%) плацентах. Структурные особенности инфекционного поражения имелись в значительной части плацент: острой восходящей амниотической инфекции разной степени выраженности – в 29 (25,7%), гематогенной – в 16 (14,2%). Хорошо выраженный компенсаторный ангиоматоз ворсин мы наблюдали в 47 (41,6%) плацентах.
Несмотря на большой объем исследования и изученные нами почти три десятка морфологических признаков состояния фетоплацентарного комплекса, мы не выделили структурно группы плацент, соответствующие стадиям ХБП.
Клинико-морфологические маски системы мать–плацента–плод при хронической болезни почек
Методом логических симптомов для каждой группы исследования были выбраны совокупности морфологических особенностей плаценты и клинических характеристик системы мать–плацента–плод и сформированы маски, у которых неотличимость от своей группы максимальна, а для всех остальных групп минимальна (табл. 4). Метод масок, полученных при анализе симптомов, позволил отделить наиболее легкую стадию ХБП1 от контрольной группы и наиболее тяжелые по снижению СКФ стадии ХБП2, ХБП3, ХБП4 вместе – от ХБП1.
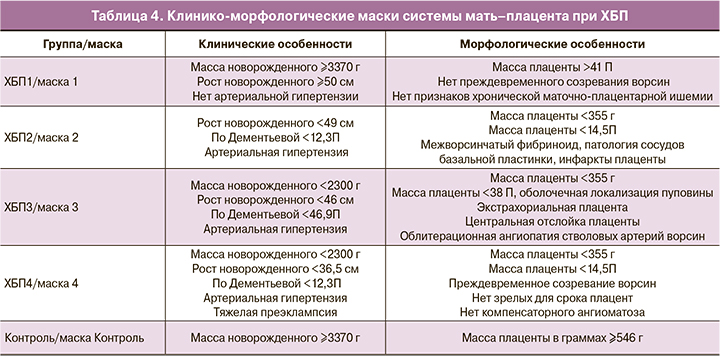
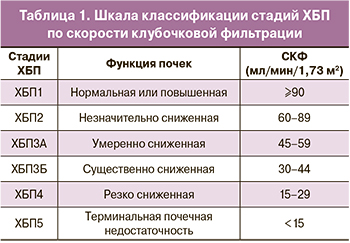
Группа ХБП1 (маска 1) характеризуется массой плаценты, соответствующей среднему коридору перцентильных значений и зрелым для срока беременности ворсинчатым деревом без значимых структурных гипоксических изменений. От группы контроля (маска «контроль») маска 1 отличается более низкими показателями массы плаценты. Тенденция изменения морфологических характеристик плаценты с возрастанием степени тяжести основного заболевания направлена в сторону стойкого снижения абсолютной и перцентильной массы плаценты от 41П при ХБП1 до 14,5П при ХБП4 (маска 4). Патогенетически это обусловлено патологией сосудов базальной пластинки, характерной для всех групп, начиная с ХБП2 (маска 2), и проявляющейся неполноценной гестационной трансформацией спиральных артерий, тромбозом, кровоизлияниями и некрозами в децидуальной ткани, приводящими к снижению маточно-плацентарного кровотока, облитерации межворсинчатого пространства фибриноидом с формированием псевдоинфарктов (рис. 1, а), к развитию инфарктов плацентарного диска. Катастрофическим осложнением патологии сосудов базальной пластинки явилась отслойка плаценты при ХБП3 (маска 3). В этой же группе с маской 3 отмечена характерная для хронической маточно-плацентарной ишемии облитерационная ангиопатия стволовых артерий (рис. 1, б), начиная с уровня хориальной пластинки – гипертрофия мышечного слоя, его спазм, приводящий к пролиферации эндотелия, занимающего просвет сосудов с образованием внутрисосудистых септ, перемычек с перекалибровкой и изменением типа кровотока с магистрального на капиллярный. Кроме того, при ХБП3 (маска 3) значимыми являлись патология прикрепления пуповины (оболочечная локализация) и экстрахориальные плаценты, окруженные ободком или валиком. Необратимые структурные изменения плаценты вследствие хронической маточно-плацентарной ишемии формируют маску 4-й группы ХБП4 с отсутствием в ней зрелых для срока беременности плацент и характерным преждевременным созреванием ворсинчатого дерева в сочетании с тяжелой ПЭ и задержкой роста плода (ЗРП).
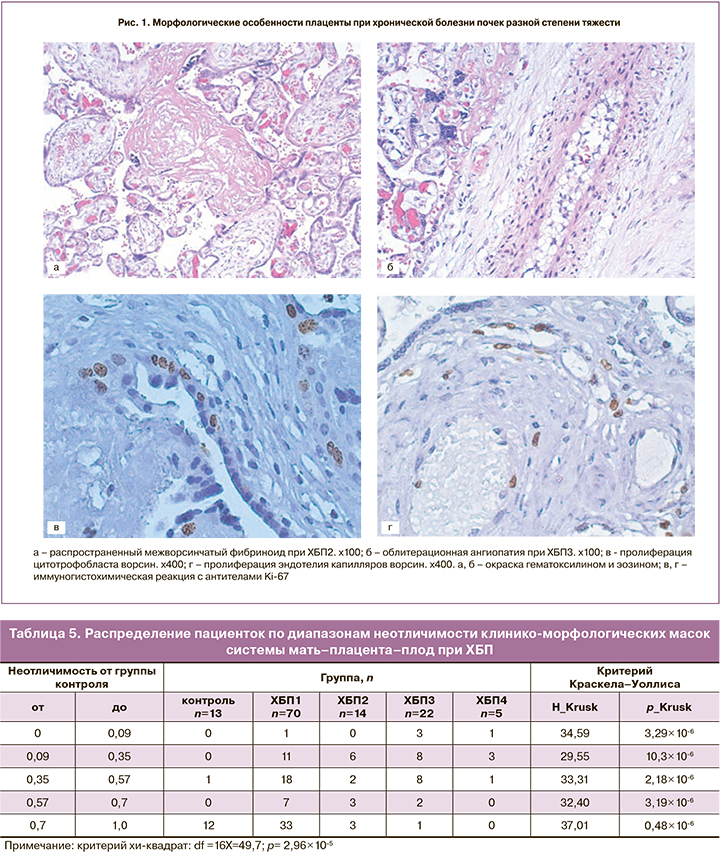
Для каждой пациентки вычисляли неотличимость от масок всех остальных групп. Полученные распределения неотличимостей демонстрируют обособление групп друг от друга по комплексу морфологических изменений плаценты в сочетании с клиническими особенностями, с учетом и числовых, и нечисловых характеристик пациенток (табл. 5).
Выраженные гипоксические изменения проявляются пролиферацией ворсинчатого цитотрофобласта (рис. 1, в), являющегося источником формирования синцитиотрофобласта, а также пролиферацией эндотелия отдельных капилляров (рис. 1, г). Однако эти процессы, направленные на компенсацию тяжелой маточно-плацентарной и плацентарно-плодовой ишемии, не приводят к компенсаторному ангиоматозу, отсутствующему при ХБП4. С возрастанием степени тяжести основного заболевания ухудшается васкуляризация ворсин. ХБП1 практически не отличается от контрольной группы по количеству и размерам капилляров, тогда как при ХБП2, ХБП3 и ХБП4 отмечается стойкая тенденция к резкому уменьшению количества капилляров в срезе ворсины, их сужению до нескольких мкм², в части сосудов просвет отсутствует, наблюдается только CD31-позитивный эндотелий (рис. 2). При сравнении площади сечения капилляров в 50 ворсинах, принадлежавших к своей группе по тяжести ХБП, отмечается заметное уменьшение сечений капилляров по сравнению с контролем (табл. 6).
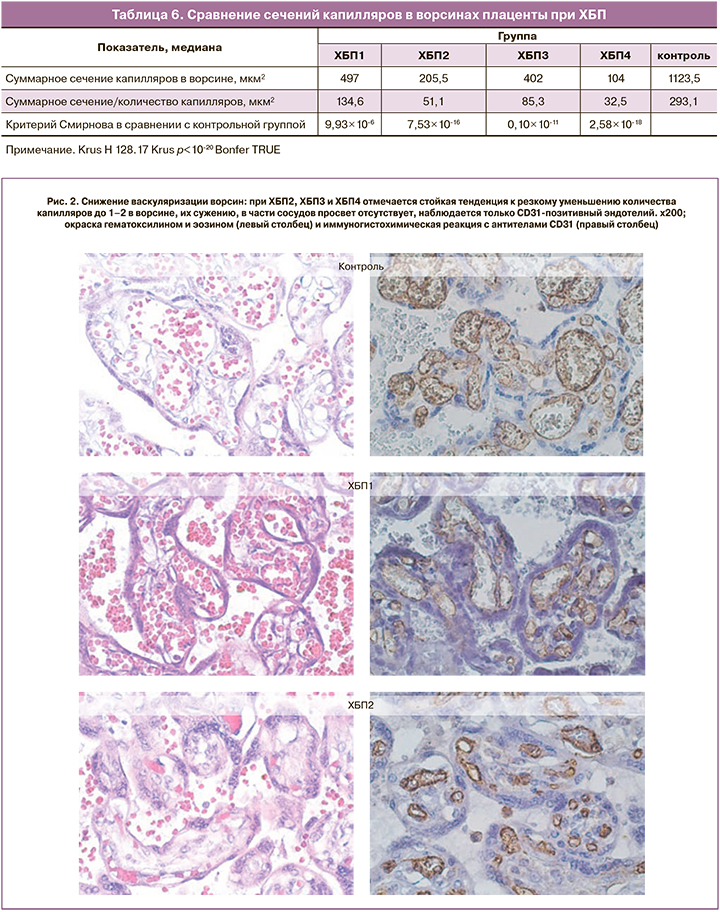
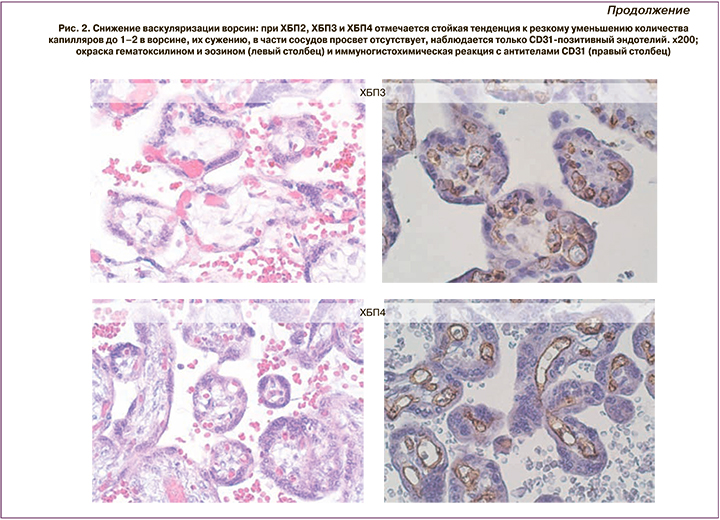
Морфофункциональное состояние системы мать–плацента–плод при хронической болезни почек
С возрастанием степени тяжести основного заболевания нами отмечено снижение перцентильной массы плаценты, статистически значимое при ХБП3 (29,5П) и ХБП4 (13П) в сравнении с ХБП1 (50,5П), при этом последняя, а также ХБП2 (55,5П) не отличались достоверно от контрольной группы (60П). Снижение массы плаценты сопровождалось снижением массы и роста новорожденного при ХБП3 (35,8П) и ХБП4 (1П). Задержка роста плаценты, возможно, связана с длительным снижением объема маточно-плацентарного кровотока с I триместра беременности. Основным механизмом хронического уменьшения объема маточно-плацентарного кровотока являются патологические изменения сосудов [1, 2].
При заболеваниях почек в сочетании с АГ наблюдаются патологические изменения сосудов децидуальной ткани с ухудшением циркуляции, как и при ПЭ. Децидуальная артериопатия может быть слабой степени – с утолщением стенок сосудов базальной пластинки, неполноценной трансформацией спиральных артерий или тяжелой – с фибриноидными некрозами или острым атерозом [8, 9]. Патология сосудов базальной пластинки была характерна для ХБП2, ХБП3 и ХБП4: она проявлялась неадекватной гестационной трансформацией спиральных артерий, тромбозом, кровоизлияниями и некрозами децидуальной ткани, приводящими к снижению маточно-плацентарного и внутриплацентарного кровотока, облитерации межворсинчатого пространства фибриноидом, развитию инфарктов плацентарного диска. Нарушения маточно-плацентарного кровотока могут сопровождаться клиническими проявлениями в виде ПЭ. Причиной ее развития в настоящее время считаются недостаточная инвазия вневорсинкового трофобласта и неполноценное ремоделирование спиральных артерий, приводящих к ухудшению кровоснабжения плаценты с развитием малой плаценты и задержки роста плода [10]. Известно, что тяжелыми последствиями поражения сосудов базальной пластинки могут быть преждевременное созревание ворсин, увеличенное количество синцитиальных узлов, агглютинация терминальных ворсин с увеличением перивиллезного фибрина, множественные инфаркты плаценты разной давности, отражающие прогрессирующий тромбоз децидуальных сосудов, вазоспазм или разрыв с возможной отслойкой плаценты [8, 9]. В наших наблюдениях преждевременное созревание ворсин явилось статистически значимым для ХБП4. При этом тенденция изменения морфологических особенностей плаценты с возрастанием степени тяжести ХБП стойко направлена на гиповаскуляризацию ворсин. Пролиферация эндотелия, выявляемая иммуногистохимическим методом, не обеспечивает васкуло-, ангиогенез и компенсацию тяжелой маточно-плацентарной и плацентарно-плодовой ишемии, не приводит к компенсаторному ангиоматозу при ХБП4. В плацентах при ХБП2, ХБП3 и ХБП4 отмечается стойкая тенденция как к резкому уменьшению количества капилляров до нескольких единиц в ворсине, так и к их сужению до 1–3 мкм² с отсутствием просвета в части из них (рис. 3). На графике кривые ХБП2, ХБП3 и ХБП4 отражают отсутствие капилляров большого сечения, кривая ХБП1 – 15% увеличенных капилляров, а в группе контроля – половину капилляров площадью более 2 мкм². Площадь суммарного сечения капилляров в ворсинах плаценты контрольной группы (1123,5 мкм²) достоверно больше, чем в группах исследования: суммарное сечение капилляров в ворсинах при ХБП1 меньше в 2 раза (497 мкм²), ХБП2 – в 5,5 (205,5 мкм²), ХБП3 – в 3 (402 мкм²), ХБП4 – в 10 раз (104 мкм²). Согласно законам гидродинамики, узкие капилляры оказывают большее сопротивление плацентарно-плодовому кровотоку, что сопряжено с тяжелым течением почечного заболевания. Уменьшение размера и снижение васкуляризации терминальных ворсин отражают прогрессирование плацентарной гипоксии, при этом большая степень отклонения морфометрических параметров ворсин от контрольного уровня отмечена при ранней ПЭ [11]. Полноценный васкулогенез и ангиогенез в плаценте зависят от сбалансированного взаимодействия ангиогенных факторов, основное место среди которых отводится семейству сосудистого эндотелиального фактора роста VEGF [12]. Снижение уровня экспрессии VEGF и его рецептора в терминальных ворсинах плаценты характерно для ранней ПЭ до 34 недель беременности [13]. Поскольку ранее было показано [14], что уровни ангиогенных и антиангиогенных факторов (sFlt1 и PlGF) в сыворотке крови, а также коэффициента sFlt1/PlGF не зависят от стадии ХБП, то патогенез ухудшения васкуляризации ворсин, вероятнее всего, определяется не стадией ХБП, а ПЭ. Об этом свидетельствуют значения коэффициента sFlt1/PlGF на фоне ХБП, определенные во II и III триместрах беременности: они достоверно выше у беременных с последующим развитием ПЭ по сравнению с женщинами, у которых ПЭ не развивалась, как за счет повышения уровня антиангиогенного фактора sFlt1, так и в результате выраженного снижения PlGF [14]. Проблема диагностики ПЭ при ХБП имеет свои особенности из-за общности симптомов. Частота развития ПЭ у пациенток с ХБП составила 30% против 2,3% в Московской области: при ХБП1 – 18,8%, ХБП2 – 37,0%, ХБП3 – 61,8%, ХБП4 – 71,4%. ПЭ явилась причиной досрочного родоразрешения по состоянию плода у 77,5%, прерывания беременности по медицинским показаниями – у 71,4%, острого почечного повреждения – у 75,9% беременных с ХБП.

Повышение частоты аномалий прикрепления пуповины и формы плацентарного диска, характерное для ХБП3 по сравнению с популяционными показателями, возможно, также обусловлено патологией сосудов базальной пластинки. Согласно концепции трофотропизма, краевую и оболочечную локализацию пуповины на плацентарном диске объясняют ростом последнего в зоне интенсивного маточно-плацентарного кровообращения и атрофией ворсин в участках недостаточного кровоснабжения со смещением основания пуповины к краю диска или в экстраплацентарные оболочки [1, 15].
Такие признаки хронической маточно-плацентарной ишемии как облитерационная ангиопатия, многочисленные синцитиальные узлы, мы обнаружили в ⅓ всех наблюдений ХБП. Следует отметить, что в 42% плацент преобладал хорошо выраженный компенсаторный ангиоматоз ворсин. Отсутствие тяжелых ишемических поражений плаценты в большинстве наблюдений и хорошо выраженные компенсаторные изменения ворсинчатого дерева мы связываем с длительным и тщательным наблюдением за течением беременности и проводимой терапией.
Заключение
Статистически значимые структурные изменения плаценты при ХБП проявляются в клиническом симптомокомплексе снижением весо-ростовых показателей новорожденного. При этом стойко наблюдающаяся АГ и присоединившаяся тяжелая ПЭ замыкают патогенетический круг формирования клинико-морфологических особенностей системы мать–плацента–плод при ХБП. Морфофункциональное состояние фетоплацентарного комплекса при ХБП1 не имеет значимых структурных гипоксических изменений в сравнении с контролем. С возрастанием степени тяжести основного заболевания, начиная со стадии ХБП2, прогрессивно снижаются перцентильная масса плаценты и весо-ростовые показатели новорожденного, что патогенетически обусловлено ПЭ с эндотелиальной дисфункцией матери и хронической маточно-плацентарной ишемией, приводящей к необратимым структурным изменениям плаценты – преждевременному созреванию ворсинчатого дерева с гиповаскуляризацией ворсин, одному из самых тяжелых патологических вариантов строения без перспективы дальнейшего роста и адекватного плацентарно-плодового кровотока.



