Все большее применение находит метод экстракорпоральной мембранной оксигенации (ЭКМО), по сути искусственного кровообращения, при разных нозологиях, сопряженных с сердечной и дыхательной недостаточностью или их комбинацией у разных категорий пациентов. Но крайне редко в мире подобная технология применяется у беременных или родильниц [1] по причине крайне высоких рисков потенцирования неблагоприятных сценариев различного рода осложнений, сопряженных с матерью и ребенком (плодом) в акушерской практике. Тем не менее причин, способных спровоцировать необходимость применения ЭКМО по жизненным показаниям у данной категории пациентов, немало. Наиболее частые: острый респираторный дистресс легких по причине пневмонии, особенно вирусной, аспирации, повреждения легких, сопряженного с массивной гемотрансфузией TRALI или сепсисом, эмболия легких амниотической жидкостью или тромбами, кардиомиопатия.
В России это первый случай применения ЭКМО во время развившейся в раннем послеродовом периоде кардиомиопатии, имеющей разные определения (синдром Такоцубо, синдром разбитого сердца, стресс-индуцированная или послеродовая кардиомиопатия), при идентичном патогенезе стагнированного миокарда, в ряде случаев с вторичным спазмом коронарных (венечных) сосудов в ответ на гиперкатехоламинемию с характерным диффузным цитолитическим повреждением миоцитов и нарушением их эффективного сокращения и расслабления, что в конечном итоге может приводить к тяжелым системным циркуляторным нарушениям, вплоть до остановки кровообращения.
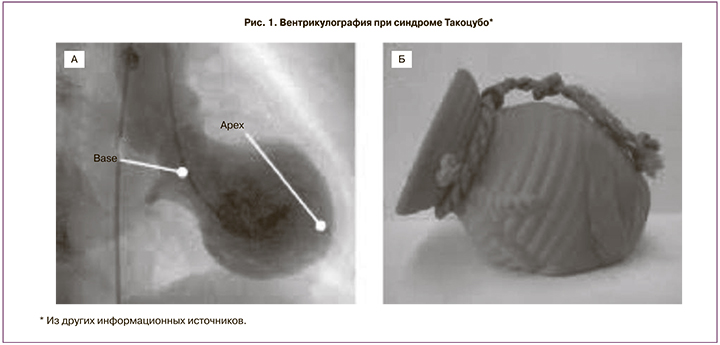
Синдром Такоцубо (TakoTsubo, дословно с японского: Тako – осьминог и Тsubo – ловушка) (рис. 1) был описан в Японии в 1991 г. как характерной формы дилатация левого желудочка при остро возникшей кардиомиопатии. В ряде случаев он может быть сопряжен с драматическим жизнеугрожающим сценарием кардиогенного шока, рефрактерной тяжелой тахикардией, тромбозом полости левого желудочка, трансмуральным разрывом миокарда верхушки левого желудочка и летальностью [2–5]. Причины развития синдрома Такоцубо могут быть разными: сильные эмоциональные переживания, стресс-индуцированная и/или вторичная экзогенная гиперкатехоламинемия (адреналин, норадреналин, допамин), у родильниц – большие дозы окситоцина, сопряженные с маточным кровотечением, в ряде случаев на фоне недостаточности эстрогенов [2, 6]. Диагностика подразумевает наличие маркеров повреждения миокарда (тропонина), ангио- или эхокардиографических признаков стагнированного миокарда и отсутствие окклюзии коронарных (венечных) сосудов [4]. Стоит также отметить тот факт, что кардиомиопатия описанного сценария (синдром Такоцубо) в большинстве случаев носит обратимый характер, и пережившие острый период заболевания пациенты, как правило, имеют неплохие шансы на восстановление сократительной функции миокарда; хотя это может занять несколько недель или даже месяцев [4, 7]. В настоящее время нет однозначных рекомендаций по лечению синдрома Такоцубо, тем не менее определяющими являются:
- устранение факторов стресса, индуцировавших патогенез кардиомиопатии;
- возможное назначение медикаментов, уменьшающих потребности миокарда и всего организма в кислороде (β-блокаторы, ингибиторы ангиотензин-превращающего фермента, α-блокаторы, седативные);
- устройства механической поддержки сократительной функции миокарда (внутриаортальная баллонная контрпульсация (ВАБК), ЭКМО) при неэффективности консервативной терапии [4].
Необходимость применения активной антикоагулянтной терапии во время ЭКМО может значимо потенцировать риски развития акушерских кровотечений в раннем послеродовом периоде [6], что также сдерживает применение устройств вспомогательного кровообращения в клинической практике.
Клиническое наблюдение
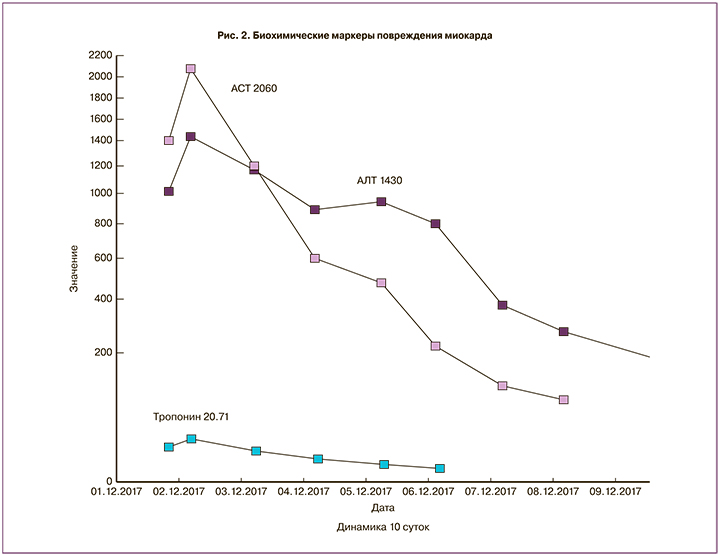
Пациентка Б., 29 лет, вес 51 кг, рост 158 см. Из анамнеза: 1-е срочные роды дихориальной диамниотической двойней (кесарево сечение) от 30.11.2017, гипотоническое кровотечение, через несколько часов – релапаротомия, гистерорафия с частичной перевязкой маточных и яичниковых артерий, геморрагический шок 3 степени. В раннем после-операционном периоде после повторной операции развились тяжелый циркуляторный шок 3 степени и синдром полиорганной недостаточности. Пациентка перенесла четыре эпизода клинической смерти в интервале 2 ч на этапе межгоспитального перевода родильницы из акушерского стационара в дежурный многопрофильный стационар скорой помощи, в том числе 2 эпизода в машине скорой помощи, потребовавших неотложных реанимационных мероприятий на этапе 1-й межгоспитальной транспортировки. Общая продолжительность сердечно-легочной реанимации составила 47 мин. На эхокардиографии (ЭКГ) отмечалось прогрессирующее снижение фракции выброса левого желудочка (ЛЖ) 18–12–6% с тотальным выраженным гипокинезом всех камер сердца, АД 60/43 мм рт. ст., центральное венозное давление +14 мм рт. ст., частота сердечных сокращений 150/мин, на ЭКГ – полиморфные расширенные комплексы QRS c периодическими непродолжительными пробежками желудочковой тахикардии. Адренергическая поддержка комбинацией адреналина – 0,6 мкг/кг/мин, добутамина – 25 мкг/кг/мин, норадреналина – 0,3 мкг/кг/мин. В анализах кислотно-основного состояния (КОС) – выраженный дисциркуляторный лактат-ацидоз (pH – 7,21, BE – 8, лактат – 18 ммоль/л). Стоит отметить, что биохимические маркеры повреждения миокарда, которые были взяты позже в 3-м лечебном учреждении, где проходил основной этап лечения пациентки, многократно превышали референсные значения с максимумом на 2-е сутки (рис. 2) от развития эпизодов клинической смерти на фоне циркуляторного шока. Состояние расценено как стресс-индуцированная жизнеугрожающая кардиомиопатия, или синдром Такоцубо тяжелого течения с резко отрицательной динамикой состояния пациентки и прогрессирующей полиорганной недостаточностью (кома – 2 ст., анурия, угасание рефлексов). Было принято решение об экстренном подключении ВАБК с целью механической поддержки кровообращения и выигрыша времени до прибытия специализированной бригады из городского Центра ЭКМО-терапии на базе клиники МЧС в Санкт-Петербурге.
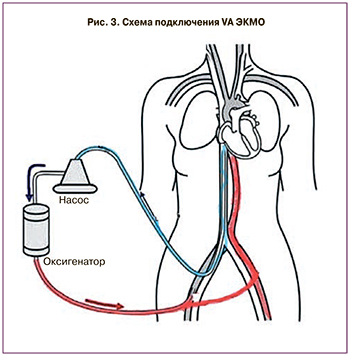 Прибытие бригады через 1 ч 05 мин от момента ее вызова, дистанция 16 км. Периферическое пункционное подключение ВА-ЭКМО (рис. 3) в течение 24 мин по схеме: заборная канюля – 23 Fr, бедренная вена, возвратная канюля – 15 Fr, бедренная артерия. Стабилизация гемодинамики, газообмена, КОС, снижение доз инотропных препаратов (адреналин – 0,05 мкг/кг/мин, норадреналин – 0,1 мкг/кг/мин) на фоне комбинированной механической поддержки кровообращения ВАБК 1:2 + ЭКМО 3,0 л/мин и последующая 2-я межгоспитальная транспортировка пациента наземным транспортом (реанимобиль С-класс) силами специализированной бригады городского Центра ЭКМО в клинику МЧС (ВЦЭРМ им. А.М. Никифорова). Время в пути составило 39 мин. В приемном покое Центра ЭКМО, куда пациентка была доставлена в общей сложности через 16 ч от оперативного родоразрешения, выполнена мультиспиральная компьютерная томография (МСКТ) по программе «политравма», с целью оценки геморрагий и постгипоксического отека головного мозга, а также органов брюшной полости, малого таза, забрюшинного пространства после ранее выполненных операций. В соответствии с принятым в Центре протоколом первичного обследования ЭКМО пациентов также выполнена МСКТ заборных магистралей и оксигенатора с контрастированием в ангиорежиме с целью внутрисосудистого позиционирования канюль, исключения «эндоликов» и тромбов, в экстракорпоральном контуре искусственного кровообращения.
Прибытие бригады через 1 ч 05 мин от момента ее вызова, дистанция 16 км. Периферическое пункционное подключение ВА-ЭКМО (рис. 3) в течение 24 мин по схеме: заборная канюля – 23 Fr, бедренная вена, возвратная канюля – 15 Fr, бедренная артерия. Стабилизация гемодинамики, газообмена, КОС, снижение доз инотропных препаратов (адреналин – 0,05 мкг/кг/мин, норадреналин – 0,1 мкг/кг/мин) на фоне комбинированной механической поддержки кровообращения ВАБК 1:2 + ЭКМО 3,0 л/мин и последующая 2-я межгоспитальная транспортировка пациента наземным транспортом (реанимобиль С-класс) силами специализированной бригады городского Центра ЭКМО в клинику МЧС (ВЦЭРМ им. А.М. Никифорова). Время в пути составило 39 мин. В приемном покое Центра ЭКМО, куда пациентка была доставлена в общей сложности через 16 ч от оперативного родоразрешения, выполнена мультиспиральная компьютерная томография (МСКТ) по программе «политравма», с целью оценки геморрагий и постгипоксического отека головного мозга, а также органов брюшной полости, малого таза, забрюшинного пространства после ранее выполненных операций. В соответствии с принятым в Центре протоколом первичного обследования ЭКМО пациентов также выполнена МСКТ заборных магистралей и оксигенатора с контрастированием в ангиорежиме с целью внутрисосудистого позиционирования канюль, исключения «эндоликов» и тромбов, в экстракорпоральном контуре искусственного кровообращения.
Результаты и обсужение
Продолжительность ВАБК составила 7 сут, ЭКМО – 12 сут, искусственной вентиляции легких – 13 сут, пребывание в ОРИТ – 17 сут, в стационаре – 50 сут. Выписка из стационара с полным восстановлением когнитивных функций, минимальными проявлениями полинейропатии и рекомендованным дозированным увеличением физической активности в течение последующих 3 мес под руководством врача восстановительной медицины. Через 7 мес отмечено полное восстановление всех функций и толерантности до исходного уровня физической активности до беременности.
В стационаре основного этапа лечения предстояло решить целый ряд вопросов. Тактика акушерско-гинекологического сопровождения оперированной матки с признаками гемометры: был выбран консервативный сценарий сохранения матки с тактикой динамического наблюдения по критериям потенциального развития синдрома диссеминированного внутрисосудистого свертывания и инфекционных осложнений. Безусловно, решение спорное, но ретроспективно оправданное, исходя из рисков дополнительной операции и сопряженного с ней еще большего кровотечения на фоне гепаринотерапии в условиях искусственного кровообращения. Проведенная терапия: большиедозы транексамовой кислоты – 2 г/сут, постоянная внутривенная инфузия в течение первых 24 ч, переливание свежезамороженной плазмы до уровня нормального референсного значения антитромбина-III, гепаринотерапия с целевым активированным частичным тромбопластиновым временем (АЧТВ) 40 с и с последующим его увеличением до 50 с через 6 ч по критериям состоятельности хирургического гемостаза оперированной матки. Антибактериальная терапия проводилась в максимальных дозах комбинацией: меропенем 3 г/сут, линезолид, тигециклин с последующей коррекцией схемы на увеличение дозы меропенема до 8 г/сут и добавление колистиметата натрия по результатам бактериологического анализа скрининга инфекционных локусов с определением антибактериальной чувствительности и минимальной подавляющей концентрации «на входе в клинику». Возможности провести деэскалацию не было по причине активного высева панрезистентной Klebsiella pneumoniae и полирезистентной Acinetobacter baumannii из нескольких локусов. Динамическая оценка состояния матки в сочетании с прокальцитонином в интервале каждых 12 ч в течение первых 3 суток позволила с большей уверенностью придерживаться ранее выбранной тактики. Особенностью ведения родильницы на ЭКМО является необходимость ранней профилактики лактационных маститов, что требует назначения каберголина 0,5 мг с интервалом 12 ч через желудочный зонд и регулярного сцеживания через каждые 4 ч до полного подавления лактации. Целесообразность глубокой нейровегетативной защиты, в том числе в комбинации с гипотермией, могла быть логичной в саногенезе гипоксического повреждения головного мозга, но имела относительные противопоказания с позиции исключения кардиодепрессивных эффектов седативных препаратов (тиопентал натрия, пропофол) [8], а также гипокоагуляционного эффекта системной гипотермии на качество гемостаза [9]. Компромиссным решением была выбрана тактика умеренной нейровегетативной блокады головного мозга преимущественно за счет фентанила в режиме 36,0˚ С нормотермической перфузии с помощью терморегулирующего устройства, не допуская даже субфебрильного повышения температуры. Эта тактика была оправдана по критериям комплексной оценки выраженности постгипоксического повреждения головного мозга: отсутствие выраженного отека и/или судорожной активности, сохранение скоростных характеристик церебрального кровообращения. По истечении 7-х суток, когда встал вопрос об этапной деэскалации механической поддержки сердца (отключение ВАБК), было принято решение о практически полном прекращении введения фармакологических препаратов с седативным эффектом и ранней оценкой ЭЭГ с наведенными потенциалами биоэлектрической стимуляции головного мозга. До этапа отлучения пациента от ЭКМО и механической вентиляции легких применялся в минимальных дозах дексмедетомидин 0,2 мкг/кг/ч по требованию, согласно тактике ранней активизации пациента с целью профилактики совокупности рисков реанимационных осложнений [10]. Отдельного упоминания заслуживает вопрос целесообразности хирургической декомпрессии ЛЖ: на начальных этапах в интервале 6 ч у пациентки проводили динамическую оценку состояния камер сердца, в том числе признаков их спонтанного контрастирования, отмечены четыре степени, свидетельствующие о нарастающем риске тромбоза ЛЖ. Критериями отказа от дополнительного хирургического вмешательства с минимальной, но все же травмой миокарда для нас являлись следующие ЭКГ-признаки: эффективное открытие створок аортального клапана в систолу, спонтанное контрастирование ЛЖ ≤1 ст., конечно-диастолический объем (КДО) ЛЖ <110 мл (норма для женщин – 89±20 мл). Оставаться в пределах вышеуказанных целевых параметров позволяла балансировка между минимально-достаточной производительностью центрифужного насоса аппарата ЭКМО (уменьшает постнагрузку на ЛЖ) и нежелательной, с позиции патогенеза синдрома Такоцубо, но в данном случае компромиссной адренергической стимуляцией миокарда адреналином в минимальных терапевтических дозах 0,02–0,05 мкг/кг/мин. Сочетание ЭКМО с ВАБК в этом случае также оправдано синергично направленным эффектом поддержки сердца [11]; частота баллонных систол <100/мин, что обеспечивается в большинстве случаев соотношением 1:2 (ВАБК/ЧСС). Ретроспективно можно смело говорить о правильно выбранной тактике принятия решения в отношении целесообразности постановки декомпрессора ЛЖ.
Вопрос риска вероятности летального исхода в ходе предстоящей транспортировки пациентки в условиях искусственного кровообращения или транспортного ЭКМО из стационара № 2 в стационар №3 нами оценивался с помощью авторского метода наложения шкал APACHE-IV и SAVE, в результате чего было получено прогностическое снижение вероятности летального исхода в условиях ЭКМО-поддержки с 88,5 до 55%, что, безусловно, давало больше оснований для применения данного метода поддержки гемодинамики на этапах межгоспитальной транспортировки и последующего лечения в специализированном Центре ЭКМО терапии [12]. Тем не менее юридически подобная тактика является неправомерной на сегодняшний день, исходя из рекомендаций Министерства здравоохранения от 26.11.2015 «Организация медицинской эвакуации беременных женщин, рожениц и родильниц при неотложных состояниях» [13], где рефрактерный шок любого генеза расценивается как абсолютное противопоказание к возможности межгоспитальной эвакуации данной категории пациентов (беременные, роженицы, родильницы), исходя из логики их «нетранспортабельности», и любая консультативная помощь в этом случае должна оказываться на базе стационара акушерского профиля. В этих рекомендациях, тем не менее, упоминается метод ЭКМО, но исключительно в контексте возможности его применения у пациенток с дыхательной недостаточностью. Справедливости ради стоит отметить, что специализированных международных рекомендаций транспортировки в условиях ЭКМО-терапии у этой категории пациентов также не существует [14, 15].
Вышеизложенное клиническое наблюдение свидетельствует о возможности эффективного применения технологии ЭКМО на этапах межгоспитальной эвакуации и лечения в условиях специализированных региональных центров ЭКМО-терапии у пациенток акушерского профиля с жизнеугрожающей сердечной недостаточностью, в том числе с рефрактерным циркуляторным шоком. Однако существующая нормативная база требует изменений и разработки современных национальных методических рекомендаций по актуальным вопросам представленной темы.



