Активные формы кислорода, происхождение и значение для жизни клетки
Свободные радикалы кислорода (активные формы кислорода, АФК) могут принимать участие в самых разных клеточных процессах – как физиологического, так и патологического характера, вступая в химические реакции с молекулами внутри клеток. Известно, что при определенных условиях даже физиологический уровень АФК в клетках может способствовать не только их выживанию, пролиферации и дифференцировке, но и вызывать гибель путем индукции апоптоза или некроза [1, 2]. Подобное состояние клетки называется окислительный стресс и может быть определено как дисбаланс между АФК и внутриклеточными антиоксидантами.
Окислительный стресс оказывает непосредственное токсическое действие на клетки и приводит к индукции перекисного окисления липидов, повышению уровня окисленных белков и повреждению ДНК. В последнее время признано, что именно окислительный стресс играет роль первопричины развития у человека почти всех известных тяжелых патологий, включая рак [3, 4], сердечно-сосудистые и нейродегенеративные [5] заболевания, а также участвует в процессе старения [6, 7] и хроническом воспалении [8].
Обычно в АФК превращается лишь небольшой процент кислорода, поступающего в клетки (по современным оценкам примерно от 1 до 4%) [9]. При этом именно митохондриальная электрон-транспортная цепь непосредственно генерирует супероксид анион-радикал (О2•-), служащий первичным радикалом [10] и являющимся родительским по отношению к остальным, в связи с чем митохондрии представляются наиболее важным сайтом внутриклеточной продукции АФК.
Обычно О2•- утилизируется непосредственно в сайте продукции с помощью специфического фермента – митохондриальной марганцевой супероксиддисмутазы (Mn-SOD или SOD2), с образованием пероксида водорода (H2O2) [11]. Токсичность непосредственно H2O2 в клетках ограничена ввиду ее низкой способности к реакции, однако перекись имеет длительный период полураспада (> сек) и может легко проходить через мембраны. Хотя Н2О2 далее в митохондриях при помощи фермента глутатион перокскидазы(GPX) также превращается в H2O [12], часть ее, при определенных обстоятельствах достаточно значимая, может диффундировать в цитозоль, проходить сквозь мембраны, попадая во все клеточные органеллы, ядро и внеклеточное пространство. Это, безусловно, может быть причиной увеличения концентрации как общих клеточных, так и тканевых АФК. Наконец, в присутствии иона переходного металла, например Fe2+, H2O2 также легко превращается в гидроксильный радикал (•ОН) (реакция Фентона) [13].
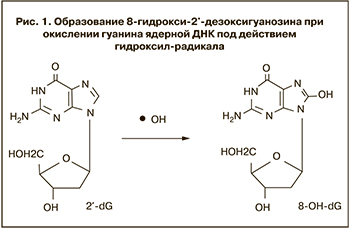
Период полураспада гидроксильного радикала в водной среде менее 1 нс [14], но это соединение обладает высокой реакционной способностью. В естественных условиях •ОН наносит существенный ущерб клеточным молекулам, так как разрушает практически любые соединения, в непосредственной близости от которых радикал образуется [15]. Особенно опасно формирование •ОН в непосредственной близости от ДНК, поскольку это может привести к радикальным взаимодействиям с азотистыми основаниями ДНК или с дезоксирибозой сахароуглеродного скелета ДНК и образованию поврежденных оснований, а также разрывам цепи. Так как наиболее чувствительное основание в составе ДНК – это гуанин (G), то обычно гидроксильные радикалы с ним и реагируют с образованием 8-гидрокси-2’-дезоксигуанозина (8-OHdG) (рис. 1). Таким образом, 8-OHdG является одним из основных продуктов окисления ДНК и чувствительным маркером генотоксического окислительного повреждения ДНК [16].
Участие АФК в процессе созревания фолликула и овуляции
Овуляция инициируется выбросом лютеинезирующего гормона (ЛГ) и сопровождается различными изменениями состояния и морфологии фолликула. Механизм овуляции сравним с воспалительной реакцией [17]. Компоненты воспаления, которые принимают участие в овуляции, включают подъем уровня синтеза простагландинов и увеличение продукции цитокинов, активацию протеолитических ферментов и повышение проницаемости сосудов [18]. АФК являются важными медиаторами этих воспалительных реакций; как сообщается в ряде работ, радикалы принимают непосредственное участие в индукции овуляции [19]. Известно, что во время овуляции АФК производятся макрофагами, нейтрофилами и активированными сосудистыми эндотелиальными клетками, находящимися в фолликуле [20].
Хотя АФК играют важную роль в разрыве фолликула во время овуляции, они потенциально могут повредить яйцеклетки и клетки гранулезы, успешно переживающие действие ЛГ. Кроме того, АФК как было недавно установлено, непосредственно ингибируя стероидогенные ферменты и разрушая внутриклеточные белки-носители, обеспечивающие транспорт холестерина в митохондрии, подавляют выработку клетками прогестерона в ответ на ЛГ [20, 21]. Наконец, АФК также могут нарушать интактность плазматической мембраны лютеин-чувствительных клеток, поскольку индуцируют свободнорадикальное перекисное окисление липидов; как следствие, окислительное повреждение клеточных мембран часто рассматривают как причину регресса желтого тела [22].
 АФК также имеют важное значение для созревания яйцеклетки – так как окислительное фосфорилирование, сопряженное с восстановлением кислорода в терминале электронтранспортной цепи митохондрий является основным источником энергии, необходимой для созревания яйцеклетки из зародышевого пузырька (GV) до стадии метафазы II (MII), определяемой по появлению первого полярного тельца. MII ооциты имеют высокий уровень потребления аденозинтрифосфата (АТФ) 23]. Однако, как показано для клеток, живущих в условиях избытка кислорода (40% в листьях растений), повышенная продукция АФК приводит к ингибированию АТФ-синтетазы [24] и глубокому повреждению митохондрий; содержание АТФ в ооцитах в итоге сильно снижается 24, 25]. Было показано, что уровень АТФ имеет критичное значение для ооцита и имеет место прямая корреляция между количеством АТФ и качеством ооцитов [25]. Таким образом, избыточное количество АФК при окислительном стрессе может быть первичной причиной плохого качества ооцитов, поскольку именно АФК вызывают перекисное окисление липидов клеточных мембран, а также приводят к снижению содержания в ооцитах интактной ДНК. Кроме того, АФК вызывают блок развития фертилизованного ооцита на стадии двух бластомеров, индуцируют апоптоз, а у мышей и хомяков даже ингибируют само оплодотворение [26]. Есть сообщения о регистрации более высокого уровня H2O2 во фрагментированных эмбрионах человека и неоплодотворенных яйцеклетках по сравнению с нефрагментированными эмбрионами [27].
АФК также имеют важное значение для созревания яйцеклетки – так как окислительное фосфорилирование, сопряженное с восстановлением кислорода в терминале электронтранспортной цепи митохондрий является основным источником энергии, необходимой для созревания яйцеклетки из зародышевого пузырька (GV) до стадии метафазы II (MII), определяемой по появлению первого полярного тельца. MII ооциты имеют высокий уровень потребления аденозинтрифосфата (АТФ) 23]. Однако, как показано для клеток, живущих в условиях избытка кислорода (40% в листьях растений), повышенная продукция АФК приводит к ингибированию АТФ-синтетазы [24] и глубокому повреждению митохондрий; содержание АТФ в ооцитах в итоге сильно снижается 24, 25]. Было показано, что уровень АТФ имеет критичное значение для ооцита и имеет место прямая корреляция между количеством АТФ и качеством ооцитов [25]. Таким образом, избыточное количество АФК при окислительном стрессе может быть первичной причиной плохого качества ооцитов, поскольку именно АФК вызывают перекисное окисление липидов клеточных мембран, а также приводят к снижению содержания в ооцитах интактной ДНК. Кроме того, АФК вызывают блок развития фертилизованного ооцита на стадии двух бластомеров, индуцируют апоптоз, а у мышей и хомяков даже ингибируют само оплодотворение [26]. Есть сообщения о регистрации более высокого уровня H2O2 во фрагментированных эмбрионах человека и неоплодотворенных яйцеклетках по сравнению с нефрагментированными эмбрионами [27].
Защитные системы фолликула. Оценка качества ооцитов по уровню окислительного стресса и активности антиоксидантной системы (АО)
Важным элементом системы контроля уровня АФК в фолликуле является АО, локализованная в полости фолликула в фолликулярной жидкости (рис. 2 см. на вклейке). Именно фолликулярная жидкость служит «биологическим окном» для понимания процессов, происходящих в микроокружении зрелых ооцитов и идентификации факторов, обусловливающих их качество, способность к оплодотворению и успешность программ ЭКО/ИКСИ [28, 29].
В проспективном исследовании, проведенном Oyawoye и соавт., методом оценки восстановленности комплексов железа (FRAP – ferric. reducing/antioxidant power) была оценена общая антиоксидантная активность (total antioxidant capacity, TAC). При пункции фолликулов у 63 женщин, проходящих программу ЭКО в стимулированном цикле, было собрано 303 образца фолликулярной жидкости. Большая часть образцов – 218 (71,9%) были получены из фолликулов, содержащих ооцит, но оказалось, что базальный уровень TAC не зависел от наличия ооцита. Из всего количества ооцитов 169 77,5%) были оплодотворены, из них 134 (79,3%) эмбриона дожили до дня переноса. Базальный уровень TAC был значительно выше в образцах фолликулярной жидкости, полученной при пункции фолликулов, содержащих ооциты, в дальнейшем успешно оплодотворившиеся. Это дало исследователям основание предположить на первом этапе работ, что высокий уровень TAC может служить предиктором высокого потенциала оплодотворения. Однако впоследствии была выявлено, что выживаемость эмбрионов на день переноса наблюдается в достаточно большом диапазоне ТАС, в том числе и при ее низких значениях [30]. Наблюдение, говорящее о связи высокого уровня TAC и потенциала оплодотворения ооцитов, не противоречит результатам исследования Paszkowski et al., согласно которым были отмечены более высокие значения активности антиоксидантного фермента глутатионпероксидазы (GSHPx) в фолликулах, дающих ооциты, в дальнейшем успешно оплодотворяющиеся, по сравнению с активностью в фолликулах с не оплодотворившимися ооцитами [31]. В работе Agarwal и соавт. также была отмечена положительная корреляция между TAC и частотой наступления беременности у женщин в программах ЭКО [32]. В то же время низкий базальный уровень TAC среди эмбрионов с высокой выживаемостью на день переноса противоречит данным ряда исследований [27, 33, 34]. Oyawoye и соавт. предположили, что такие расхождения могут быть обусловлены зависимостью глубины проявления радикальных повреждений при действии АФК от стадии развития эмбриона. Величина снижения TAC спустя 72 ч после получения ооцита не имела значительных различий между фолликулами, содержащих ооцит и пустыми фолликулами; не было зависимости ни от статуса оплодотворения, ни от выживаемости эмбрионов на день переноса. Такие результаты дают основания полагать, что абсолютные величины скоростей ферментов АО в фолликулярной жидкости имеют низкую прогностическую ценность для расчета успешности оплодотворения и выживаемости эмбрионов на день переноса.
В исследовании Attaran и соавт. уровень АФК и ТАС в фолликулярной жидкости были рассчитаны методом стационарного приближения при помощи измерения хемилюминесценции специфического в отношении АФК зонда для 53 женщин, проходящих программу ЭКО [35]. Уровень АФК в фолликулярной жидкости был значительно выше у забеременевших женщин в результате программы ЭКО, чем у женщин, беременность у которых не наступила. В то же время зависимости TAC от наступления беременности выявлено не было. Однако отсутствие контрольной группы здоровых женщин в не стимулированном цикле исключает возможность сопоставления исследуемой популяции с популяцией здоровых фертильных женщин.
Wiener-Megnazi и соавт. использовали метод термохемилюминесценции (TCL) для измерения уровня оксидативного стресса в образцах фолликулярной жидкости, полученных от 189 женщин, проходящих программу ЭКО [28]. После селекции группы по возрастному критерию была выявлена положительная корреляция между уровнем окислительного стресса и числом полученных зрелых ооцитов (р<0,0001). Все беременности были отмечены при амплитуде TCL на 50с в пределах 347–569 cps. Значения 385 ps и 569 cps были приняты как пороговые величины; негативные прогностические значения вне этого промежутка составили 96%, а позитивные 32% (р<0,004). Согласно полученным результатам был предложен благоприятный пороговый уровень окислительного стресса. Существование допустимого порогового уровня также предположили Das и соавт. в результате оценки 208 образцов фолликулярной жидкости от 78 женщин, проходящих программу ЭКО со стимуляцией функции яичников [36].
 Предполагается, что свободные радикалы кислорода обусловливают возрастное снижение способности к оплодотворению. Свободнорадикальная активность человеческой фолликулярной жидкости повышается с возрастом, вызывая апоптоз клеток гранулезы и кумулюса. Так, у женщин старшего возраста отмечается окислительное повреждение структуры ооцита и клеток гранулезы примордиальных фолликулов [29, 37, 38]. Т. Takahashi и соавт. предположили, что длительное воздействие АФК на старые ооциты негативно влияет на кальциевый гомеостаз и повреждает Ca2+-зависимую передачу сигналов, снижая способность ооцита к развитию. Пероксид водорода снижает циклический аденозинмонофосфат (цАМФ)-зависимый и цАМФ-независимый стероидогенез. И клетки гранулезы, и лютеальные клетки отвечают на воздействие пероксида водорода уменьшением ответа на гонадотропин и ингибированием секреции прогестерона [39]. Окислительный стресс также ведет к регрессу и недостаточности желтого тела беременности [29]. При этом в экспериментальных исследованиях установлен защитный эффект эстрадиола в отношении апоптоза. Предположительно вырабатываемый яичниками эстрадиол функционирует как скавенджер АФК в процессе фолликулогенеза и функционирования желтого тела беременности [37].
Предполагается, что свободные радикалы кислорода обусловливают возрастное снижение способности к оплодотворению. Свободнорадикальная активность человеческой фолликулярной жидкости повышается с возрастом, вызывая апоптоз клеток гранулезы и кумулюса. Так, у женщин старшего возраста отмечается окислительное повреждение структуры ооцита и клеток гранулезы примордиальных фолликулов [29, 37, 38]. Т. Takahashi и соавт. предположили, что длительное воздействие АФК на старые ооциты негативно влияет на кальциевый гомеостаз и повреждает Ca2+-зависимую передачу сигналов, снижая способность ооцита к развитию. Пероксид водорода снижает циклический аденозинмонофосфат (цАМФ)-зависимый и цАМФ-независимый стероидогенез. И клетки гранулезы, и лютеальные клетки отвечают на воздействие пероксида водорода уменьшением ответа на гонадотропин и ингибированием секреции прогестерона [39]. Окислительный стресс также ведет к регрессу и недостаточности желтого тела беременности [29]. При этом в экспериментальных исследованиях установлен защитный эффект эстрадиола в отношении апоптоза. Предположительно вырабатываемый яичниками эстрадиол функционирует как скавенджер АФК в процессе фолликулогенеза и функционирования желтого тела беременности [37].
Многие тиоловые соединения выступают в роли ловушек для АФК. В исследовании M. Borowiecka и соавт. был оценен уровень продуктов окисления липидов и белков в фолликулярной жидкости 82 женщин, проходящих программу ЭКО. Измеряли уровень TBARS (молекул, реактивных в отношении тиобарбитуровой кислоты), карбонилирования белков (СР) и количество свободных тиоловых групп (SH) [40]. Маркеры окислительного стресса подверглись сравнительному анализу в группах с наступившей и ненаступившей беременностью. Две группы пациентов были сравнены в отношении возраста, индекса массы тела и гормонального статуса (антимюллеровый гормон, эстрадиол). Карбинилы и свободные тиолы были оценены с помощью иммуноферментного анализа, сопряженного с измерением флюоресценции (ELISA) и реагента Эллмана (Ellman reagent – 5, 5’-dithiobis-2-nitrobenzoic acid, DTNB). Значения TBARS для фолликулярной жидкости от 29 забеременевших женщин были 0,954±0,420 µmol/l, что было в два раза ниже, чем в группе пациенток (53 человека), не достигших беременности (1,961±0,796 µmol/l) при p<0,0001. В группе пациенток, не достигших беременности, наблюдался двукратный подъем уровней СР в сравнении с группой пациенток, достигших беременности (2,969±0,723 против 1,523±0,254; p<0,0001). Возраст и индекс массы тела были значительно выше в группе пациенток, не достигших беременности. Не было выявлено статистически значимой разницы между уровнем свободных тиолов и изучаемыми показателями гормонального статуса в исследуемых группах. Результаты свидетельствовали, что повышенный уровень продуктов перекисного окисления липидов и белков может служить прогностически неблагоприятным критерием в отношении исходов программ ЭКО. Данное исследование поддерживает гипотезу, что низкий уровень маркеров окислительного стресса имеет важное значение в отношении фертильности.
В ряде исследований представлены доказательства системного характера окислительного стресса у пациенток с бесплодием, проходящих программу ЭКО. Схожие уровни маркеров оксидативного стресса в фолликулах, аспирированных из правого и левого яичника, были продемонстрированы в работе K.B.K. in и соавт. [41]. Косвенно доказана взаимосвязь окислительного стресса и уровня антифосфолипидных антител. Выявлена положительная корреляция присутствия антифосфолипидных антител в плазме крови и высокого уровня окислительного стресса в плазме крови женщин с бесплодием, проходящих программу ЭКО 42–44]. В пилотном исследовании как маркер оксидативного стресса в сыворотке крови пациентов, проходящих программу ЭКО, был выявлен 8,12-изо-простагландин F2a (8,12-iso-iPGF2a).
Исследование роли интрафолликулярного и системного уровня окислительного стресса и АО в программах ЭКО/ИКСИ было целью исследования Agne Velthut и соавт. [45]. В исследовании участвовали 102 пациентки, проходившие стимуляцию функции яичников в рамках программы ЭКО/ИКСИ. Исследованию подлежала фолликулярная жидкость, плазма крови и моча, взятые в день пункции яичников. Были измерены общая концентрация перекиси водорода и TAС, на базе которых посчитан индекс окислительного стресса. Также была измерена мочевая концентрация 8-изо-простагландина F2a (F2IsoP). Была выявлена положительная корреляция между интрафолликулярным уровнем окислительного стресса и исходом стимуляции функции яичников: было использовано меньше препарата ФСГ и получено больше ооцитов. Кроме того, у пациенток с высоким индексом окислительного стресса был зарегистрирован более высокий уровень сывороточного эстрадиола. Однако высокий уровень F2IsoP коррелировал с низким качеством полученных ооцитов, а также был значительно выше у курящих пациентов. Пациенты с эндометриозом имели более низкий уровень фолликулярных показателей антиоксидантной защиты. Наиболее важным заключением исследования стала выявленная положительная корреляция между системной ТAС крови и наступлением беременности (р=0,03).
В работе Celik и соавт. целью исследования было определить, есть ли различия уровней маркеров оксидативного стресса в фолликулярной жидкости и сыворотке крови в протоколах стимуляции функции яичников с антагонистами (антГнРГ) и агонистами (аГнРГ) гонадотропин-рилизинг гормона [46]. Оценке подлежали: малоновый диальдегид (MDA), оксид азота (NO), карбонилы в белках (CР), гидроксипролин (OH-P), супероксиддисмутаза (SOD), восстановленный глутатион (GSH), глутатионпероксидаза (GSH-Px), аденозиндезаминаза (ADA) и ксантиноксидаза (XO). Значения сывороточных концентраций GSH, GSH-Px и MDA были ниже в группе протокола с антГнРГ по сравнению с группой протокола с аГнРГ, но уровень сывороточного SOD был выше в группе протокола с аГнРГ. Значения концентраций фолликулярных SOD, ADA и NO были выше в группе протокола с антГнРГ по сравнению с группой протокола с аГнРГ. Статистически значимых различий в исходах программ ЭКО/ИКСИ обнаружено не было. В ходе данного исследования была выявлена взаимосвязь между повышенным уровнем окислительного стресса и применением в циклах ЭКО/ИКСИ протокола стимуляции функции яичников с антГнРГ.
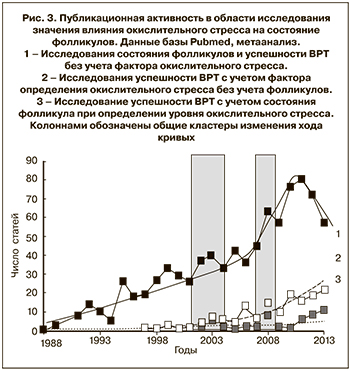
Завершая обзор данных литературы, посвященный значению оценки уровня окислительного стресса в программах вспомогательных репродуктивных технологий, следует отметить, что вопрос о степени влияния гормональной нагрузки при выбранном способе стимуляции суперовуляции на уровень окислительного стресса остается открытым, несмотря на колоссальный объем выполненных работ. Также открыт вопрос о необходимости применения индукции овуляции для пациентов с абсолютным трубным фактором бесплодия при отсутствии иных причин. Можно заключить, что для оптимизации лечения бесплодия методом ЭКО с учетом уровня окислительного стресса необходимы дальнейшие исследования в направлениях, отражающих общие тенденции распределения активности научных групп в данной области (рис. 3).



