В последние десятилетия наблюдается непрерывный прогресс в развитии репродуктивной медицины, ведущий к совершенствованию вспомогательных репродуктивных технологий. Несмотря на это, по данным мировой статистики, частота наступления беременности достигла своего плато и не меняется кардинально на протяжении последнего десятилетия [1, 2]. В этой связи в настоящее время интерес специалистов сосредоточен на поиске причин повторных неудач программ экстракорпорального оплодотворения (ЭКО) и отсутствия имплантации при переносе эмбрионов хорошего качества [3]. Другим не менее важным и крайне интересным аспектом является феномен так называемого «ареста» раннего эмбриогенеза, подразумевающий остановку развития эмбриона на ранних этапах или же недостаточное получение бластоцист хорошего качества. Доказано, что именно частота формирования бластоцисты, которая должна составлять не менее 60%, является ключевым показателем эффективности программ ЭКО [4].
Известно, что около 40% эмбрионов останавливаются в своем развитии на различных стадиях в течение всего преимплантационного периода [5]. Эмбрион, остановившейся в развитии, характеризуется отсутствием признаков митотического клеточного деления как минимум в течение 24 часов, а также явлениями дегенерации и лизирования.
В зависимости от стадии развития, на которой отмечается остановка эмбриона, наблюдаются: отсутствие дробления после стадии зиготы, остановка дробления на 2–3-й день, когда предполагается, что эмбрион находится между стадией 2–8 клеток, неспособность уплотняться до морулы или сформировать бластоцисту [6]. Исследователями были предложены различные теории, пытающиеся объяснить механизмы нарушения развития преимплантационного эмбриона [7–9]. Одна из наиболее известных рассматривает «арест» как защитный механизм для предотвращения дальнейшего развития эмбрионов низкого качества [7, 8]. Другая гипотеза предполагает, что, помимо остановки развития, отражающей предопределенный внутренний сценарий процессов естественного отбора, когда некачественные эмбрионы «отсекаются», необходимо учитывать определенную роль культивирования эмбриона in vitro в условиях, отличающихся от естественных [9].
Основываясь на гипотезе о том, что возможной причиной нарушения развития эмбриона могут быть условия культивирования, которые, несомненно, отличаются от естественных, в настоящей работе была предпринята попытка устранить этап развития эмбриона вне организма и перенести в полость матки эмбрион на стадии зиготы, то есть сразу же после констатации оплодотворения. Указанное решение было принято эмпирически для тех пациенток, у которых при многочисленных (3 и более) попытках ЭКО имела место одна и та же ситуация, а именно остановка развития эмбрионов на 3-и сутки культивирования. В этих случаях, как правило, врач может предложить прибегнуть к использованию ооцитов донора, что является тяжелым решением для пациентов молодого возраста. В данной статье описывается опыт применения методики переноса зигот у 37 пациенток, имеющих «арест» эмбрионов в предыдущих попытках ЭКО.
Цель исследования: оценить эффективность переноса эмбриона в полость матки на стадии зиготы у пациенток с нарушением развития эмбрионов при неоднократных попытках ЭКО.
Материалы и методы
В проспективное исследование включены 37 пар, проходивших лечение методами ЭКО/ИКСИ в ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» МЗ РФ с января по декабрь 2021 г.
Все пациентки, включенные в исследование, имели не менее 3 безуспешных попыток ЭКО/ИКСИ в анамнезе, характеризующихся «остановкой» эмбрионов в развитии на стадии дробления на 2–3-и сутки культивирования.
Критериями включения в исследования были: нормальный кариотип партнеров/супругов, получение не менее 5 ооцит-кумулюсных комплексов (ОКК) после проведения трансвагинальной пункции фолликулов, отсутствие тяжелой патозооспермии у партнера и высокого процента фрагментации ДНК сперматозоидов, не менее 3 безуспешных программ ЭКО в анамнезе.
Учитывая негативные исходы предыдущих попыток, пациенткам был предложен метод переноса эмбрионов в полость матки на стадии зиготы. У всех пар было получено информированное добровольное согласие на участие в исследовании. Пациенткам проводили контролируемую овариальную стимуляцию по стандартному протоколу с антагонистом гонадотропин-рилизинг-гормона. В качестве индукторов роста фолликулов использовали как фоллитропин альфа, так и человеческий менопаузальный гонадотропин. Начальную дозу гонадотропинов рассчитывали в зависимости от возраста, индекса массы тела и овариального резерва пациентки. При проведении стимуляции оценивали количество антральных, растущих и преовуляторных фолликулов при ультразвуковом мониторинге. Трансвагинальную пункцию проводили через 36 ч после введения хорионического гонадотропина (ХГЧ) в дозе 10 000 МЕ. В аспирированной фолликулярной жидкости осуществляли поиск ОКК.
Манипуляции производили при стабильной температуре (+37,0°С). Полученные ОКК после отмывки от фолликулярной жидкости и крови помещали в стерильные планшеты (Nunc, Denmark) с культуральной средой G-TL Vitrolife (Vitrolife, Sweden) на 2–3 ч с целью предварительной инкубации при температуре +37,0°С и атмосфере с 6% СО2. Далее производили денудирование ооцитов – их ферментативное очищение от клеток кумулюса при помощи раствора гиалуронидазы (CooperSurgical, Denmark) в течение 20 с и отмывание от фермента в среде G-TL (Vitrolife, Sweden) для последующей процедуры оплодотворения. После проведения оплодотворения ооциты переносили в культуральную среду G-TL (Vitrolife, Sweden) с целью дальнейшего культивирования. Оценку оплодотворения – визуализацию двух пронуклеусов (формирование зиготы) – проводили через 14–16 ч после оплодотворения. В случае отсутствия двух пронуклеусов оплодотворение считали несостоявшимся. Все этапы культивирования проводили в мультигазовых инкубаторах K-Systems (Kivex Biotec LTD., Denmark) в каплях по 25 мкл под маслом (Vitrolife, Sweden).
Качество зигот и морфологию пронуклеусов оценивали в соответствии с классификацией Скотта [10] по следующим параметрам: соприкасаемость, размер пронуклеусов, степень рассеяния нуклеолей в пронуклеусах, гомогенность цитоплазмы.
Методика предусматривает двукратный осмотр зигот: первый – через 16–18 ч после инсеминации, второй – через 24–26 ч после инсеминации.
Перенос эмбрионов, критерии оценки эффективности переноса (конечных точек исследования)
Перенос эмбрионов в полость матки осуществляли на 1-е сутки при констатации наличия 2 пронуклеусов в зиготе при помощи «мягкого» катетера Wallace (Германия) или Cook (Австралия). Переносили 1 или 2 зиготы лучшего морфологического качества (класса Z1 по классификации Скотта) [10]. Поддержку посттрансферного периода индуцированного цикла проводили путем вагинального введения микронизированного прогестерона в дозировке 600 мг в день. Частоту биохимической беременности определяли на основании сывороточной концентрации ß-субъединицы ХГЧ (ß-ХГЧ), при уровне ß-ХГЧ более 20 МЕ/л. Частоту клинической беременности определяли на основании визуализации плодного яйца при ультразвуковом исследовании через 21 день после переноса эмбрионов.
Статистический анализ
Результаты обрабатывали на персональном компьютере с использованием статистического анализа для Microsoft Excel 2010 и SPSS V22.0. Для определения вида распределения данных перед проведением сравнительного анализа количественных данных в исследуемых группах проводили теcт Колмогорова–Смирнова или теcт Шапиро–Уилка в зависимости от размера выборки. Для описания количественных признаков, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD). При распределении качественных признаков, отличающемся от нормального, использовали медиану (Me) и интерквартильный размах в формате Me (Q1;Q3). Качественные показатели представлены в абсолютных и относительных величинах (%). При нормальном виде распределения данных для оценки различий в группах применяли методы параметрической cтатиcтики (t-test – для несвязанных признаков). При распределении данных, отличном от нормального, применяли методы непараметрической cтатиcтики (тест Манна–Уитни – для несвязанных признаков). Все различия cчитались статистически значимыми при значении p<0,05.
Результаты
Клинико-лабораторные данные пациенток, включенных в исследование, представлены в таблице 1. В исследование включены 37 пациенток, средний возраст которых составил 38,3 (3,3) года. Учитывая негативное влияние возраста на исходы программ ЭКО, пациентки позднего репродуктивного возраста – старше 40 лет – рассматривались отдельно. Таким образом, 20 пациенток имели средний возраст 36,2 (2,4), а 17 женщин – 41,8 (1,1) года. У подавляющего числа пациенток (35/37) было диагностировано первичное бесплодие продолжительностью 6,1 (2,3) года.
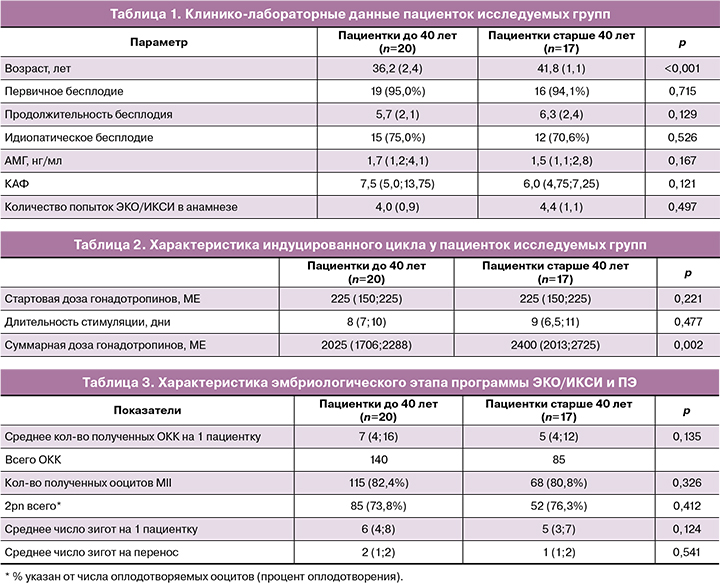
Среднее количество попыток ЭКО/ИКСИ в анамнезе составило 4,2 (1,6) попытки. Состояние овариального резерва у большинства женщин (92%) было оценено как нормальное: уровень антимюллерова гормона (АМГ) – 1,7 (1,2; 4,1) нг/мл у женщин молодого возраста и 1,5 (1,1; 2,8) нг/мл у пациенток старшего возраста, среднее количество антральных фолликулов (КАФ) – 7,5 (5,0; 13,75) и 6,0 (4,75; 7,25) соответственно. При анализе состояния репродуктивной функции и причин инфертильности у 73 % (27/37) женщин бесплодие было расценено как идиопатическое.
Проведен анализ предыдущих попыток ЭКО у исследуемой группы пациенток (n=37). В исследуемой группе среднее количество попыток ЭКО/ИКСИ на 1 пациентку составило 4,2 (1,0). Все предыдущие попытки характеризовались умеренным ответом на стимуляцию яичников с получением оптимального количества ОКК (10,2 (3,2) на пункцию). Необходимо отметить, что овариальная стимуляция в предыдущих попытках проводилась по различным протоколам. Из представленных документов было выяснено, что коэффициент оплодотворения составил 66,3% (615/928), что соответствовало нормальным значениям программ ЭКО. При этом у всех пациенток наблюдалось нарушение развития эмбрионов на ранних этапах дробления.
Учитывая чрезвычайную гетерогенность понятия ареста эмбриогенеза, интересным было проанализировать предыдущие эмбриологические данные и установить, на каких именно этапах происходила остановка развития эмбриона. У подавляющего числа пациенток (30/37) остановка в развитии приходилась на 2–3-и сутки культивирования, а у остальных женщин (7/37) на 3-и сутки культивирования было зафиксировано наличие 6-/8-клеточных эмбрионов, которые прогностически имели потенциал для дальнейшего развития и формирования бластоцист, но на 5-е сутки культивирования бластоцисты отсутствовали. Данные проведенного ретроспективного анализа подтвердили факт нарушения параметров раннего эмбриогенеза у всех пациенток исследуемой группы.
Характеристики индуцированных циклов и эмбриологического этапа программ ЭКО/ИКСИ у пациенток исследуемых групп представлены в таблицах 2 и 3.
Приведенные в таблице 2 данные показывают, что, несмотря на кажущееся увеличение курсовых доз вводимых гонадотропинов и дней стимуляции у пациенток более старшего возраста, эти показатели не достигли достоверных различий по сравнению с более молодыми женщинами, что свидетельствует о потенциальной перспективности проведения программы ЭКО у женщин старшего репродуктивного возраста, включенных в исследование.
Результаты эмбриологического этапа подтвердили влияние возраста на эффективность программ ЭКО. У женщин старшего возраста получено достоверно меньшее количество ОКК и зрелых ооцитов, был меньшим процент оплодотворения и, соответственно, меньшим число полученных зигот по сравнению с более молодыми пациентками.
20 пациенткам 1-й группы в общей сложности было перенесено 36 зигот, в среднем 1,8 (1; 2) на пациентку. Дальнейшему культивированию подверглись эмбрионы 14 пациенток. Характерным явился тот факт, что среди культивируемых эмбрионов в 81,8% (11/14) случаев был зафиксирован «арест» на 3-й день культивирования, бластоциста не получена ни в одном случае, что соответствует данным предыдущих попыток ЭКО. У 17 пациенток старше 40 лет было получено 52 зиготы, каждой из них был произведен перенос эмбриона на 1-е сутки культивирования. Для дальнейшего культивирования осталось 18 эмбрионов, все они остановились в развитии.
На 14-е сутки переноса эмбрионов положительные значения β-ХГЧ были определены у 14 пациенток 1-й группы и у 4 пациенток позднего репродуктивного возраста. На долю биохимических и неразвивающихся беременностей пришлось 27,3% (3/14) и 9,1% (2/14) соответственно у пациенток 1-й группы. У 1 пациентки позднего репродуктивного возраста наблюдалась биохимическая беременность, а у 2 пациенток из 4 – неразвивающаяся. Прогрессирующая маточная беременность была установлена у 10 пациенток: у 9 женщин молодого возраста, что составило 45,0% (9/20), и только у 1 в группе пациенток позднего репродуктивного возраста – 5,8% (1/17); ОР=7,65 (95% ДИ 1,08–54,43); p=0,009.
Обсуждение
Программы ЭКО/ИКСИ и перенос эмбрионов осуществляются согласно рекомендациям, разработанным Эдвардсом и др. (1980), с переносом эмбрионов в полость матки на стадии дробления [11]. Перенос зиготы выполняли некоторые специалисты, но с противоречивыми результатами в общей популяции пациентов. Некоторые авторы сообщали об отсутствии различий в показателях имплантации и беременности между переносом эмбрионов на 1-й и 2/3-й день культивирования [11–15]. Согласно другим данным, частота наступления беременности значительно ниже после переноса эмбрионов на стадии зиготы по сравнению с переносом эмбрионов на стадии дробления [16–17]. В исследовании Sermondade N. et al. (2012) стратегия переноса эмбрионов в полость матки на стадии зиготы применялась по отношению к пациенткам с множественными безуспешными программами ЭКО/ИКСИ в анамнезе, у которых в предыдущих попытках наблюдались эмбрионы с крайне повышенной степенью фрагментации. Частота наступления беременности у пациенток основной группы исследования составила 26,4% [18].
Полученные клинические результаты позволили задуматься вновь о тех характеристиках, которые присущи дробящемуся эмбриону. Не только эуплоидность, которая определяется молекулярно-генетическими исследованиями, но и влияние эпигенетических факторов, условия культивирования, определяют качество получаемого эмбриона.
Эмбрионы на ранних стадиях своего преимплантационного развития проявляют удивительную пластичность и способность адаптироваться к факторам окружающей среды. Однако, как отмечают некоторые исследователи, именно эти приспособительные механизмы могут привести к остановке развития или к значительному снижению качества эмбрионов [19, 20]. Отсутствие дробления эмбрионов, так называемый «арест» раннего эмбриогенеза – явление нечастое в клинической практике, но достаточно драматическое для пациентов, которые вынуждены прибегать к использованию ооцитов донора.
В настоящем исследовании мы попытались преодолеть это явление, перенеся эмбрионы на стадии зиготы. Первый положительный опыт, а именно достижение беременности у 10/37 пролеченных женщин, заставляет задуматься о возможных причинах остановки развития эмбрионов в программах ЭКО. Интересным явился тот факт, что большинство беременностей при переносе на стадии зиготы наступает у пациенток молодого возраста, у пациенток позднего репродуктивного возраста мы не получили статистически значимого повышения частоты наступления беременности. Представленные результаты позволяют предположить, что у молодых женщин, имеющих в большем проценте эуплоидные эмбрионы, решающее значение в формировании ареста раннего эмбриогенеза могут иметь эпигенетические факторы, не исключено, что они связаны с условиями культивирования in vitro. Несмотря на то что одним из основных этапов программ ВРТ является культивирование эмбрионов на протяжении 5 дней в условиях in vitro, возможное влияние культуральных сред и условий культивирования на развивающийся эмбрион все еще не является в полной степени изученным. Кроме того, многочисленные недавние исследования показали, что процесс культивирования вызывает значительные изменения в экспрессии генов, и эпигенетические изменения происходят во время перехода от стадии зиготы к стадии бластоцисты [21, 22]. На более поздних стадиях развития эти изменения могут повлиять на способность к имплантации эмбриона, развитие плода и здоровье потомства [19].
Большинство исследований, анализирующих влияние различных условий культивирования на развитие эмбриона, было сосредоточено на концентрации кислорода, поскольку это может нарушить внутриклеточный окислительно-восстановительный баланс в эмбрионе [23]. Несомненно, что выбор правильной среды культивирования имеет принципиальное значение для оптимизации способности эмбрионов к развитию, но какая среда для культивирования может быть «идеальной» – вопрос далеко не решенный [24].
Необходимо отметить, что большинство из супружеских пар молодого возраста, включенных в исследование, не имели явных причин инфертильности, т.е. в естественных условиях беременность почему-то не наступала, несмотря на наличие у пациентки овуляторного цикла, проходимых маточных труб и фертильной спермы супруга. Тем не менее достигнутые успехи, связанные с переносом зигот в программах ЭКО, заставляют активизировать исследования в направлении изучения факторов, влияющих на развитие эмбриона in vitro, что, в в свою очередь, поможет разрешить проблему бесплодия неясного генеза. Что касается женщин старшего возраста, то причины нарушения этапов раннего эмбриогенеза более очевидны. Известно, что до 90% ооцитов у женщин после 40 лет являются анеуплоидными, что, скорее всего, обуславливает нарушение развития полученных эмбрионов.
Заключение
Наступление беременности в достаточно сложных клинических случаях повторяющейся остановки развития эмбрионов при проведении программ ЭКО у молодых женщин демонстрирует необходимость дальнейшего изучения ряда факторов, имеющих принципиальное значение в процессе раннего эмбриогенеза, и накопления клинического опыта, подтверждающего целесообразность использования этого метода.



