Постменопаузальный остеопороз (ПМО) – системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, которые приводят к повышению хрупкости костей, являясь одной из социальных проблем в развитых странах мира [1]. Частота заболеваемости увеличивается с возрастом, а связанные с ней осложнения растут с увеличением продолжительности жизни [2]. Особенно остро эти проблемы актуальны для женщин и определяются широкой распространенностью заболевания среди населения, его многофакторной природой, высокой частотой инвалидизации, а в ряде случаев смертельными исходами [3].
С точки зрения доказательной медицины наиболее эффективными лекарственными средствами терапии ПМО являются бисфосфонаты (БФ) [4]. Несмотря на то что первые исследования по изучению воздействия БФ на кость были проведены более 30 лет назад, активное применение последних для лечения остеопороза начато только в последние 15 лет. Разработка нескольких поколений препаратов БФ с различной антирезорбтивной активностью сделало этот класс соединений перспективным в лечении остеопороза [5]. В результате фармакотерапии БФ можно достигнуть существенного сокращения потерь костной массы, добиться нормализации показателей костного обмена с уменьшением болевого симптома в костях, снижением риска возникновения переломов в среднем на 40–70% и улучшением качества жизни больных [6].
Этот класс лекарственных средств создан на основе неорганических пирофосфатов – синтетических производных фосфоновых кислот, которые отличаются наличием в своей химической структуре замены атома кислорода в молекуле пирофосфата на атом углерода – Р-С-Р. Две фосфонатные группы функционируют в роли «зацепки» в костной ткани и определяют механизм действия БФ. Наличие –ОН группы способствует связыванию с поверхностью кости. Кроме того, в структуре боковых цепей БФ имеется два радикала (R1 и R2). R2 облегчает физико-химическое связывание БФ с гидроксиапатитом и определяет биологическое действие на костные клетки [7].
Совсем недавно был изучен молекулярный механизм действия БФ. Он касается ключевого фермента внутриклеточного мевалонатного пути синтеза холестерина – фарнезилдифосфатсинтетазы (FDPS – farnesyl diphosphate synthasе, ФДС), который является мишенью для этих соединений [8].
Азотсодержащие БФ способны ингибировать мевалонатный путь биосинтеза холестерина в остеокластах за счет торможения фермента ФДС. К продуктам метаболизма мевалоната относится не только холестерин, но и специфические низкомолекулярные G-белки семейства Rab, Rac, Rap и Rho (рис. 1). Они участвуют в процессах внутриклеточной передачи сигналов, пролиферации, дифференцировки, апоптоза, миграции клеток, регуляции транскрипции генов, в поддержании цитоскелета и в осуществлении защитных реакций костных клеток [9]. Различная способность БФ подавлять активность ФДС детерминирована участком R2. При ингибировании БФ фермента ФДС эти G-белки не подвергаются посттрансляционной модификации с помощью фарнезилпирофосфата и геранилпирофосфата. Механизм торможения пренилирования G-белков потенцирует апоптоз остеокластов [10].
 Ряд исследователей проанализировали изменения отдельных цитокинов в периферической крови после введения различных азотсодержащих БФ (золедронат, ибандронат, алендронат). Через 28–36 ч после инфузии золедроната был зафиксирован пик подъема интерлейкина (ИЛ)-6, фактора некроза опухоли (ФНО)-α и интерферона (ИФН)-γ в сыворотке крови. Повышенные значения данных показателей сохранялись в течение 3–5 дней после инфузии [11]. Азотсодержащие БФ способны выступать в роли небелкового фосфатного антигена, впрочем, как и энзимы мевалонатного пути синтеза холестерина: изопентил дифосфат, диметилаллил фосфат [12]. Данные химические соединения связываются с рецепторами γδ-Т лимфоцитов, активируя их напрямую [13]. Непрямой механизм активации γδ-Т лимфоцитов связан с тем, что ингибирование ФДС влечет за собой повреждение внутриклеточного синтеза изопреноидных липидов и тормозит пренилирование низкомолекулярных протеинов [14, 15].
Ряд исследователей проанализировали изменения отдельных цитокинов в периферической крови после введения различных азотсодержащих БФ (золедронат, ибандронат, алендронат). Через 28–36 ч после инфузии золедроната был зафиксирован пик подъема интерлейкина (ИЛ)-6, фактора некроза опухоли (ФНО)-α и интерферона (ИФН)-γ в сыворотке крови. Повышенные значения данных показателей сохранялись в течение 3–5 дней после инфузии [11]. Азотсодержащие БФ способны выступать в роли небелкового фосфатного антигена, впрочем, как и энзимы мевалонатного пути синтеза холестерина: изопентил дифосфат, диметилаллил фосфат [12]. Данные химические соединения связываются с рецепторами γδ-Т лимфоцитов, активируя их напрямую [13]. Непрямой механизм активации γδ-Т лимфоцитов связан с тем, что ингибирование ФДС влечет за собой повреждение внутриклеточного синтеза изопреноидных липидов и тормозит пренилирование низкомолекулярных протеинов [14, 15].
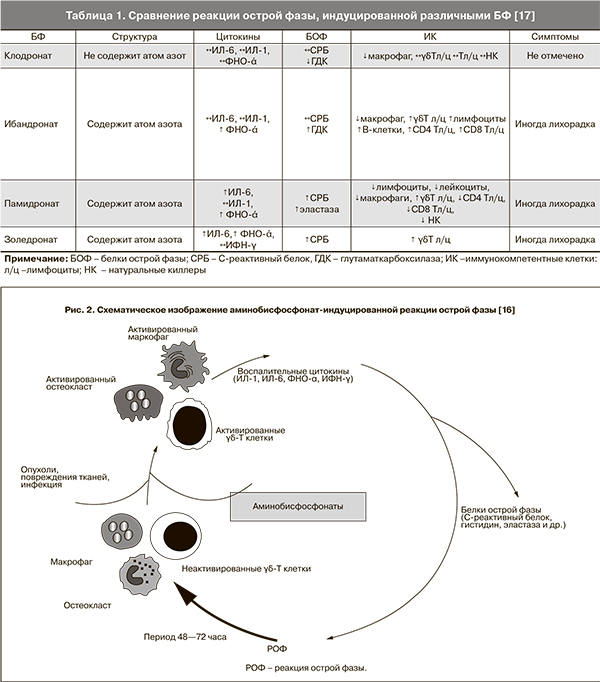
В 7-дневной культуре человеческой периферической крови in vitro было отмечено достоверное повышение уровня мононуклеарных клеток (γδ-Т лимфоцитов CD3+ популяции). Причем в крови пациентов, пролеченных золедроновой кислотой, уровень Т-лимфоцитов повышался на 59,0%; ибандроновой кислотой – 37,1%; алендронатом – 46,2%; клодронатом – 4,5%. Т-лимфоциты несут ответственность за осуществление антибактериального, противопаразитарного, противоопухолевого защитного эффекта. Поэтому активация Т-лимфоцитов азотсодержащими БФ является проявлением их иммуномодулирующего действия (рис. 2) [16], (табл. 1) [17].
Dunford и соавт. исследовали способность БФ ингибировать ФДС in vitro, используя гомогенаты J774 макрофагов и рекомбинантную человеческую ФДС. Результаты исследования демонстрируют 70-кратную разницу в силе действия между памидронатом и золедроновой кислотой. Различия в антирезорбтивной активности среди БФ были выше in vivo (300-кратное различие между памидронатом и золедроновой кислотой). Ингибирующее влияние БФ на ФДС тесно связано с их антирезорбтивным действием. Dunford и соавт. показали достоверную корреляцию между антирезорбтивным действием БФ и их способностью ингибировать ФДС (r=0,95, р<0,0001; Spearman’s rho correlation) [18].
Кроме того, подавление активности ФДС способствует накоплению продуктов промежуточного метаболизма изопреноидов в мевалонатном пути биосинтеза холестерина. К ним относятся изопентилдифосфат и геранилдифосфат. Именно они опосредуют развитие постинфузионной реакции в ответ на введение азотсодержащих БФ [10].
В многоцентровом рандомизированном, двойном слепом, плацебо-контролируемом исследовании HORIZON PFT с участием 3889 женщин с ПМО были подробно проанализированы симптомы реакции острой фазы (РОФ) после внутривенного введения золедроновой кислоты в течение 36 месяцев.
Для удобства все симптомы РОФ были условно разделены на 5 групп:
- Гипертермия: лихорадка, прилив холодный, прилив горячий.
- Скелетно-мышечные проявления: отек суставов, локальная скелетно-мышечная боль, распространенная скелетно-мышечная боль, ригидность мышц.
- Гастроинтестинальные симптомы: боль в животе, анорексия, диарея, тошнота, рвота.
- Глазные проявления: признаки иридоциклита, боль в глазах.
- Общие симптомы: слабость, головокружение, отечность, гриппоподобный синдром, головная боль, обморок, вазомоторный ринит, жажда, бессонница [19].
По данным исследования после введения золедроновой кислоты отмечались нежелательные РОФ длительностью обычно не более 3 дней после введения препарата у 801 (20,6%) пациентки из группы плацебо (n=3876) и у 1901 (48,9%) из группы пациенток, получающих золедроновую кислоту (n=3889). Наиболее распространенными симптомами были повышение температуры тела, озноб или приливы жара. На втором месте по частоте развития отмечались боли в костях, мышцах. Реже наблюдались нежелательные явления со стороны желудочно-кишечного тракта (тошнота, рвота, диарея), иридоциклиты, назофарингиты, отек суставов.
Исследователи отмечают, что симптомы РОФ имели преходящий характер и по продолжительности редко превышали 3 дня. С каждой последующей инфузией уменьшалась их длительность и степень выраженности. Кроме того, авторы рассчитали риски возникновения нежелательных явлений. Оказалось, что основными факторами риска возникновения РОФ являются молодой возраст, высокие значения индекса массы тела, азиатская раса, частое использование нестероидных противовоспалительных средств. Также РОФ чаще наблюдали у пациентов с остеоартритами и онкологическими заболеваниями в анамнезе. Гораздо реже РОФ развивались у курильщиков, пациентов с сахарным диабетом, у людей, ранее принимавших БФ [19].
В педиатрическом институте эндокринологии и диабета (Сидней) проведено ретроспективное исследование, посвященное изучению эффективности и безопасности терапии золедроновой кислотой различных остеопатий у 68 детей в возрасте от 2,2 до 18 лет. Было проанализировано несколько режимов терапии от 0,0125 мг/кг до 0,05 мг/кг каждые 6 месяцев. Следует отметить, что режим для взрослого человека составляет в среднем 0,06 мг/кг. Костная патология включала аваскулярный некроз костной ткани на фоне дерматомиозитов, болезни Крона, остеопороз на фоне длительного использования стероидов, иммобилизации, псевдоартрозов и др. Исходно проводили забор крови на общий кальций, креатинин, витамин D3, паратиреоидный гормон, С-реактивный белок. Измеряли рост, вес, индекс массы тела, общую площадь поверхности тела, мышечную массу, массу жировой ткани. Данный скрининг проводили в течение 48–72 ч после каждой инфузии. Часть детей предварительно и в течение 3 дней после инфузии получали препараты кальция 2 г и 5000 Ед эргокальцитриола. У 42% детей после инфузии золедроновой кислоты в дозе 0,0125 мг/кг и у 74% – в дозе 0,025 мг/кг отмечали гипокальциемию (<2,1 ммоль/л). Соответственно, в группе детей, предварительно принимающих кальций и витамин D, случаи гипокальциемии были крайне редкими (p<0,05). Через 48 ч после инфузии у 77% детей отмечались гриппоподобные симптомы, у 68% – боли в мышцах и костях, у 52% – лихорадка, у 35% – тошнота и рвота, у 17% – головная боль. В 16% случаев отмечались парестезии на фоне гипокальциемии. Все симптомы не имели тяжелого течения. Средняя продолжительность симптомов составила 24 ч. Частота гриппоподобных симптомов превалировала в группе детей, получающих терапию золедроновой кислотой в дозе 0,05 мг/кг в сравнении с минимальным режимом введения – 0,0125 мг/кг (р<0,05). В группе детей с отмеченными симптомами постдозной реакции было зарегистрировано достоверное повышение уровня С-реактивного белка. Последующие инфузии не сопровождались развитием данных симптомов. Авторы исследования отмечают дозозависимый эффект золедроната на развитие симптомов постдозной реакции, которые носят воспалительный характер [20].Другие исследования продемонстрировали взаимосвязь сывороточных концентраций витамина D и риска развития симптомов РОФ. В одном из них 90 женщинам в возрасте 63,7±10,6 года проводили антирезорбтивную терапию остеопороза золедроновой кислотой. После чего все женщины были рандомизированы в 2 группы: с наличием симптомов (РОФ+) и без них (РОФ–). Случаи повышения уровня С-реактивного белка и температуры тела были критериями отбора. Сывороточные концентрации витамина D менее 30 нг/мл регистрировали у 31% пациенток с РОФ+ и у 76% с РОФ–. Относительный риск возникновения симптомов РОФ у женщин с дефицитом витамина D составил 5,8 (95%, CI 5,30–6,29; р<0,0002) и 2,38 (95%,CI 1,85–2,81; р<0,028) для женщин с нормальными значениями витамина D. Уровень витамина в сыворотке крови обратно коррелировал со степенью повышения температуры тела после инфузии золедроновой кислоты (r=-0,64, р<0,0001) и уровнем С-реактивного белка (r=-0,79; р<0,001). Температура тела выше 37,0ºС и патологическое повышение значений С-реактивного белка чаще наблюдали у женщин с уровнем витамина D менее 30 нг/мл. Авторы делают вывод, что витамин D так или иначе вовлечен в иммунологические механизмы развития РОФ после приема БФ [21].
Механизм действия азотсодержащих БФ имеет сложный многонаправленный характер. Развитие специфической симптоматики в ответ на внутривенное введение БФ доказывает вмешательство данных соединений с систему иммунологического ответа и требует проведения направленных исследований в этой области.