В последние годы число больных карциномой эндометрия неуклонно растет [1]. Большинство специалистов рассматривают карциному эндометрия в тесной взаимосвязи с гиперплазией эндометрия (ГЭ), которая относится к предопухолевым процессам [2]. Сегодня обсуждается ряд факторов, которые обусловливают развитие ГЭ: несбалансированная длительная стимуляция эстрогенами, нарушенная рецептивность эндометрия, неадекватная реакция клеток эндометрия на внешние воздействия, которая определяется экспрессией маркеров пролиферации, апоптоза, факторов роста и др. [3]. Реализация вышеперечисленных факторов наиболее вероятна в условиях хронического эндометрита (ХЭ), который создает предпосылки для формирования пролиферативных процессов и дальнейшей атипической трансформации клеток эндометрия [4, 5]. Вместе с тем в настоящее время частота выявления бактериальных возбудителей воспаления при ХЭ снижается, а вирусных агентов, в том числе вируса папилломы человека (ВПЧ), – увеличивается [5]. При ГЭ также часто обнаруживают ВПЧ [6], причем у каждой третьей пациентки при наличии ВПЧ в эндометрии выявляют ГЭ с атипией и высокодифференцированную аденокарциному эндометрия [7].
Известно, что повышение уровня экспрессии маркера пролиферации Ki-67 и маркера антипролиферативной активности ингибитора циклин-Д-зависимых киназ p16INK4a в клетках является предиктором онкологических заболеваний [8, 9]. В нормальных эпителиальных клетках, в частности экзоцервикса, белок p16INK4a экспрессируется в незначительном количестве, но при заболеваниях шейки матки, ассоциированных с папилломавирусной инфекцией, наблюдается повышенная его экспрессия [10, 11]. Однако исследования, посвященные анализу экспрессии вышеперечисленных маркеров в слизистой оболочке матки при ГЭ в сочетании с ХЭ, малочисленны и противоречивы [12–14].
Цель исследования – определение особенностей пролиферативной и антипролиферативной активности клеток эндометрия при его гиперплазии в сочетании с ХЭ путем анализа уровня экспрессии протеинов Ki-67 и p16INK4a в слизистой оболочке матки.
Материалы и методы
Исследование проводили на кафедрах акушерства и гинекологии, патологической анатомии и судебной медицины ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, г. Челябинск. Обследованы 90 пациенток. 1-ю группу составили 29 женщин, у которых при гистологическом изучении биоптатов эндометрия выявлена ГЭ без атипии в сочетании с ХЭ; 2-ю – 21 пациентка с ГЭ без атипии (группа сравнения 1); 3-ю группу – 20 женщин с ХЭ (группа сравнения 2); 4-ю группу (группу контроля) – 20 гинекологически здоровых женщин, обратившихся по вопросам планирования беременности, гистологическое исследование биоптатов эндометрия которых выявило нормальную слизистую оболочку матки.
Критерии включения: репродуктивный возраст, нормальный овуляторный менструальный цикл (для 1-й, 3-й, 4-й групп), информированное согласие на участие в исследовании.
Критерии исключения: овуляторная дисфункция (для 1-й, 3-й, 4-й групп), аденомиоз, миома матки, требующая хирургического лечения, атипическая ГЭ.
Дизайн исследования – одномоментное нерандомизированное ретроспективное с использованием гистологических, иммуногистохимических, статистических методов.
Эндометрий получали на 18–22-й дни менструального цикла путем мануальной вакуумной аспирации под контролем гистероскопии (в 1-й и 2-й группах) или с использованием пайпель-биопсии (в 3-й и 4-й группах).
Проводили комплексное морфологическое исследование образцов эндометрия, интерпретируя морфологические картины по общепринятым критериям [15, 16]. Гистологические препараты готовили по стандартным методикам.
Депарафинизированные срезы окрашивали гематоксилином и эозином, пикрофуксином по ван Гизону. Для выявления плазматических клеток использовали мышиные моноклональные антитела (МКАТ) CD 138/syndecan-1 (clon B-A38, r.t.u., Cell Marque Sigma – Aldrickcompany, USA).
Степень выраженности ХЭ определяли в соответствии с критериями, предложенными Э.А. Казачковой и соавт. [17] и Г.Х. Толибовой и соавт. [18] (для оценки уровня CD138).
О степени активности ХЭ судили по критериям полуколичественной морфологической оценки воспалительного процесса при ХЭ, предложенным О.А. Алимовой и соавт. [19]. Если при ХЭ нейтрофильные гранулоциты в полиморфноклеточном воспалительном инфильтрате были единичными либо отсутствовали, такой процесс обозначали как неактивный.
Для оценки уровня экспрессии маркера пролиферации Ki-67 использовали МКАТ к Ki-67 (Cell Marque, клон SP6, 1:100), для определения уровня экспрессии p16INK4a – специфическую сыворотку к белку p16INK4a из набора CINtec histology kit (производство MTM laboratories AG, Germany). Изучение иммуногистохимических маркеров было основано на оценке наличия, интенсивности и распределения коричневого окрашивания ядер пораженных клеток. Исследование проводили два независимых морфолога. Изучали процент позитивно окрашенных ядер клеток в не менее чем 1000 клетках в 10 полях зрения. При отсутствии иммунопозитивно окрашенных клеток в отношении p16INK4a и Ki-67 экспрессия считалась негативной. При верификации единичной экспрессии обнаруживали редкие одиночные клетки желез и стромы эндометрия с коричневым окрашиванием ядер; при очаговой форме экспрессии выявляли немногочисленные скопления клеток с ядрами, окрашенными в коричневый цвет; диффузная форма экспрессии устанавливалась при обнаружении клеток с коричневыми ядрами по всей толще эндометрия в железах и строме. Для объективизации оценки экспрессии Ki-67 и p16INK4a использовали компьютерный морфометрический анализатор изображений «Видеотест – Морфология 5.2» (Россия).
Статистический анализ выполнен с использованием статистического пакета Statistica 10 фирмы StatSoft. При анализе количественных показателей определяли соответствие закону нормального распределения с использованием критерия Колмогорова–Смирнова. При нормальном распределении количественных показателей использовали среднее арифметическое (М) и стандартное отклонение (SD). При отличии показателей от нормального распределения рассчитывали медиану (Ме) и квартили Q1 и Q3, данные представлены в формате Ме (Q1; Q3). Качественные показатели определяли в абсолютных и относительных (%) величинах.
Для анализа количественных показателей применяли критерий Краскела–Уоллиса с последующим попарным сравнением с помощью U-критерия Манна–Уитни. Для сравнения качественных показателей использовали критерий Хи-квадрат с поправкой Йетса. Для выявления взаимосвязи признаков вычисляли коэффициенты корреляции Спирмена. При интерпретации результатов статистического анализа величина уровня значимости (р), равная 0,05, принята за критическую.
Результаты и обсуждение
Средний возраст пациенток 1-й группы составил 39,8 (3,5) года, во 2-й – 34,8 (3,6) года, в 3-й – 34,2 (1,5) года, в 4-й – 33,85 (0,7) года. Полученные результаты не имели статистически значимых отличий.
Анализ сопутствующей соматической патологии показал, что в 1-й группе статистически значимо чаще встречались заболевания сердечно-сосудистой системы (по МКБ-10: I25, I11, R00, I83) (11 (37,9%) женщин в 1-й группе, 4 (19,04%) – во 2-й, 3 (15%) – в 3-й, 2 (10%) – в 4-й; p=0,035). Во 2-й группе статистически значимо чаще встречались заболевания эндокринной системы (E00-07, E65-68, E10-14) (9 (42,8%) пациенток во 2-й группе, 4 (13,8%) – в 1-й, 2 (10%) – в 3-й, 1 (5%) – в 4-й; p=0,003).
Становление менструальной функции в группах исследования нарушено не было, по времени менархе группы также были однородны.
Оценка гинекологического анамнеза показала статистически значимую высокую коморбидность по воспалительным заболеваниям органов малого таза у 20 (68,97%) женщин в 1-й группе, 9 (42,86%) – во 2-й, 8 (40%) – в 3-й, 0 – в 4-й; p=0,04). У 8 (27,6%) больных 1-й группы ГЭ имела рецидивирующий характер, по данным анамнеза, пациентки получали ранее терапию гестагенами. В эпителии шейки матки у 6 (20,7%) женщин 1-й группы зарегистрирован ВПЧ 16, 31 и 58 типов.
Во 2-й группе статистически значимо чаще встречались синдром поликистозных яичников (Е28) (8 (38,1%) женщин во 2-й группе, 3 (10,3%) – в 1-й, 0 – в 3-й, 0 – в 4-й; p=0,002) и невоспалительные поражения яичника (N83.0, N83.1) (11 (52,4%) пациенток во 2-й группе, 8 (27,6%) – в 1-й, 6 (30%) – в 3-й, 2 (10%) – в 4-й; p=0,03).
При гистологическом исследовании материала в 1-й группе выявлена ГЭ без атипии в сочетании с ХЭ: отмечали повышенное количество желез эндометрия неправильной формы, увеличение уровня железисто-стромального соотношения, истончение межацинарных перегородок. Вышеуказанные изменения зарегистрированы на фоне хронического воспалительного процесса: в строме слизистой оболочки матки обнаружены диффузно расположенные немногочисленные нейтрофильные гранулоциты, группы лимфоцитов, отдельные мелкие поля фибробластов. При идентификации CD138 были обнаружены как единичные плазмоциты (в 2 (6,9%) случаях), так и диффузно рассеянные одиночные плазматические клетки (в 7 (24,1%) случаях), вплоть до их очаговых скоплений (в 20 (68,97%) случаях). Вышеописанная характеристика эндометрия свидетельствует о ГЭ без атипии в сочетании с ХЭ низкой степени активности и различной степени выраженности.
При оценке уровня экспрессии Ki-67 (рис. 1) в 17 (58,6%) образцах определяли диффузную форму экспрессии этого маркера: имело место интенсивное коричневое окрашивание ядер в структуре как железистого, так и стромального компонентов. В 6 (20,7%) случаях экспрессия Ki-67 расценена как очаговая (зарегистрированные группы клеток с ядрами коричневой окраски), в 6 (20,7%) образцах – единичная экспрессия (обнаружены единичные иммунопозитивные клетки). Морфометрически площадь иммунопозитивных структур в 1-й группе составила 29,1% (15,7%; 43,7%).
При изучении экспрессии p16INK4a (рис. 2) в 23 (79,3%) случаях зарегистрирована диффузная форма экспрессии p16INK4a (в стромальном и железистом компонентах обнаружены многочисленные, диффузно расположенные иммунопозитивные клетки), в 3 (10,3%) – очаговая форма экспрессии (обнаружены немногочисленные скопления клеток желез и стромы с ядрами коричневой окраски), в 3 (10,3%) – единичная (выявляли редкие одиночные иммунопозитивные клетки). При этом в эпителии шейки матки у 6 (20,7%) пациенток 1-й группы зарегистрирован ВПЧ 16, 31 и 58 типов. Средняя площадь иммунопозитивных структур достигла 38,1% (24,2%; 50,2%). В 1-й группе максимальные уровни экспрессии Ki-67 и p16INK4a зарегистрированы у пациенток, имеющих рецидивирующий характер ГЭ.
Схожую картину ГЭ без атипии отмечали и во 2-й группе. Слизистая оболочка матки отличалась многочисленными неравномерно распределенными железами разной формы и величины, включая кистозно-расширенные, на отдельных участках со складками в направлении просвета желез. Регистрировали проявления реактивного неактивного воспаления: при отсутствии плазмоцитов обнаруживали немногочисленные диффузно расположенные гранулоциты, редкие лимфоциты, малочисленные мелкие скопления фибробластов. При иммуногистохимическом исследовании образцов эндометрия преобладала очаговая форма экспрессии Ki-67 (в 15 (71,4%) случаях), единичная форма встречалась в 6 (28,6%) случаях. Экспрессия p16INK4a чаще регистрировалась в виде очаговой формы (в 13 (61,9%) случаях), единичная экспрессия встречалась в 8 (38,1%) случаях. Площадь иммунопозитивных структур по отношению к Ki-67 составила 14,7% (10,2%; 26,6%), p16INK4a – 25,3% (16,3%; 34,1%) (рис. 1, 2).
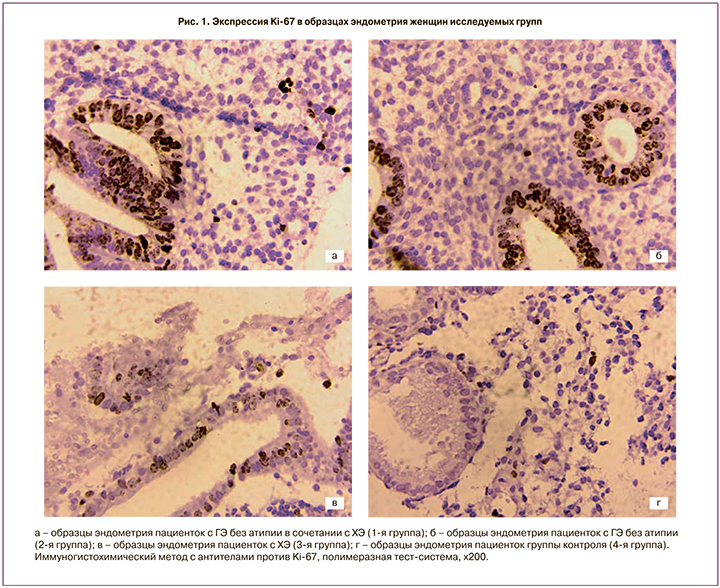
В 3-й группе наблюдали картину ХЭ низкой степени активности и умеренной степени выраженности: в толще эндометрия располагались диффузно расположенные немногочисленные нейтрофильные гранулоциты, обнаружена полиморфно-клеточная инфильтрация с многочисленными диффузно рассеянными лимфоцитами без тенденции к очаговым скоплениям, наличие немногочисленных плазмоцитов, фибробластическая трансформация клеток стромы и фиброз вплоть до определения крупных полей из фибробластических клеток. При оценке пролиферативной активности экспрессия Ki-67 регистрировалась преимущественно в виде единичной (19 (95%) образцов). В 1 (5%) микропрепарате иммунопозитивные клетки обнаружены не были. Средняя площадь иммунопозитивных структур в отношении к Ki-67 составила 6% (1,93%; 12,93%). Оценка антипролиферативной активности показала преимущественно единичную форму экспрессии p16INK4a (в 19 (95%) образцах), 1 (5%) образец был негативен в отношении этого маркера. Средняя площадь иммунопозитивных структур в отношении p16INK4a достигла 5,8% (1,6%; 9,8%) (рис. 1, 2).
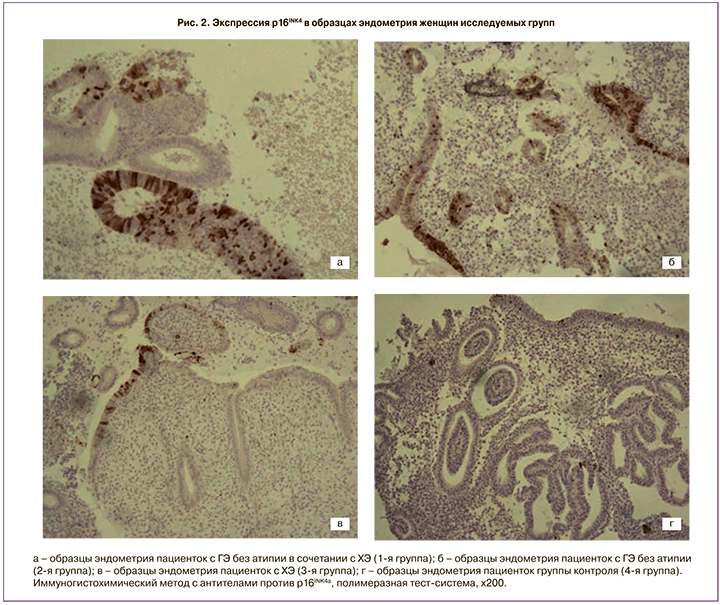
Слизистая оболочка тела матки женщин группы контроля соответствовала средней стадии фазы секреции: экспрессия Ki-67 была преимущественно единичной (в 15 (75%) случаях), 5 (25%) образцов были негативны. Средняя площадь иммунопозитивных структур составила 1,25% (0,07%; 3,93%). Наблюдаемая пролиферация, возможно, связана с активным делением клеток эндометрия, характеризующим данную фазу менструального цикла. В отношении экспрессии p16INK4a в 3 (15%) образцах обнаружена единичная форма экспрессии, что возможно связано с транзиторным характером папилломавирусной инфекции, 17 (85%) биоптатов слизистой оболочки матки были негативны, площадь иммунопозитивных структур в отношении белка p16INK4a составила 2,6% (0,7%; 4,5%) (рис. 1, 2).
Оценка пролиферативной активности клеток эндометрия пациенток с ГЭ в сочетании с ХЭ свидетельствует о высоком пролиферативном потенциале клеток эпителия желез и стромы эндометрия, причем не только по сравнению с группой контроля, но и по отношению к 1-й и 2-й группам сравнения, что указывает на активно идущие процессы клеточного деления. Площадь иммунопозитивных структур в отношении Ki-67 была статистически значимо больше в 1-й группе и составила 29,1% (15,7%; 43,7%), в то время как во 2-й группе – 14,7% (10,2%; 26,6%), 6% (1,93%; 12,93%) – в группе ХЭ и 1,25% (0,07%; 3,93%) – в группе контроля (p=0,03).
 Повышенная экспрессия p16INK4a в 1-й группе пациенток свидетельствует о возможном участии вирусов в развитии гиперпластического процесса. В 1-й группе средняя площадь иммунопозитивных структур по отношению к p16INK4a была статистически значимо больше и достигла 38,1% (24,2%; 50,2%), у пациенток 2-й группы этот показатель составил 25,3% (16,3%; 34,1%), в 3-й группе – 5,8% (1,6%; 9,8%), в группе контроля – 2,6% (0,7%; 4,5%) (p=0,002).
Повышенная экспрессия p16INK4a в 1-й группе пациенток свидетельствует о возможном участии вирусов в развитии гиперпластического процесса. В 1-й группе средняя площадь иммунопозитивных структур по отношению к p16INK4a была статистически значимо больше и достигла 38,1% (24,2%; 50,2%), у пациенток 2-й группы этот показатель составил 25,3% (16,3%; 34,1%), в 3-й группе – 5,8% (1,6%; 9,8%), в группе контроля – 2,6% (0,7%; 4,5%) (p=0,002).
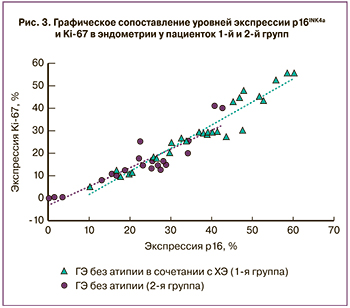
Сопоставление уровней экспрессии Ki-67 и p16INK4a в слизистой оболочке матки у женщин 1-й и 2-й групп показало сильную прямую корреляционную связь между уровнем экспрессии p16INK4a и Ki-67 в эндометрии; коэффициент корреляции Спирмена составил 0,869, p=0,0001 (рис. 3). Уровни экспрессии перечисленных маркеров в 3-й и 4-й группах были минимальны, и провести статистические сопоставления не представилось возможным.
Заключение
Клетки эндометрия при ГЭ в сочетании с ХЭ характеризуются как повышенной пролиферативной, так и антипролиферативной активностью. Наблюдаемая коэкспрессия Ki-67 и p16INK4a при ГЭ в сочетании с ХЭ может быть сигналом повреждения клеточного цикла и требует поиска факторов, определяющих одновременную экспрессию этих маркеров при данной патологии. Указание на наличие максимальных уровней экспрессии Ki-67 и p16INK4a в образцах эндометрия у пациенток с рецидивированием гиперпластического процесса может стать основой для разработки программы оценки риска рецидива ГЭ.



