Проблемы недержания мочи у женщин с пролапсом тазовых органов (ПТО) заставляют их прибегать к оперативному лечению, так как приводят к серьезной социальной дезадаптации, снижают трудоспособность, сексуальную активность, влияют на качество жизни.
Эндогенные патогенетические механизмы декомпенсации эластических свойств тканей тазового дна при ПТО и стрессовом недержании мочи (СНМ) остаются недостаточно изученными. Известно, что подверженность человека различным заболеваниям может определяться так называемыми «генами предрасположенности» [1]. Некоторые данные современных исследований позволяют связывать полиморфизм генов, определяющих синтез коллагена, ферментов деградации коллагена, в частности семейства металлопротеиназ (ММР-1, MMP-2, MMP-9) с риском развития ПТО и СНМ [2–5]. Также известно, что активация прометаллопротеиназ таких, как про-ММР-1,-3-9,-10,-13, непосредственно осуществляется ферментом плазмином, тогда как ингибитор активатора плазминогена (PAI 1) препятствует превращению плазминогена в плазмин и, следовательно, нарушает активацию ММР, замедляя, таким образом, деградацию соединительной ткани [6]. Поиск и исследование генов – кандидатов ПТО и СНМ является важным аспектом изучения патогенеза заболевания, открывает новые возможности для выявления женщин групп риска по развитию данной патологии, прогнозирования клинического течения заболевания, а также для выбора методов профилактики и оперативного лечения.
Цель исследования: выяснить особенности полиморфизма генов MMP1 (матриксная металлопротеиназа-1), MMP3 (матриксная металлопротеиназа-3), PAI (ингибитор активатора плазминогена) у больных с ПТО и СНМ.
Материал и методы исследования
Обследованы 128 пациенток: 63 женщины с ПТО и 65 женщин с ПТО и СНМ, жителей Северо-Западного региона России, представителей европеоидной расы. От каждой женщины в установленном порядке получено информированное согласие на проведение данного исследования. Средний возраст пациенток в указанных группах составил 65,3±5,4 и 66,5±6,7 года соответственно. Результаты объективного обследования состояния тазового дна пациенток представлены на рисунке.
Группа сравнения (n=117) представляла собой популяционную выборку женщин, не имеющих на момент исследования клинических признаков ПТО и недержания мочи и проживающих в Северо-Западном регионе России.
Образцы ДНК, полученные стандартным методом из лимфоцитов периферической крови, были использованы для проведения полимеразной цепной реакции (ПЦР) и ПЦР-ПДРФ – анализа (анализ полиморфизма длины рестрикционных фрагментов) генов MMP1, ММP3, PAI1. Cмесь для амплификации обьемом 25 мкл включала 15 нМ каждого праймера, 67 мМ трис-HCl, рН 8.8, 16,6 мМ сульфата аммония, 6,7 мМ MgCl2, 6,7 мкМ ЭДТА, 10 мМ меркаптоэтанола, 170 мкг BSA, 1,0 мМ каждого dNTP и 1U Taq-ДНК-полимеразы. Для проведения ПЦР использовали следующие олигонуклеотидные праймеры:
MMP1 (1G/2G)- F TGACTTTTAAAACATAGTCTATGTTCA
R TCTTGGATTGATTTGAGATAAGTCATAGC
MMP3 (5A/6A)- F TTCTCCATTCCTTTGATGGGGGGAAAGA
R TTCCTGGAATTCACATCACTGCCACCACT
PAI (4G/5G) – F CACAGAGAGA GTCTGGCCACTT
R GGCCCAACAGAGGACTCTTG
Для амплификации использовали программируемый термоциклер «ДНК-технология» (Москва). Для проведения ПЦР использовали следующие условия: после денатурации (94оС, 7 мин) проводили 30 циклов амплификации в режиме: для ММР1, ММР3 – 94оС-40сек; 56оС-40сек; 72оС-1 мин, для PAI – 94оС-50сек; 56оС-50сек; 72оС-1 мин с заключительным синтезом 5 мин при 72оС. Для идентификации аллелей полиморфного сайта (rs1799750) гена ММР1 (-1607del G, (G>GG)) продукты амплификации расщепляли эндонуклеазой Alu1 (1G аллель содержит уникальный сайт для Alu1). Для идентификации аллелей полиморфного сайта (rs3025058) гена ММР3 (-1171, 5A/6A) продукты амплификации расщепляли эндонуклеазой Tth111I (5A аллель содержит уникальный сайт для Tth111I). Для идентификации аллелей полиморфного сайта (rs1799768) гена PAI (-675 5G/4G) продукты амплификации расщепляли эндонуклеазой Tth111I (5G аллель содержит уникальный сайт для Tth111I). После окончания ПЦР полноту гидролиза оценивали по результатам электрофореза в 7,5% полиакриламидном геле после окраски этидиумбромидом и визуализации в ультрафиолетовом свете.
Статистическая обработка данных проводилась методами описательной статистики и сравнения выборок, с использованием t-критерия Стюдента, критерия χ2 с поправкой Йетса, коэффициента соотношения шансов (OR). Уровень статистической значимости (р) принят ≤0,05. Обработка данных проводилась с использованием программы «Instat».
Результаты исследования
Распределение частот генотипов по гену MMP1(rs1799750) у пациентов с ПТО и СНМ в основных группах и группе контроля представлены в табл. 1. Достоверных различий частот аллелей 1G и 2G в основных группах и в группе сравнения не выявлено. Вместе с тем, гомозиготы по аллелю 1G (1G/1G) гена ММР1 в группе ПТО встречалось достоверно чаще, чем в группе сравнения (р=0,03). При сравнении всех групп достоверных различий в частотах других генотипов по гену ММР1 выявлено не было. Согласно рассчитанному коэффициенту соотношения шансов, наличие генотипа 1G/1G по гену ММР1 повышает вероятность развития ПТО в 2,1 раза (OR=2,1 95%CI: 1,05-4,38).
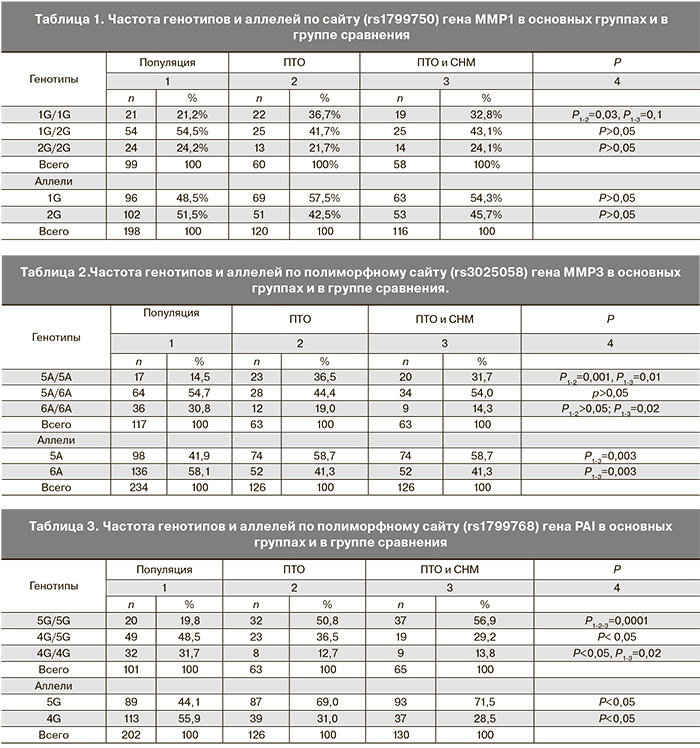
Как следует из данных, приведенных в табл. 2, распределение частот генотипов и аллелей по изученному полиморфизму гена MMP3 между группами исследованных пациентов и контрольной выборки имеет достоверные различия. В частности, выявлено достоверное преобладание частоты аллели 5A в группах пациентов по сравнению с контрольной группой. В группе ПТО в сочетании с СНМ выявлено достоверное преобладание генотипа 5A/5A по сравнению с таковым в контрольной группе (р=0,01) и в группе ПТО без СНМ (р=0,001). Согласно рассчитанному коэффициенту соотношения шансов, наличие 5A/5A MMP3 генотипа повышает вероятность ПТО приблизительно в 3,4 раза (OR=3,38 95% CI: 1,64-6,99), вероятность сочетанной патологии (ПТО + СНМ) приблизительно в 3,3 раза (OR=3,29 95% CI: 1,43-7,57).
Как следует из представленных в табл. 3 данных, между группами с ПТО и группой сравнения имеются достоверные различия в распределении генотипов и аллелей полиморфизма rs1799768 по гену PAI. В группах обследованных пациентов выявлено достоверное преобладание 5G/5G генотипа, по сравнению с контролем. Согласно рассчитанному коэффициенту соотношения шансов, наличие 5G/5G генотипа по гену PAI повышает вероятность ПТО в 3,2 раза (OR=3,16 95% CI: 1,6-6,2), а 5G/5G генотипа – вероятность ПТО + СНМ в 5,3 раза (OR=5,3 95% CI: 2,7-10,7).
Обсуждение
 Гистологические и иммуногистохимические исследования тканей пациенток с ПТО и СНМ описывают патологические изменения соединительнотканных и мышечных компонентов тазового дна, обусловливающие их функциональную несостоятельность [7–9]. Согласно современным представлениям указанные изменения являются формой проявления дисплазии соединительной ткани (ДСТ) [7, 10]. ДСТ – полиорганная или полисистемная патология с прогредиентным течением, в основе которой лежат дефекты синтеза или катаболизма компонентов внеклеточного матрикса или регуляторов морфогенеза соединительной ткани [11]. Матриксные металлопротеиназы (ММР) — протеолитические ферменты (эндопептидазы), участвующие в деструкции и ремоделировании соединительной ткани [12]. МMP принадлежит важная роль регуляторов в поддержании гомеостаза экстрацеллюлярного матрикса при физиологических состояниях (заживление ран) и при патологических процессах (воспаление, ревматоидный артрит, метастазирование, разрушение хряща, формирование аневризмы миокарда и др.) [13, 14]. Существуют иммуногистохимические данные, указывающие на важную роль дисбаланса ММР, а также тканевых ингибиторов ММР в развитии патологии тазового дна (СНМ и ПТО) [9]. В последнее время появляются сообщения об ассоциации генетически-детерминированной активности ферментов семейства ММР, в частности ММР1, с патогенезом ПТО и недержанием мочи при напряжении [15, 16]. ММР1 — коллагеназа-1, синтезируемая фибробластами соединительной ткани и моноцитами. ММР1 является одним из ферментов, осуществляющих первый этап катаболизма интерстициального коллагена I, II и III типов [12]. Стоит отметить, что коллагеновые волокна в структурах поддерживающего аппарата органов малого таза в основном образованы коллагеном I и III типов [9]. Полиморфизм в гене ММР1 – инсерция гуанина (G) в положении 1607 – определяет наличие двух аллелей гена: 1G (содержащий в своем составе один остаток гуанин в положении 1607) и 2G (содержащий последовательность из 2 остатков гуанина). Результатом мутации в гене ММР1 является повышенное образование соответствующего фермента. Предполагается, что отмеченная при иммуногистохимических исследованиях высокая экспрессия ММР1 в биоптатах тканей пациенток с ПТО обусловлена мутацией в гене соответствующего фермента. Так S. Vishwajit и соавт. отмечали у пациенток с ПТО и СНМ достоверное преобладание в сравнении с популяционными данными частоты мутантного аллеля 2G, ассоциированного с повышенной активностью фермента ММР1 [16]. В нашем исследовании достоверной разницы частот аллелей 1G, 2G гена ММР1 в исследуемых группах и в популяционной выборке выявлено не было. Однако в группе ПТО генотип 1G/1G встречался достоверно чаще, чем в контрольной выборке, что согласуется с данными Ю.А. Дегтяревой [17]. В группе ПТО и СНМ не выявлено достоверных различий частот изучаемых генотипов по сравнению с контролем. Таким образом, отмеченная при иммуногистохимических исследованиях высокая активность ММР1 в тканях больных с ПТО [18] может быть обусловлена не только аллельными вариантами соответствующего гена, но связана с нарушением регуляции его активности в тканях в результате действия тканевого ингибитора ММР1. Противоречивость полученных данных свидетельствует о необходимости дальнейших исследований по уточнению роли полиморфизма гена ММР1 и факторов регуляции его активности на тканевом уровне в патогенезе ПТО и СНМ. MMP3, также называемая стромелизином-1, катализирует деградацию многих компонентов соединительной ткани, включая протеогликаны, линк-белок, коллаген типов II, IV, IX и XI, ламинин и фибронектин. MMP3 может также влиять на деградацию экстрацеллюлярного матрикса через активацию проколлагеназы-1. Известно, что MMP3 играет важную роль в естественных процессах тканевого ремоделирования и патологических процессах (остеоартритах и ревматоидных артритах). Полиморфный вариант гена MMP3 (-1171 5А>6А) представляет собой инсерционно-делеционный полиморфизм, который изменяет сайт связывания транскрипционного фактора NFκB, что влияет на экспрессию гена ММР3. Аллель 5A повышает экспрессию данного гена, тогда как 6А аллель ассоциирован с более низкой активностью промотора и соответственно низкой экспрессией гена [12]. В нашем исследовании обнаружено достоверное преобладание 5G/5G генотипа MMP3 в группах больных с ПТО без СНМ, а также в сочетании с СНМ по сравнению с контрольной группой. Эти результаты позволяет полагать, что генотип 5G/5G гена ММР3 играет роль в развитии ПТО и СНМ.
Гистологические и иммуногистохимические исследования тканей пациенток с ПТО и СНМ описывают патологические изменения соединительнотканных и мышечных компонентов тазового дна, обусловливающие их функциональную несостоятельность [7–9]. Согласно современным представлениям указанные изменения являются формой проявления дисплазии соединительной ткани (ДСТ) [7, 10]. ДСТ – полиорганная или полисистемная патология с прогредиентным течением, в основе которой лежат дефекты синтеза или катаболизма компонентов внеклеточного матрикса или регуляторов морфогенеза соединительной ткани [11]. Матриксные металлопротеиназы (ММР) — протеолитические ферменты (эндопептидазы), участвующие в деструкции и ремоделировании соединительной ткани [12]. МMP принадлежит важная роль регуляторов в поддержании гомеостаза экстрацеллюлярного матрикса при физиологических состояниях (заживление ран) и при патологических процессах (воспаление, ревматоидный артрит, метастазирование, разрушение хряща, формирование аневризмы миокарда и др.) [13, 14]. Существуют иммуногистохимические данные, указывающие на важную роль дисбаланса ММР, а также тканевых ингибиторов ММР в развитии патологии тазового дна (СНМ и ПТО) [9]. В последнее время появляются сообщения об ассоциации генетически-детерминированной активности ферментов семейства ММР, в частности ММР1, с патогенезом ПТО и недержанием мочи при напряжении [15, 16]. ММР1 — коллагеназа-1, синтезируемая фибробластами соединительной ткани и моноцитами. ММР1 является одним из ферментов, осуществляющих первый этап катаболизма интерстициального коллагена I, II и III типов [12]. Стоит отметить, что коллагеновые волокна в структурах поддерживающего аппарата органов малого таза в основном образованы коллагеном I и III типов [9]. Полиморфизм в гене ММР1 – инсерция гуанина (G) в положении 1607 – определяет наличие двух аллелей гена: 1G (содержащий в своем составе один остаток гуанин в положении 1607) и 2G (содержащий последовательность из 2 остатков гуанина). Результатом мутации в гене ММР1 является повышенное образование соответствующего фермента. Предполагается, что отмеченная при иммуногистохимических исследованиях высокая экспрессия ММР1 в биоптатах тканей пациенток с ПТО обусловлена мутацией в гене соответствующего фермента. Так S. Vishwajit и соавт. отмечали у пациенток с ПТО и СНМ достоверное преобладание в сравнении с популяционными данными частоты мутантного аллеля 2G, ассоциированного с повышенной активностью фермента ММР1 [16]. В нашем исследовании достоверной разницы частот аллелей 1G, 2G гена ММР1 в исследуемых группах и в популяционной выборке выявлено не было. Однако в группе ПТО генотип 1G/1G встречался достоверно чаще, чем в контрольной выборке, что согласуется с данными Ю.А. Дегтяревой [17]. В группе ПТО и СНМ не выявлено достоверных различий частот изучаемых генотипов по сравнению с контролем. Таким образом, отмеченная при иммуногистохимических исследованиях высокая активность ММР1 в тканях больных с ПТО [18] может быть обусловлена не только аллельными вариантами соответствующего гена, но связана с нарушением регуляции его активности в тканях в результате действия тканевого ингибитора ММР1. Противоречивость полученных данных свидетельствует о необходимости дальнейших исследований по уточнению роли полиморфизма гена ММР1 и факторов регуляции его активности на тканевом уровне в патогенезе ПТО и СНМ. MMP3, также называемая стромелизином-1, катализирует деградацию многих компонентов соединительной ткани, включая протеогликаны, линк-белок, коллаген типов II, IV, IX и XI, ламинин и фибронектин. MMP3 может также влиять на деградацию экстрацеллюлярного матрикса через активацию проколлагеназы-1. Известно, что MMP3 играет важную роль в естественных процессах тканевого ремоделирования и патологических процессах (остеоартритах и ревматоидных артритах). Полиморфный вариант гена MMP3 (-1171 5А>6А) представляет собой инсерционно-делеционный полиморфизм, который изменяет сайт связывания транскрипционного фактора NFκB, что влияет на экспрессию гена ММР3. Аллель 5A повышает экспрессию данного гена, тогда как 6А аллель ассоциирован с более низкой активностью промотора и соответственно низкой экспрессией гена [12]. В нашем исследовании обнаружено достоверное преобладание 5G/5G генотипа MMP3 в группах больных с ПТО без СНМ, а также в сочетании с СНМ по сравнению с контрольной группой. Эти результаты позволяет полагать, что генотип 5G/5G гена ММР3 играет роль в развитии ПТО и СНМ.
Белок PAI относится к семейству «серпинов». Его основная функция заключается в быстрой инактивации тканевого активатора плазминогена [6]. Хорошо изученным к настоящему времени является 4G/5G полиморфизм в – 675 положении от стартовой точки промотора гена PAI1. В результате делеции/инсерции образует повтор из 4 или 5 оснований гуанина и соответственно, 3 варианта аллелей – 5G/5G, 5G/4G и 4G/4G. В опытах на культуре клеток было показано, что 4G аллель может связываться только с энхансером, что увеличивает синтез PAI. В то же время 5G аллель связывается как с энхансером, так и супрессором, что обусловливает снижение скорости транскрипции при 5G/5G генотипе и соответственно более низкий уровень активности PAI1 [19]. Мы установили, что существует достоверное преобладание генотипа 5G/5G PAI у больных обследованных групп с ПТО и СНМ по сравнению с контрольной группой. Известно, что плазмин непосредственно активирует про-ММР-1, -3–9, -10, -13. PAI препятствует превращению плазминогена в плазмин и, следовательно, противодействует данному пути активации ММР, замедляя деградацию соединительной ткани. Соответственно при 5G/5G генотипе и более низкой функциональной активности PAI происходит повышенное образование плазмина и активация металлопротеиназ, что способствует деградации соединительной ткани у больных с ПТО и СНМ
Заключение
Данные анализа полиморфизма изученных генов подтверждают гипотезу о роли наследственной ДСТ в этиологии и патогенезе ПТО и СНМ. Одним из эндогенных факторов, способствующих развитию данной патологии является мутация генов ММР1, MMP3 и PAI. Необходимы дальнейшие углубленные исследования для решения вопроса о том в какой мере тестирование полиморфизмов генов ММР1 MMP3 и PAI может быть применено для отбора женщин групп повышенного риска по развитию данных заболеваний.



