По данным Всемирной организации здравоохранения, женское бесплодие в общей структуре бесплодия составляет от 8 до 29% и не имеет тенденции к снижению во всем мире [1]. При стабильной частоте традиционных вариантов бесплодия – эндокринный, трубно-перитонеальный, мужской фактор – существенно возросла роль его сочетанных форм [2]. По данным ASRM (American Society for Reproductive Medicine), по крайней мере 25% бесплодных пар имеют более одной причины бесплодия, причем проблемы могут быть у каждого из супругов, и у одного из супругов одновременно может быть несколько проблем [3]. Выявить причину бесплодия может быть достаточно трудно, поскольку встречаются различные комбинации факторов бесплодия, а также существует вероятность, что за диагностированной патологией скрывается еще и неустановленная причина [4]. Кроме того, в ряде случаев после полного клинико-лабораторного обследования причина бесплодия остается невыявленной, и пара считается здоровой. В таком случае говорят о бесплодии неясного генеза, или идиопатическом бесплодии, доля которого в структуре бесплодия может составлять 10–30% [5]. По данным ASRM, причину бесплодия не удается выявить у 10% бесплодных пар. В случае бесплодия неясного генеза нет единого алгоритма дальнейшего диагностического поиска проблемы, что объясняет совершенно различную тактику ведения: от выжидательной тактики (контролируемая индукция овуляции, внутриматочная инсеминация) до сложных протоколов вспомогательных репродуктивных технологий (ВРТ) [6, 7]. Таким образом, бесплодие неясного генеза является серьезной проблемой современной репродуктологии.
Отдельно необходимо отметить, что ряд супружеских пар с уже установленной причиной бесплодия, требующей применения методов ВРТ, не достигают наступления желанной беременности даже после повторных попыток ЭКО. Проблема повторных неудач имплантации, к которым относят не менее 3 неудачных циклов ЭКО с переносом 1 или 2 морфологически нормальных эмбрионов в каждом цикле, очень актуальна в настоящее время, поскольку, несмотря на совершенствование диагностических методов и ВРТ, остается до сих пор нерешенной [8, 9]. Причины неудачных попыток ЭКО с переносом эмбрионов могут быть отнесены либо к неспособности эмбрионов к имплантации в эндометрий (эмбриональный фактор), либо к снижению рецептивности эндометрия (маточный фактор) [10, 11, 12, 13]. Под рецептивностью эндометрия в литературе понимают способность эндометрия принять внедряющуюся бластоцисту. Известно, что перенос эмбриона без генетических аномалий после проведения преимплантационного генетического скрининга во многих случаях не заканчивается наступлением беременности, что может свидетельствовать о маточном факторе бесплодия в связи с нарушением рецептивности эндометрия [12].
Имплантация эмбриона является сложным многостадийным процессом. Эмбрион может имплантироваться только в подготовленный эндометрий, что возможно только в определенный период менструального цикла, называемый «окном имплантации» (6–8 день после пика ЛГ и овуляции). Успешность имплантации эмбриона во многом зависит как от качества самого эмбриона, так и от морфофункционального состояния эндометрия. Морфологические изменения эндометрия наравне с экспрессией определенных факторов (гормонов, цитокинов, молекул адгезии, факторов роста и др.) в эндометрии в этот период являются определяющими для формирования полноценного «окна имплантации» и последующей успешной имплантации бластоцисты. Данные факторы были названы «маркерами эндометриальной рецептивности», к которым относятся различные инструментальные и лабораторные показатели, изменения которых могут повлиять на клинические исходы ЭКО, оцениваемые по частоте наступления беременности [13, 14].
Было выявлено, что в рецептивности эндометрия важную роль могут играть рецепторы эстрогенов и прогестерона. Также выявлен специфический ультраструктурный маркер «окна имплантации» – выросты на поверхности эндометрия (пиноподии), возникающие в середине лютеиновой фазы. Существует ряд доказательств, что начальные процессы прикрепления (адгезии) бластоцисты к эндометрию происходят именно на поверхности пиноподий [15]. Однако в литературе многократно описаны случаи нормальной ультраструктуры поверхности эпителиальных клеток у пациенток с неудачными попытками ЭКО, поэтому образование пиноподий не может быть единственным маркером, характеризующим рецептивность эндометрия [13]. Другими маркерами имплантации являются белки клеточной адгезии, включая интегрины и селектины, способствующие прикреплению эмбриона к эндометрию [16]. Однако, несмотря на то, что в литературе имеются данные об успешном применении определения интегринов в качестве маркеров «окна имплантации», не все исследователи согласны с необходимостью их определения в клинической практике [15]. Многие специалисты считают целесообразным определение в биоптатах эндометрия уровней экспрессии лейкемия-ингибирующего фактора, сосудисто-эндотелиального фактора роста, трансформирующего фактора роста β1 и других маркеров в качестве возможных предиктивных критериев адекватной рецептивности эндометрия [13]. Таким образом, на настоящий момент не существует единственного и оптимального маркера рецептивности эндометрия, в связи с чем продолжается поиск новых информативных маркеров «окна имплантации», что могло бы позволить прогнозировать наступление беременности в программах ВРТ.
Согласно данным литературы, к числу ключевых регуляторов процессов, ответственных за рецептивность эндометрия, относятся гены НОХА10 и НОХА11 [17, 18]. Также было показано, что гиперметилирование промоторов данных генов может быть связано с развитием внематочной беременности [19]. Известно, что оба гена экспрессируются как в ядрах эпителия желез эндометрия, так и в строме эндометрия в различных участках матки. Экспрессия этих генов значительно возрастает в период «окна имплантации» [20]. Обнаружено, что продукт гена НОХА10 играет важную роль в регуляции эмбрионального развития, а также контролирует циклическую трансформацию эндометрия в течение менструального цикла [21]. В исследовании Yang Y. et al. показано, что у женщин с повторными неудачами имплантации была значительно снижена экспрессия НОХА10 гена [22, 23]. Блокирование гена НОХА10 ведет к резкому уменьшению количества пиноподий [16]. Кроме того, в процессе трансформации эндометрия в середине цикла в клетках эндометрия значительно увеличивается экспрессия генов НОХА10 и НОХА11 [24]. Известно, что снижение уровня продукта того или иного гена может быть вызвано как генетическими причинами (полиморфизмом гена или мутацией), так и эпигенетической регуляцией. В частности, метилирование промоторных участков гена может приводить как к снижению экспрессии гена, так и к полной его инактивации («эпигенетическое молчание»). Du H. и Taylor H.S. был проведен обзор работ, в которых было показано, что метилирование промоторов генов НОХА10 и НОХА11 приводит к уменьшению их экспрессии и снижению рецептивности эндометрия [18]. Таким образом, существует достаточно оснований полагать, что гены НОХА10 и НОХА11 играют немаловажную роль в формировании «окна имплантации» и в определении рецептивности эндометрия.
Целью данной работы было исследование статуса метилирования промоторных участков генов НОХА10 и НОХА11 в биоптатах эндометрия у женщин с трубно-перитонеальным фактором бесплодия и неудачными попытками ЭКО в анамнезе.
Материалы и методы
Группу исследования составили 47 пациенток, планирующих реализацию репродуктивной функции в программе ЭКО, обратившхеся в отделение вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова НМИЦ АГП им. В.И. Кулакова для проведения программы ЭКО. Все пациентки соответствовали критериям включения (возраст от 18 до 40 лет, трубно-перитонеальный фактор бесплодия без выраженной патозооспермии партнера, 2 и более неудачных попыток ЭКО в анамнезе, нормальный овариальный резерв, отсутствие оперативных вмешательств на яичниках, информированное согласие на участие в исследовании). Всем пациенткам в рамках подготовки к программе ЭКО проводилось клинико-лабораторное обследование в соответствии с Приказом МЗ от 30.09.2012г №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Также у каждой пациентки в рамках обследования производилась аспирационная биопсия эндометрия (инструментом Pipelle) в период «окна имплантации» (7–9 день после овуляции, диагностированной при помощи ультразвукового исследования и мочевого теста на овуляцию Clear Blue [Unipath Ltd, Великобритания]). Полученные образцы эндометрия были трижды промыты буфером PBS (натрий-фосфатный буфер), затем заморожены и помещены на хранение при температуре –80°С в Биобанк ФГБУ «НМИЦ АГП им. В.И. Кулакова».
Выделение ДНК. Полученные образцы эндометрия измельчали хирургическим скальпелем и гомогенизировали. Выделение ДНК проводилось набором DNeasy Blood & Tissue Kit (Qiagen, USA).
Бисульфитная конверсия. 1 мкг геномной ДНК каждого образца подвергали бисульфитной конверсии (это позволяет химически модифицировать неметилированные остатки цитозина до урацила, что при дальнейшей полимеразной цепной реакции (ПЦР) приводит к подстановке в эту позицию тимина, тогда как метилированные остатки цитозина остаются немодифицированными) с использованием набора EZ DNA Methylation-Gold Kit (ZymoResearch, USA).
ПЦР-амплификация. ДНК-амплификация проводилась при общем объеме реакции 25 мкл, содержащем смесь объемом 1 мкл прямых и обратных праймеров (10 мкмоль) и 2 мкл ДНК после бисульфитного конвертирования. Было использовано 2 праймера из работы Wu et al. [25], которые подобраны к CpG-богатому фрагменту в промоторе НОХА10 на 5’-конце выше экзона I (F I регион).
Прямой:
5’-TGGGGTAGTTTTTATAGTTTTTG-3’.
Обратный:
5’-AACCCTTTCTAACTAACATTTCTT-3’ (биотинилированный).
Условия амплификации: 95°С в течение 1 минуты, после чего – 40 циклов при 95°С в течение 30 с, 55°С в течение 30 с и 72°С в течение 30 с. Конечное воздействие температуры 72°С было в течение 10 минут. Наличие ПЦР-продуктов и их длину определяли с помощью электрофореза в 2,5% агарозном геле с маркерами молекулярного веса 261 bp.
Cеквенирование: амплифицированные фрагменты были секвенированы с использованием полупроводникового секвенирования на приборе Ion S5 (Thermo Fisher Scientific). Приготовление библиотек для секвенирования и секвенирование проводили согласно инструкции производителя.
Для определения степени метилирования проводили выравнивание полученных в результате секвенирования прочтений на референсную последовательность с использование программы bowtie2. После этого подсчитывали количество нуклеотидов С и T (т.е. метилированных и неметилированных нуклеотидов) для каждого CpG-островка.
Для контроля уровня бисульфитной конвертации подсчитывали соотношение нуклеотидов Т к С в каждой позиции вне CpG-островков, где до конвертации был нуклеотид С. Статус конвертации для всего образца был определен как среднее значение для всех позиций и составил не менее 95%.
Всем пациенткам проводилась программа ЭКО по стандартному протоколу с препаратами антагониста гонадотропин-рилизинг-гормона. Стимуляция функции яичников проводилась с применением рекомбинантного фолликулостимулирующего гормона. Триггер овуляции вводился при наличии лидирующих фолликулов диаметром 17 мм и более. В качестве триггера овуляции использовался препарат хорионического гонадотропина. Перенос 1 бластоцисты хорошего качества (по классификации D. Gardner и W.B. Schoolcraft) осуществляли на 5-е сутки после проведения трансвагинальной пункции яичников. Патология эндометрия исключена. При подъеме уровня хорионического гонадотропина в сыворотке крови через 14 дней после переноса эмбриона в полость матки регистрировали биохимическую беременность, а при визуализации плодного яйца в полости матки через 21 день после переноса эмбриона – клиническую беременность.
Статистическая обработка данных выполнялась на индивидуальном компьютере с помощью пaкета статистических программ Statistica 12 (США) и SPSS Statistics 23 (США).
Для качественных данных определяли доли и риски (%). Для сравнения категориальных данных в двух группах, а также для оценки значимых различий между ними использовали непараметрические методы (точный критерий Фишера). Для количественных данных результаты указывались как медиана, 25–75 процентили. Для сравнения количественных данных в двух группах также применяли методы непараметрической статистики (тест Манна–Уитни). Различия между величинами считали статистически значимыми при уровне значимости p<0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Результаты и обсуждение
В зависимости от исхода следующей после проведения пайпель-биопсии программы ЭКО пациентки были разделены на 2 группы: группа 1 – пациентки, у которых беременность наступила; группа 2 – пациентки, у которых беременность не наступила. На основании критерия Колмогорова–Смирнова выявлено, что возраст и антропометрические данные пациенток в исследуемых группах подчинялись закону нормального распределения (p>0,05), однако, учитывая небольшой объем выборки для каждой из групп, мы применяли здесь и далее непараметрические методы расчета. Тест Манна–Уитни не выявил статистически значимых различий по возрасту, росту, массе тела и, как следствие, по индексу массы тела между исследуемыми группами (таблица).
Также не было выявлено статистически значимых различий между группами при оценке менструальной функции (возраст менархе, длительность менструального цикла, продолжительность менструального кровотечения) и половой функции (возраст начала половой жизни) (таблица).
В структуре экстрагенитальных заболеваний статистически значимых различий между исследуемыми группами обнаружено не было. Гинекологическая заболеваемость и акушерский анамнез пациенток также не различались в обеих группах, как видно из таблицы. Следует отметить, что в обеих группах пациенток в анамнезе не было образований яичников, и, как следствие, резекция яичников не проводилась. Также ни у одной пациентки, включенной в исследование, не встречался синдром поликистозных яичников. При проведении сравнительной оценки гормонального статуса пациенток статистически значимых различий выявлено не было.
Нами было сделано предположение, что у исследуемых пациенток с положительным и отрицательным исходом программ ВРТ различается метилирование промоторов НОХА10 и НОХА11 генов, что может влиять на экспрессию данных генов и, как следствие, на рецептивность эндометрия. Промотор гена включает в себя несколько участков последовательности ДНК, в которых рядом находятся цитозиновый и гуаниновый остатки – CpG-островков. Известно, что ферменты, осуществляющие метилирование ДНК (ДНК-метилтрансферазы), могут присоединять метильную группу на цитозин только в области CpG-островков. С метилированием CpG-островков в промоторе гена в конечном итоге связано снижение экспрессии этого гена и подавление его функции.
Метилирование ДНК можно выявить с помощью химической реакции бисульфитной конверсии. В одноцепочечной ДНК бисульфит воздействует на остатки цитозина, что приводит в итоге к их превращению в урацил. Однако в случае присутствия метильной группы на остатке цитозина такая конверсия произойти не может. Зная последовательность нуклеотидов в нормальном геноме человека и последовательность ДНК после проведения бисульфитной конверсии, можно определить, какие CpG-островки были метилированы, а какие – нет. Для определения последовательности после конверсии может быть использован ряд методов, например, метилспецифическая ПЦР, секвенирование по Сэнгеру, секвенирование нового поколения (NGS). Последний вариант позволяет точно и быстро определить в смеси последовательность всех присутствующих последовательностей ДНК.
В связи с тем что при выделении ДНК из образца ткани после пайпель-биопсии происходит лизирование большого числа клеток, в конечную смесь могут попадать различные молекулы ДНК, в части из которых определенный CpG-островок метилирован, а в другой части ‒ нет. Секвенирование позволяет определить наличие в смеси всех возможных вариантов последовательностей, в связи с чем, результаты анализа метилирования каждого CpG-островка выдаются в виде процентного содержания молекул ДНК в общей смеси, в которой конкретный CpG-островок метилирован.
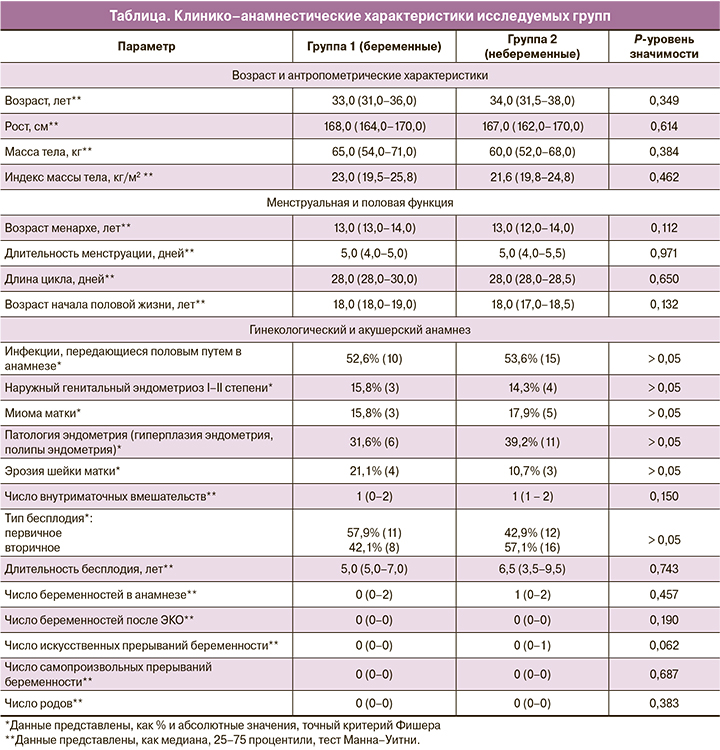
Результаты сравнения профилей метилирования промоторов генов HOXA10 и HOXA11 представлены на рисунках 1 и 2 соответственно.
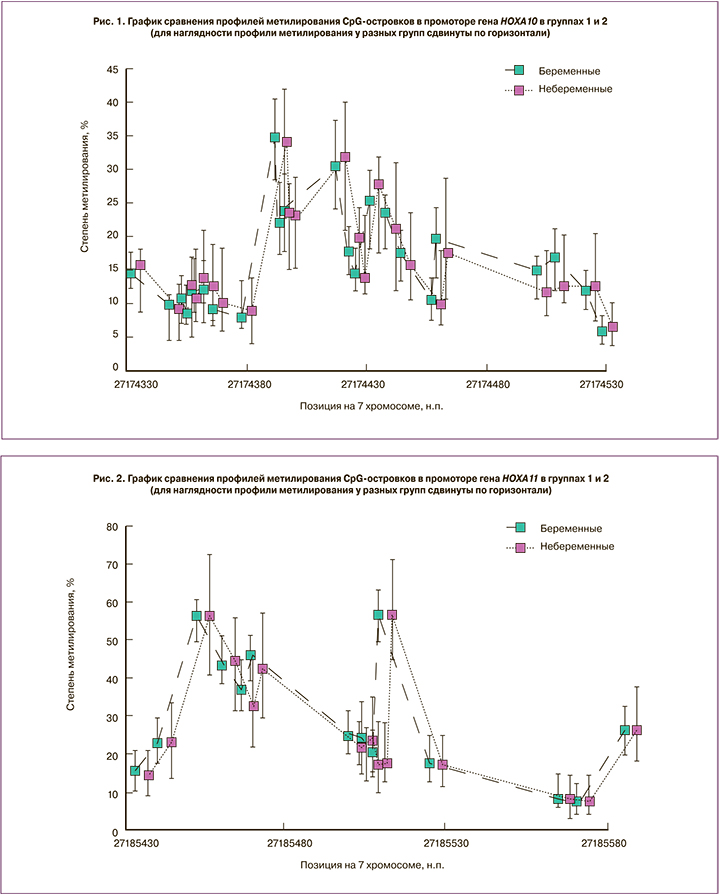
Всего в ходе исследования было проанализировано метилирование 23 CpG-островков промоторного участка гена HOXA10 и 15 CpG-островков гена HOXA11. В результате не было выявлено достоверного различия метилирования ни для одного из CpG-островков обоих генов. Это позволяет предположить, что в исследованной популяции у пациенток с повторными неудачными попытками ЭКО в анамнезе метилирование генов HOXA10 и HOXA11 является довольно консервативным параметром и, по-видимому, не вносит вклада в определение исходов программ ЭКО.
Хотя существует множество исследований, в которых проводится анализ связи метилирования промоторов генов HOXA10 и HOXA11 с различными факторами бесплодия, у женщин с трубно-перитонеальным бесплодием ранее роль метилирования генов HOXA10 и HOXA11 в составе многофакторных моделей не анализировалась. В проспективное обсервационное исследование Margioula-Siarkou C. et al. было включено 65 пациенток с бесплодием различного генеза, у 13 из них был трубно-перитонеальный фактор, а у 15 – бесплодие неясного генеза. В группу контроля вошли 25 здоровых пациенток. В ходе исследования было выявлено, что у пациенток с бесплодием неясного генеза в эндометрии экспрессия HOXA11 статистически ниже, а у пациенток с трубно-перитонеальным фактором бесплодия значимого отличия экспрессии данных генов не обнаруживалось. При этом метилирование генов в данном исследовании не анализировалось [27].
В другом исследовании с наблюдательным когортным дизайном с участием 18 здоровых женщин, 12 женщин с привычными неудачами имплантации и 20 женщин с привычным невынашиванием беременности было выявлено, что в эндометрии здоровых женщин экспрессия белка HOXA10 значимо выше, чем у остальных групп пациенток, что, вероятно, указывает на роль HOXA10 в неудачных исходах программ ВРТ. Однако анализа метилирования генов в данном исследовании также не проводилось [22].
Заключение
Таким образом, ранее у пациенток с трубно-перитонеальным бесплодием и неудачными попытками ЭКО в анамнезе статус метилирования промоторных участков генов НОХА10 и НОХА11 не рассматривался, хотя роль данных генов в неудачных исходах предполагалась. В исследованной нами популяции роль метилирования промоторов генов НОХА10 и НОХА11 для прогноза исходов программ ВРТ не подтвердилась, поскольку профиль метилирования промоторов данных генов является довольно консервативным.



