Согласно последним данным, среди пар репродуктивного возраста распространенность бесплодия составляет 10–15% [1]. Множественные неудачные попытки забеременеть – глубокое психологическое и физическое испытание, которое несет за собой отрицательные последствия, формирующие душевные и личностные особенности такой категории пациентов [2]. В связи с высокой распространенностью Всемирная Организация Здравоохранения признала бесплодие социальным заболеванием, так как оно оказывает воздействие на семьи и общины [3]. Вспомогательные репродуктивные технологии (ВРТ) являются зачастую единственной возможностью получения желанной беременности и рождения здорового ребенка. Несмотря на развитие методов ВРТ, эффективность программы экстракорпорального оплодотворения (ЭКО) в среднем не превышает 40%, а частота родов живым плодом – 33,3% из расчета на один селективный перенос эмбриона в полость матки [4].
Бесплодие является многофакторной патологией, что требует персонифицировать подход к лечению каждой супружеской пары [5]. Одним из наиболее интересных и до сих пор неизученных до конца факторов является бесплодие, обусловленное наличием у пациентки наружного генитального эндометриоза (НГЭ). Актуальность данной проблемы объясняется высокой частотой встречаемости заболевания, наличием множественных нарушений репродуктивной функции при данной патологии, поздним и часто неэффективным использованием методов ВРТ [6, 7].
НГЭ – генетически детерминированный патологический процесс, характеризующийся наличием вне полости матки ткани, по морфологическим и функциональным свойствам подобной эндометрию [8, 9]. Важно отметить, что не все женщины с эндометриозом страдают бесплодием. Однако распространенность этого заболевания намного выше среди женщин, неспособных к самостоятельному зачатию (~30–50%), чем среди фертильного населения (10–15%) [10]. Негативное воздействие на фертильность связывают с возникновением местной воспалительной реакции с последующим повреждением липидов, белков и нуклеиновых кислот [11]. Такая «токсичная среда» влияет и на качество гамет, и на сам процесс оплодотворения, не только снижая шансы на естественное зачатие, но и оказывая отрицательное влияние на качество эмбрионов и их способность к развитию в программах ВРТ [12].
Становится очевидным, что необходимо изучать и внедрять новые неинвазивные методы исследования эмбриона, которые позволят увеличить частоту имплантации и наступления беременности при селективном переносе эмбриона в программах ВРТ.
Уникальными объектами для неинвазивного исследования являются среды культивирования эмбрионов различных стадий развития, а также фолликулярная жидкость (ФЖ), полученная в ходе трансвагинальной пункции яичников. Метаболомное профилирование ФЖ и сред культивирования может предоставить информацию об энергообмене, метаболической активности и состоянии сигнальных систем эмбриона. Оценка молекулярных составляющих сред культивирования является перспективным направлением для поиска маркеров успешной имплантации эмбриона с последующим развитием клинической беременности и рождением здорового ребенка.
В современной метаболомике широко используется метод хроматографического разделения аналитов с последующей масс-спектрометрической детекцией (ВЭЖХ-МС).
В данном исследовании нами был проведен анализ профилей метаболитов ФЖ и сред культивирования, полученных от эмбрионов разных морфологических групп, которые, по данным преимплантационного генетического тестирования (ПГТ), являлись эуплоидными, от пациенток с НГЭ и пациенток контрольной группы. Целью исследования являлось выявление специфических маркеров в профиле метаболитов ФЖ и сред культивирования эмбрионов пациенток с НГЭ для оценки качества и имплантационного потенциала культивируемых эмбрионов человека.
Материалы и методы
В ходе одномоментного исследования в параллельных группах были получены образцы ФЖ и сред культивирования эмбрионов различного морфологического качества от пациенток с НГЭ, а также без эндометриоза, в качестве контрольной группы. В исследование вошла 31 пациентка в возрасте от 23 до 37 лет, проходящие программу ЭКО (ИКСИ) с использованием препаратов гонадотропинов с проведением ПГТ методом сравнительной геномной гибридизации.
Были отобраны ФЖ (72 образца) и среды культивирования эмбрионов (29 образцов), относящихся к группам «отличного» и «хорошего» морфологического качества, согласно классификации Гарднера [13, 14]. После получения данных ПГТ для сравнительного анализа результатов метаболического профиля были выбраны образцы, принадлежащие только эуплоидным эмбрионам группы НГЭ и группы контроля: 27 образцов ФЖ (21 – НГЭ, 6 – группа контроля) и 19 образцов сред культивирования (13 – НГЭ, 6 – группа контроля).
От всех пациенток получено информированное согласие на проведение исследования.
Исследование состава фолликулярной жидкости
Перед проведением ВЭЖХ-МС проводили экстракцию метаболитов добавлением к 100 мкл ФЖ 19 объемов экстракционной смеси метанола, хлороформа и метил-трет-бутилового эфира (в соотношении 4:3:3 по объему), после чего перемешивали в течение 20 минут и центрифугировали (13000 g) 15 минут. Супернатант переносили в чистые виалы и упаривали под струей азота, после чего сухой остаток растворяли в 45 мкл смеси ацетонитрила и изопропанола (1:1).
Для ВЭЖХ-МС-анализа к 45 мкл экстракта каждого образца добавляли 5 мкл внутреннего стандарта с конечной концентрацией 5 мкМ, разделение проб проводили на колонке Acquity UPLC BEH HILIC – 1,7 мкм, длина 15 см, внутренний диаметр 1 мм (Waters, USA) при помощи хроматографической системы Ultimate 3000 Nano LC System (Thermo Scientific, USA).
Элюирование компонентов образцов проводили методом хроматографии гидрофобных взаимодействий в изократическом растворе 5% подвижной фазы «В» (5 мкМ раствор ацетата аммония в воде) и 95% фазы «А» (100% ацетонитрил) в течение 15 минут, затем в градиенте 5–30% подвижной фазы «В» течение 10 минут при скорости потока 50 мкл/мин. Затем промывали 5 минут (95% фазы «В»), после чего в течение 1 минуты возвращалась исходная концентрация фазы «B» в 5% и колонка 3 минуты уравновешивалась. Общее время хроматографического анализа одного образца составило 34 минуты. Детекция метаболитов проводилась на гибридном квадруполь-времяпролетном масс-спектрометре Bruker MaXis Impact (Bruker Daltoniks, Germany) в двух измерениях на один образец. Масс-спектры получали при разрешении 50 000 в диапазоне 100–3000 m/z, в режиме положительно заряженных ионов.
Детектирование пиков, их группировка и коррекция времени удерживания проводилась с помощью программного пакета XCMS [15]. Детекция пиков была выполнена с помощью алгоритма Centwave [16] c параметрами: разброс m/z – 15 ppm; минимальная и максимальная ширина пика – 10 и 50 секунд соответственно. Группировка пиков по всем образцам была выполнена методом Peak Density [17] с параметрами по умолчанию.
Для первичной идентификации метаболитов с соответствующими молекулярными массами использовали базу данных HMDB (www.hmdb.ca).
Исследование эмбриональных питательных сред человека
Культивирование эмбрионов проводилось в индивидуальных каплях культуральных сред (Irvine CSC) одинакового объема (30 мкл). На 5-е сутки культивирования производилась морфологическая оценка полученных эмбрионов с последующим забором в равных объемах (20 мкл) отработанных культуральных сред, которые были промаркированы и заморожены (-80°С).
Перед проведением ВЭЖХ-МС проводили экстракцию метаболитов добавлением трех объемов метанола к одному объему инкубационной среды. После перемешивания преципитат осаждали центрифугированием при 14 000 g, супернатант использовали для анализа.
Для ВЭЖХ-МС-анализа отбирали 18 мкл экстракта каждого образца, добавляли 2 мкл внутреннего стандарта с конечной концентрацией 5 мкМ, разделение проб проводили на колонке Atlantis T3 – 3 мкм, длина 15 см, внутренний диаметр 1 мм (Waters, USA) при помощи хроматографической системы Ultimate 3000 Nano LC System (Thermo Scientific, USA).
Элюирование компонентов образцов проводили методом обращенно-фазной хроматографии в изократическом растворе 5% подвижной фазы «В» (0,1% раствор муравьиной кислоты в ацетонитриле) и 95% фазы «А» (0,1% раствор муравьиной кислоты в воде) в течение 15 минут, затем в градиенте 5–95% подвижной фазы «B» в течение 10 минут при скорости потока 40 мкл/мин. Затем промывали 5 минут (95% фазы «B»), после чего в течение 1 минуты возвращалась исходная концентрация фазы «B» в 5% и колонка 3 минуты уравновешивалась. Общее время хроматографии одного образца составило 34 минуты. Детекция метаболитов проводилась на гибридном квадруполь-времяпролетном масс-спектрометре Bruker MaXis Impact (Bruker Daltoniks, Germany) в двух измерениях на один образец. Масс-спектры получали при разрешении 50 000 в диапазоне 50–1500 m/z, в режиме положительно заряженных ионов.
Детектирование пиков, их группировка и коррекция времени удерживания проводились аналогично методике исследования ФЖ. Для первичной идентификации метаболитов также использовали базу данных HMDB.
Статистический анализ
При анализе как ФЖ, так и сред культивирования эмбрионов человека, для поиска и визуализации наибольших различий между образцами использовался метод многомерной статистики – дискриминантный анализ ортогональных частичных наименьших квадратов (OPLS-DA) [17]. Для проверки статистической значимости различия относительных концентраций (средних интегрированных площадей пика) между группами для конкретных метаболитов использовался t-критерий Стьюдента. Cтатистически значимыми считались те изменения, для которых значение p с учетом коррекции на множественную проверку гипотез (FDR) было меньше 0,05. Дополнительным критерием отбора для потенциальных биомаркеров являлась кратность изменений концентрации не менее чем в 2 раза между группами. Для функционального анализа масс-спектров использовался алгоритм mummichog [18]. Для оценки статистической значимости найденных метаболических путей применялся точный тест Фишера. Статистический анализ был выполнен на платформе Metaboanalyst v5.0 [19].
Результаты
Исследование фолликулярной жидкости
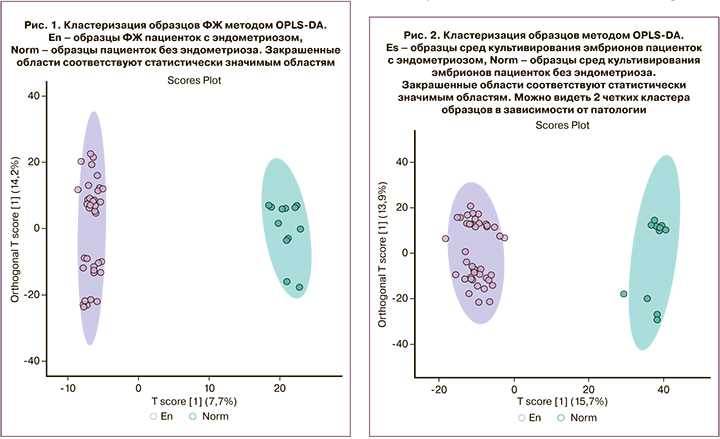
После начальной обработки масс-спектров было детектировано 3103 молекулярных иона. Методом многомерной статистики OPLS-DA была показана четкая кластеризация образцов на две области, соответствующие группам сравнения. Cтепень отличий при этом была ниже, чем при исследовании сред (7,7% изменений обусловлены первой главной компонентой против 15,7% в средах культивирования) (рис. 1). Подобный результат представляется закономерным, поскольку ФЖ в целом более гомеостатична и имеет ограниченный физиологический диапазон для возможных колебаний состава. Поиск компонентов ФЖ, статистически значимо различающихся в группах сравнения с кратностью изменений ≥2, выявил 285 молекулярных ионов. Для идентификации данных молекулярных ионов был произведен поиск в базе данных химических структур метаболитов человека (HMDB), в результате которого был получен список потенциальных биомаркеров. В частности, было выявлено большое количество липидов различных классов (табл. 1.)
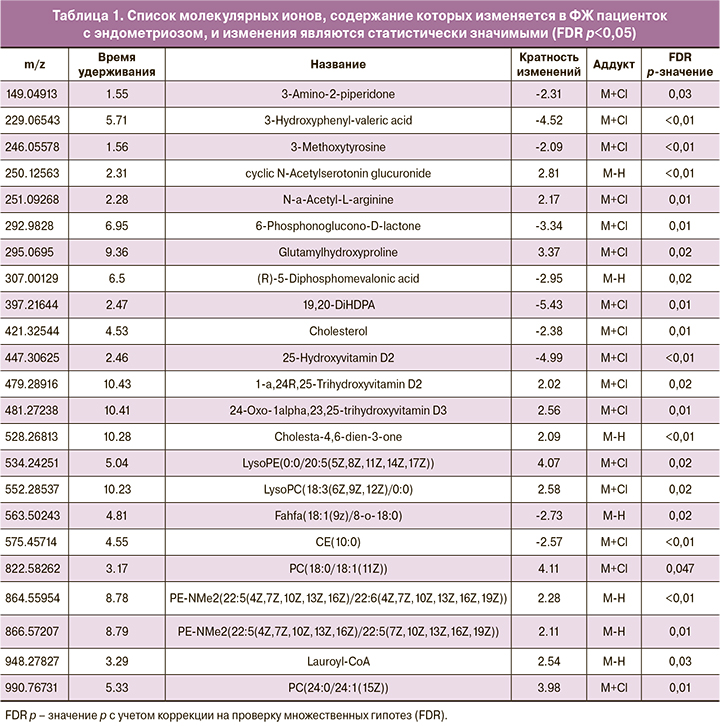
Для поиска вероятных метаболических путей, в которые вовлечены компоненты, обуславливающие различия между группами, был проведен функциональный анализ на основе тех молекулярных ионов, которые вносят вклад в дифференцировку групп по данным OPLS-DA. Выявленные метаболические пути показаны в таблице 2. Значение p соответствует вероятности случайным образом получить подобное пересечение набора наблюдаемых экспериментально метаболитов с метаболитами конкретного метаболического пути, согласно точному тесту Фишера. Среди выявленных путей преобладают пути, связанные с метаболизмом витаминов, липидов (глицерофосфолипидов и производных докозагексаеновой кислоты – нейропростанов), а также гликанов и гликолипидов (силовые кислоты). Из аминокислот представлен только метаболический путь тирозина.
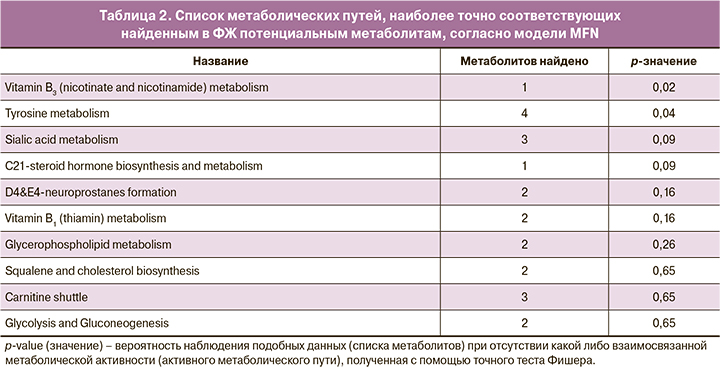
Исследование эмбриональных питательных сред человека
После начальной обработки масс-спектров было детектировано 6923 молекулярных иона. Для первичной оценки распределения образцов и выявления выбросов был использован метод OPLS-DA, который выявил хорошую кластеризацию образцов в зависимости от наличия или отсутствия эндометриоза (рис. 2). Подобная картина свидетельствует о выраженных отличиях метаболомных профилей сред культивирования исследуемых групп эмбрионов. Для поиска потенциальных биомаркеров, обуславливающих наблюдаемые различия, были отобраны молекулярные ионы, концентрации (интегрированные площади соответствующего хроматографического пика) которых между группами статистически значимо (p<0,05) отличались в среднем в 2 и более раза. Всего было отобрано 1213 таких молекулярных ионов. Для идентификации был произведен поиск в базе данных метаболитов человека (HMDB).
В результате были отобраны потенциальные биомаркеры, представляющие наибольший интерес (табл. 3). Обращает на себя внимание отсутствие в списках различающихся масс аминокислот, что указывает на идентичный уровень их потребления из среды эмбрионами обеих групп. В то же время было выявлено большое количество липидов и их производных – жирные кислоты фосфатидилэтаноламины, фосфатидилсерин, моно-и диглицериды, а также ряд других биологически активных молекул.

Статистически значимым считался уровень p<0,05 с учетом коррекции на проверку множественных гипотез (FDR). Кратность изменений рассчитана относительно контрольной группы. Идентификация молекулярных ионов проводилась при помощи базы данных метаболитов человека (HMDB).
Для поиска вероятных метаболических путей, в которые вовлечены метаболиты, обуславливающие различия между группами, был проведен функциональный анализ с использованием базы данных Metaboanalyst. Для функционального анализа отбирались молекулярные ионы, которые внесли наибольший вклад в различия между группами, согласно данным многомерной статистики OPLS-DA. Выявленные метаболические пути показаны в таблице 4. Значения p получены с помощью точного теста Фишера. В эмбриональных питательных средах было выявлено большее количество метаболитов, и, соответственно, метаболических путей, изменяющихся между группами. Так, результаты включали пути метаболизма аминокислот (метионина, цистеина, триптофана), сахаров и жирных кислот. Также выявлялись пути метаболизирования лекарственных средств и ксенобиотиков

Обсуждение
«Омиксные» технологии – сравнительно новые направления исследования, которые позволяют оценить функционирование клеточных структур на различных уровнях – от ДНК и генов до метаболитов. Изучением метаболитов занимается метаболомика, одним из основных методов которой является профилирование состава различных классов низкомолекулярных соединений в клетках и тканях, а также биологических жидкостях [20, 21]. Молекулярное профилирование позволяет выявлять соединения, которые являются участниками путей превращения основных биологически значимых органических молекул.
В последние годы данный подход применялся для поиска специфических молекулярных маркеров, которые позволили бы прояснить патогенез эндометриоза и лучше понять причины и механизмы возникновения ассоциированного с ним бесплодия. Однако изменения состава эндогенных метаболитов ФЖ и сред культивирования эмбрионов при эндометриозе остаются малоизученными [22].
Одним из наиболее универсальных методов профилирования, который широко используется в клинических лабораториях в течение последних 10–15 лет, является разделение метаболитов при помощи ВЭЖХ-МС [23]. Специфичность анализа с использованием ВЭЖХ-МС превосходит иммунологические методы и классическую высокоэффективную жидкостную хроматографию, позволяя разделять сложные многокомпонентные смеси и детектировать больший диапазон различных низкомолекулярных соединений. Данный метод зачастую требует минимальной пробоподготовки, что обеспечивает высокую производительность анализа.
В проведенном нами исследовании были использованы ФЖ, полученные в ходе трансвагинальной пункции яичников и отработанные культуральные среды эуплоидных эмбрионов 5-го дня культивирования, относящиеся к «отличной» и «хорошей» категории у пациенток, включенных в исследование и проходящих программу ЭКО/ИКСИ с ПГТ. В работу вошел только материал от эуплоидных эмбрионов, так как ранее в своем исследовании Зорина И.М. и соавт. не выявили достоверных различий между метаболомными профилями эуплоидных и анеуплоидных эмбрионов, что позволило нам исключить плоидность эмбриона как фактор нарушений метаболизма эмбриона [24].
В ходе исследования были выявлены достоверные различия профилей метаболитов ФЖ и сред культивирования эмбрионов в исследуемых группах пациентов. С использованием баз данных метаболитов человека (HMDB) нами была произведена первичная идентификация соединений, вносящих вклад в установленные различия между группами [25]. Также был проведен анализ метаболических путей, в которых могут принимать участие потенциальные метаболиты.
Известно, что НГЭ развивается на фоне относительной и абсолютной гиперэстрогении и резистентности к прогестерону. У женщин с эндометриозом преобладают прогестероновые рецепторы типа А, укороченная форма которых действует как ингибитор прогестероновых рецепторов типа В, отвечающих за развитие противовоспалительного действия прогестерона [26].
По данным проведенного анализа были обнаружены признаки нарушения стероидогенеза у пациенток с НГЭ. Повышенный уровень холестерина в ФЖ, являющегося предшественником синтеза прогестерона, и снижение в средах культивирования уровней конечных метаболитов обмена прогестерона указывают на дефицит гормона.
Одним из побочных эффектов дефицита прогестерона является нарушение регуляции эндоканнабиноидной системы (ESC). ECS состоит из эндоканнабиноидов: анандамида (AEA) и 2-арахидоноилглицерина, их рецепторов и их регуляторных ферментов [27]. Эндоканнабиноиды представляют собой эндогенные липиды. Снижение уровня прогестерона приводит к потере экспрессии каннабиноидных рецепторов типа 1 (CB1-R) и снижению уровня эндоканнабиноидов [28]. В подтверждение этого нами выявлены сниженные уровни AEA в средах культивирования эмбрионов пациенток с НГЭ. AEA играет важную роль в фолликулогенезе, созревании преовуляторного фолликула, созревании ооцита и овуляции [29]. El-Talatini M.R. et al. в своем исследовании при проведении программ ЭКО/ИКСИ выявили, что при успешной имплантации и прогрессировании беременности наблюдались повышенные уровни AEA в плазме во время овуляции и его сниженные уровни при имплантации [30].
Также были выявлены изменения липидного обмена и метаболизма жирных кислот в ФЖ и средах культивирования пациенток с НГЭ. Липидам и жирным кислотам отводится важная роль в обмене веществ организма, так как они являются структурными компонентами, субстратами для энергетического обмена, а также предшественниками различных медиаторов. В ряде исследований была показано, что нарушения в обмене омега-3 и омега-6 полиненасыщенных жирных кислот (ПНЖК), а также их окисленных производных (оксилипинов) могут быть одним из патогенетических факторов развития эндометриоза [31]. Так, в работе Hopeman M.M. et al. было установлено, что в плазме крови пациенток с НГЭ, прошедших лечение в рамках программ ЭКО/ИКСИ, был снижен уровень эйкозапентаеновой кислоты (омега-3), которая является субстратом для синтеза оксилипинов с низкой воспалительной активностью. Снижение уровня эйкозапентаеновой кислоты и других омега-3 ПНЖК может приводить к увеличению продукции оксилипинов из омега-6 ПНЖК, которые обладают выраженным воспалительным действием. Так, было показано, что при эндометриозе наблюдается повышенная продукция окисленного производного арахидоновой кислоты (омега-6) простагландина E2, являющегося одним из ключевых факторов в развитии воспалительных реакций [32, 33]. В средах культивирования, полученных от пациенток с НГЭ, было зафиксировано повышение уровня арахидоновой кислоты, а также снижение уровня докозапентаеновой кислоты (омега-3) и окисленных производных докозагексаеновой кислоты (омега-3), что может свидетельствовать о нарушении баланса продукции медиаторов липидной природы. Различные оксилипины, помимо участия в воспалительных реакциях, обеспечивают аутокринную и паракринную регуляцию процессов жизнедеятельности клеток. Изменения баланса продукции оксилипинов эмбрионами может приводить к нарушению процессов межклеточных коммуникаций и снижению имплантационного потенциала.
Важным фактором, влияющим на качество гамет у супружеских пар с бесплодием, является окислительный стресс, развивающийся на фоне недостаточной активности систем антиоксидантной защиты [34]. Избыточная продукция активных форм кислорода также может оказывать токсическое действие на эмбрион, что может приводить к нарушениям развития и снижению способности к имплантации [35–37]. Согласно современным представлениям, окислительный стресс является одним из ключевых факторов в патогенезе эндометриоза. Дисбаланс в продукции активных форм кислорода стимулирует пролиферацию клеток эндометриоидных гетеротопий и формирование вокруг них провоспалительного окружения, что может быть одним из факторов снижения фертильности у больных эндометриозом уже при начальных стадиях заболевания [38].
В своем исследовании Halpern G. et al. обсуждают значение дефицита антиоксидантов на прогрессирование эндометриоза [39]. К важным компонентам антиоксидантной системы относят, в частности, витамин Е, индольные производные и витамин D, которые способны оказывать противовоспалительное и иммуномодулирующее действие [40]. Витамины группы D снижают синтез провоспалительных оксилипинов, подавляя экспрессию циклооксигеназы-2 [41]. Изменения метаболитов витаминов D и Е были выявлены нами в ФЖ и средах культивирования эмбрионов в группе НГЭ.
Заключение
Таким образом, в результате проведенного нами исследования были показаны изменения в метаболоме ФЖ и сред культивирования эмбрионов пациенток с НГЭ. На основании полученных данных можно предположить, что наблюдаемое при эндометриозе изменение состава ФЖ может приводить к нарушениям гаметогенеза, а также влиять на процессы оплодотворения за счет формирования провоспалительного микроокружения и нарушения функции антиоксидантной защиты. Различия в составе питательных сред эмбрионов могут быть связаны с тем, что развитие яйцеклеток в провоспалительном микроокружении приводит к эпигенетическому перепрограммированию метаболических путей, которое также сохраняется и на ранних этапах эмбриогенеза. В совокупности данные факторы могут приводить к снижению фертильности у больных эндометриозом. Представляется перспективным продолжение исследований в данном направлении, поскольку понимание причин изменения метаболических процессов позволит найти точки приложения для улучшения эмбриологического этапа программ ВРТ у больных эндометриозом.



