Преэклампсия (ПЭ) – специфическое для беременности осложнение с мультисистемным характером поражения органов и систем, наблюдаемое у 2–8% беременных; является второй по значимости причиной материнской заболеваемости и смертности во всем мире [1]. В структуре причин материнской смертности от ПЭ весомую долю занимают цереброваскулярные осложнения [2–5].
В настоящее время выделена целая группа цереброваскулярных осложнений ПЭ – синдром задней обратимой энцефалопатии, синдром обратимой церебральной вазоконстрикции, геморрагический и ишемический инсульты, а также долговременные нарушения в последующей жизни пациентки после перенесенной тяжелой ПЭ и эклампсии (расстройство когнитивных функций вплоть до сосудистой деменции) [6, 7]. Даже через 5–15 лет после перенесенной ПЭ на магнитно-резонансной томографии могут определяться маркеры поражения мелких церебральных сосудов [7, 8].
Риск развития острых цереброваскулярных осложнений у беременных с ПЭ составляет примерно 1 на 500 родов, в то время как общий риск подобных осложнений во время беременности составляет примерно 30 случаев на 100 000 родов [9].
Причина и патогенез церебральных осложнений ПЭ и эклампсии до конца не изучены. Согласно современным представлениям, большинство цереброваскулярных осложнений при ПЭ рассматриваются в рамках синдрома задней обратимой энцефалопатии. Их развитие обусловлено нарушением ауторегуляции мозгового кровотока, повреждением гематоэнцефалического барьера (ГЭБ) с развитием вазогенного и цитотоксического отека преимущественно в теменно-затылочных областях головного мозга. Реже, после перенесенной ПЭ при проведении компьютерной и магнитно-резонансной томографии обнаруживают инфаркты в субкортикальных зонах белого вещества и смежных с ними зонах коры мозга [10], что может быть причиной повреждения паренхимы головного мозга с остаточными неврологическими проявлениями в последующем.
Церебральная ауторегуляция важна для поддержания адекватной церебральной перфузии в условиях изменения артериального давления (АД). Церебральная перфузия поддерживается относительно постоянной в диапазоне среднего АД между 60 и 160 мм рт. ст., однако линейно изменяется при АД ниже или выше этих значений [11]. Данные о влиянии ПЭ на мозговой кровоток достаточно противоречивы. Многие исследования выявили достоверное повышение церебрального перфузионного давления (ЦПД) у женщин с ПЭ по сравнению со здоровыми беременными [12]. Другие авторы отмечают снижение этого показателя уже на этапе развития беременности (внезапные обмороки, ухудшение памяти, внимания и работоспособности).
Belfort М.А. et al. предположили, что именно повышенное ЦПД способствует развитию вазогенного отека и синдрома задней обратимой энцефалопатии при ПЭ и эклампсии [13]. В этом исследовании настораживает тот факт, что повышение ЦПД сохраняется даже на фоне проводимой интенсивной антигипертензивной терапии [14]. Кроме того, теми же авторами обнаружена прямая корреляция между высоким АД и ЦПД у беременных с ПЭ, что свидетельствует об отсутствии адекватной компенсаторной реакции мозга в ответ на изменение АД и, по сути, о нарушении ауторегуляции мозгового кровотока [14].
В случае развития эклампсии скорость церебрального кровотока и, соответственно, ЦПД достигает максимальной величины в фазе судорожного приступа, однако, в отличие от ПЭ, отсутствует компенсаторное увеличение сосудистого сопротивления [15].
Следствием нарушения ауторегуляции мозгового кровотока является повышенная проницаемость ГЭБ, которая может привести к отеку мозга и судорожному синдрому [16]. Истинная причина повышенной проницаемости ГЭБ при ПЭ достоверно не изучена. Существует гипотеза, согласно которой источником факторов, повреждающих ГЭБ при ПЭ, является ишемизированная плацента [17].
На основании экспериментальных данных предложены две диаметрально противоположные гипотезы возникновения отека головного мозга. Первой хронологически появилась вазоспастическая концепция, согласно которой резкий подъем АД приводит к длительному спазму церебральных сосудов и срыву механизмов ауторегуляции [18]. Эти изменения приводят к гипоксии, эндотелиальной дисфункции и далее к развитию вазогенного и цитотоксического отека мозга [19].
Более поздняя концепция форсированной вазодилатации постулирует, что резкие или значительные подъемы АД, наоборот, индуцируют форсированную вазодилатацию церебральных сосудов с развитием синдрома гиперперфузии головного мозга. Это происходит вследствие срыва ауторегуляторных вазоконстрикторных механизмов и является причиной увеличения мозгового кровотока, повышения давления на стенку сосуда, повреждения ГЭБ и развития вазогенного отека мозга [11, 20]. Наиболее выраженные нарушения, как известно, возникают в задних отделах головного мозга в вертебробазилярном бассейне, обеспечивающем кровоснабжение корковых отделов зрительного анализатора, что, по-видимому, объясняется особенностями иннервации артерий этой области [21].
Учитывая достаточно противоречивые данные о патофизиологических механизмах развития цереброваскулярных осложнений при ПЭ, отсутствие доказательной базы возможностей предикции и их терапевтической коррекции, целью нашего исследования явилось изучение особенностей церебрального кровотока при ПЭ и эклампсии с оценкой возможности прогнозирования и ранней диагностики цереброваскулярных нарушений.
Материалы и методы
Обследованы 174 женщины в возрасте 17–44 года. Из них 117 составили основную группу, в которую вошли беременные с ПЭ (гестационные сроки от 33 до 41 недели), госпитализированные в родильные дома города Москвы (98 – с умеренной ПЭ, 16 – с тяжелой ПЭ, 3 – с эклампсией). В контрольную группу вошли 34 пациентки с физиологическим течением беременности, а также выделена группа из 10 здоровых небеременных и 13 беременных с хронической артериальной гипертензией. Анализируемые группы были сопоставимы по возрасту, паритету, соматическому и гинекологическому анамнезу.
Благодаря разработанному алгоритму экстренного вызова специалиста по допплерографии в соответствующие лечебные учреждения, изучение церебрального кровотока проводилось до начала лечебных мероприятий, за исключением случаев эклампсии. Пациентки после судорожного приступа эклампсии были обследованы совместно с консультативной мобильной нейродиагностической бригадой Московского координационного центра органного донорства непосредственно после экстренного родоразрешения.
Перед проведением допплерометрического исследования кровотока в магистральных артериях шеи и головного мозга обязательно измеряли АД. Допплерометрия проводилась по стандартной методике, датчиками 2 и 4 МГц на ультразвуковом приборе «Сономед 325» («Спектромед», Москва).
Оценивали показатели скорости кровотока (линейная скорость кровотока – ЛСК) и сопротивления периферического русла в артериях каротидного и вертебробазилярного бассейнов. Регистрировали асимметрию ЛСК в парных артериях основания мозга. Также инсонировали доступные локации венозные стволы и синусы мозговых оболочек.
На втором этапе определяли показатели реактивности артерий каротидного и вертебробазилярного бассейнов, а также комбинированные индексы церебрального кровотока с учетом параметров системной гемодинамики (ЦПД, индекс гидродинамического сопротивления (ИГС), индекс церебрального кровотока (ИЦК)).
Внутричерепное давление оценивали на основании показателя Клингельхофера, вычисляемого с учетом величины АД и ЛСК в средней мозговой артерии (СМА).
Процесс исследования сосудов проводился в течение 15–20 минут и происходил одновременно с акушерским осмотром.
Статистический анализ
Статистическую обработку полученных данных проводили с помощью программного пакета Statistica v.8.0. for Windows. Анализ числовых параметров показал, что исследуемые выборки не подчинялись закону нормального распределения (проверка с помощью критериев Лиллиефорса и Колмогорова–Смирнова), в связи с чем для математической обработки материала были использованы непараметрические методы математической статистики.
Для описания количественных признаков был использован перцентильный подход: в качестве меры центральной тенденции признаков вычислялась медиана (Ме – 50-й перцентиль), в качестве интервальной оценки − верхний и нижний квартили (Q1 и Q3 – соответственно 25-й и 75-й перцентили).
Для выявления различий между группами для количественных показателей использовались непараметрические критерии Краскела–Уоллиса и медианный тест, при выявлении статистически значимых различий проводили попарное сравнение с помощью U-критерия Манна–Уитни, применяя поправку Бонферрони.
Статистически значимыми считали различия при уровне значимости р<0,05, а при множественных сравнениях для 4 групп – р<0,0125.
Результаты
В контрольной группе женщин с физиологическим течением беременности в экстракраниальных сегментах каротидной системы (в обеих сонных артериях, надблоковой артерии (НБА)) отмечалось снижение средней, конечной диастолической и пиковой ЛСК до 24% по сравнению с группой небеременных. В позвоночных артериях ЛСК повышалась лишь на 3–10%.
При развитии ПЭ в общей и внутренней сонных артериях (ОСА, ВСА) нами зарегистрировано постепенное снижение ЛСК на 15–37% на фоне соответствующего уменьшения периферического сопротивления. Наиболее выраженные изменения отмечены при тяжелой ПЭ (табл. 1). При тяжелой ПЭ отмечено также наиболее выраженное снижение ЛСК и в позвоночной артерии (ПА) (на 21–28%).
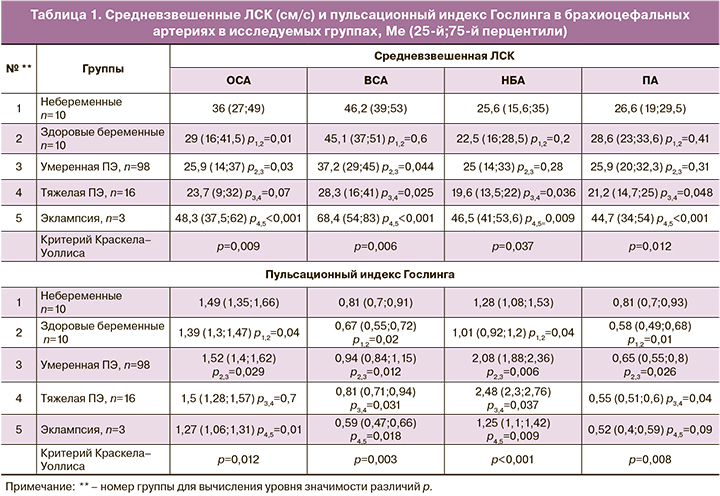
По мере нарастания тяжести ПЭ выявлено нарастание степени асимметрии ЛСК в парных артериях основания мозга.
После судорожного приступа эклампсии картина резко меняется: имеет место значительное снижение периферического сопротивления на фоне двукратного возрастания ЛСК, что свидетельствует о вазодилатации и формировании феномена мозговой гиперперфузии. При этом рост ЛСК относительно тех же параметров при тяжелой ПЭ достигал 170%.
Анализ кровотока в интракраниальных артериях при умеренной ПЭ показал несколько разнонаправленные изменения: регистрировалось снижение ЛСК во всех артериях основания мозга на фоне роста периферического сопротивления в СМА и снижения периферического сопротивления в артериях вертебробазилярной системы (табл. 2). При нарастании тяжести ПЭ выявляются асинхронные изменения ЛСК с итоговым суммарным увеличением на 10–15% и снижением периферического сопротивления на 15–20%.
Таким образом, полученные нами данные свидетельствуют о разнонаправленных изменениях периферического сопротивления в экстра- и интракраниальных сегментах ПА и однонаправленных – в тех же сегментах сонных артерий, что отчасти может объяснить преимущественные поражения задних отделов головного мозга при ПЭ. После судорожного приступа эклампсии регистрируется резкое ускорение ЛСК во всех интракраниальных артериях на 60–100% и снижение периферического сопротивления, что в сочетании с индексом Линдегаарда, не превышающим 2,0, указывает на выраженную вазодилатацию и церебральную гиперперфузию, аналогичную изменениям потока в экстракраниальных сегментах мозговых сосудов.
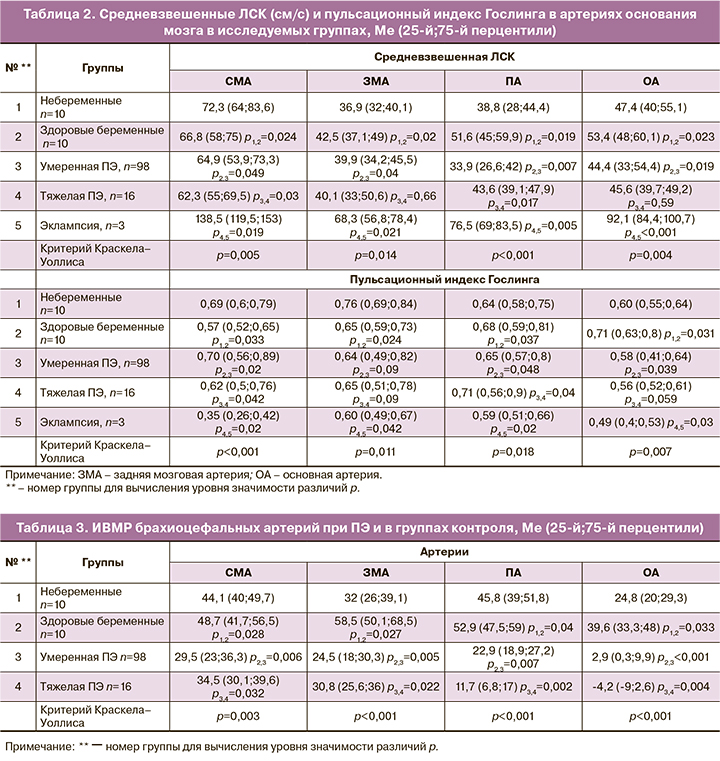
Паттерн брахиоцефального и интракраниального кровотока у женщин в финальной фазе эклампсии носил характер реверберирующего, т.е. с двумя одномоментно направленными фазами. В период судорожного припадка нами зарегистрирован ретроградный поток в НБА, соответствующий крайней степени повышения внутричерепного давления (ВЧД) с выраженными признаками затруднения венозного оттока.
Также нами были отмечены довольно значительные изменения показателей резистивности кровотока в артериях виллизиева круга при ПЭ по сравнению со здоровыми беременными и небеременными. Наиболее выраженные изменения выявлены при оценке пульсационного индекса Гослинга (табл. 1, 2).
Оценка реактивности церебральных сосудов при проведении апноэтической и гипервентиляционной пробы у пациенток с ПЭ показала резкое снижение вазоконстрикторного резерва при одновременном повышении дилатационного по мере нарастания степени тяжести данного осложнения беременности. Наиболее выраженные изменения зарегистрированы в артериях заднего бассейна.
При тяжелой ПЭ также имело место повышение индекса вазомоторной реактивности (ИВМР) в артериях каротидной системы на фоне его резкого снижения (вплоть до отрицательных значений) в артериях вертебробазилярной системы. Такие показатели ИВМР, характеризующего церебральный гемодинамический резерв, у данной категории женщин свидетельствуют о развитии парадоксальных цереброваскулярных реакций на дыхательные пробы (табл. 3).
Таким образом, изменения церебрального кровотока при ПЭ происходят волнообразно и асинхронно в вертебробазилярной и каротидной системах. Умеренная ПЭ характеризуется спазмом крупных артерий и дилатацией артерий мелкого калибра. Дальнейшая динамика приводит к паралитической дилатации мозговых артерий с феноменом тотальной мозговой гиперперфузии. Также увеличивается степень асимметрии ЛСК в парных артериальных стволах. Отмечается прогрессирующее снижение резерва церебральной сосудистой ауторегуляции параллельно с нарастанием тяжести ПЭ, что наиболее выражено в артериях заднего бассейна.
После судорожного приступа эклампсии степень сосудистых расстройств достигает максимума, проявляясь резким падением церебрального кровотока, развитием отека мозга и максимальным повышением ВЧД, вплоть до тампонады мозга с исходом в церебральную смерть.
Ультразвуковое исследование церебральных сосудов проводилось в венозных позвоночных сплетениях и орбитальных венах, средних и задних мозговых венах, вене Галена, прямом и кавернозном синусах. По мере нарастания тяжести ПЭ регистрировалось повышенное количество инсонируемых венозных стволов и общее увеличение ЛСК в лоцированных сосудах. При тяжелой ПЭ характерной находкой явился ретроградный кровоток в орбитальных венах. Перечисленные изменения являются свидетельством выраженного нарушения венозного оттока из полости черепа, обусловленного повышением ВЧД.
Оценка ВЧД позволила выявить также нарушения церебральной ликвородинамики. При умеренной ПЭ имело место относительное снижение ВЧД, при тяжелой ПЭ – повышение, особенно выраженное в короткий период, предшествующий судорожному приступу. После приступа эклампсии отмечено резкое снижение ВЧД, однако далее, в случае тяжелого состояния пациентки (постэкламптическая кома, развитие отека мозга), ВЧД вновь возрастает до критических величин. Вычисление ВЧД проводилось с помощью индекса Клингельхофера (1988), включающего среднюю ЛСК в СМА и среднее АД.
Статистически значимых различий в показателях индекса Клингельхофера у беременных контрольной группы и у небеременных нами не выявлено: 1,08 (Q1;Q3 – 1,02;1,14) и 1,03 (Q1;Q3 – 0,9;1,08) соответственно. При умеренной ПЭ индекс Клингельхофера возрастает почти на 35% – до 1,38 (Q1;Q3 –1,3;1,49), а при тяжелой – достигает максимальных значений 1,67 (Q1;Q3 – 1,58;1,79), возрастая на 62,1%. Через 30–40 минут после эклампсии регистрировалось снижение индекса Клингельхофера до величин, характерных для контрольной группы, – до 1,06 (Q1;Q3 – 0,99;1,15). Однако в случае развития постэкламптической комы значения этого индекса более чем в 2 раза превышали его показатели у беременных с тяжелой ПЭ и в 3,5 раза – у здоровых беременных (3,71; Q1;Q3 – 2,97;4,53).
Таким образом, изменения ВЧД при ПЭ довольно динамичны. По мере нарастания тяжести ПЭ и усугубления цереброваскулярных нарушений ВЧД постепенно нарастает, достигая максимальных значений непосредственно перед судорожным приступом. В случае благоприятного исхода после разрешения эклампсии ВЧД резко падает практически до нормального уровня; в случае осложненного течения – возрастает до критических величин, являясь эквивалентом тяжелого отека головного мозга.
Качественная оценка церебрального кровотока (табл. 4) должна проводиться с учетом особенностей центральной гемодинамики и величины системного АД. С этой целью на заключительном этапе нашего исследования проведена оценка ЦПД, ИГС и ИЦК (расчет индексов проводился по формулам Ааслида в модификации Белфорта (1994, 2001)).
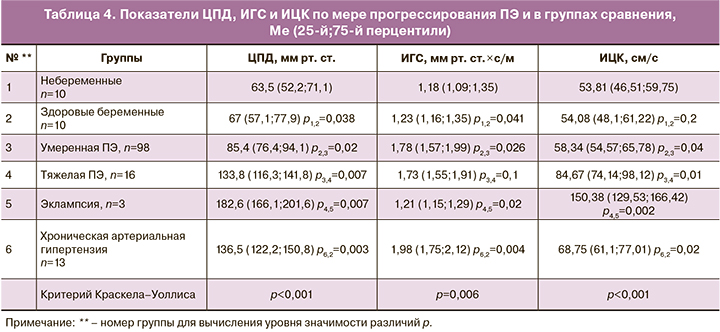
При развитии ПЭ нами отмечено повышение ЦПД и ИГС, особенно выраженное при тяжелой ее форме.
ИЦК – обобщающий показатель мозгового кровотока, который является относительно константной величиной и отражает адекватность кровоснабжения головного мозга. При физиологической беременности значимых изменений ИЦК не происходит. В случае появления первых признаков умеренной ПЭ на начальном этапе регистрируется снижение ИЦК на 25% по сравнению со здоровыми беременными. При нарастании тяжести ПЭ отмечается значительный подъем до 110%. Такие высокие цифры ИЦК сопровождаются уже неврологическими симптомами (головная боль, нарушение зрения, сознания и др.).
После судорожного приступа эклампсии ЦПД возрастает в 1,5 раза, сосудистое сопротивление снижается на 50%, а ИЦК увеличивается на 75% (в 3 раза относительно показателя здоровых беременных). При тампонаде мозга ЦПД падает до критических величин, ИГС возрастает в 3,5 раза, ИЦК падает практически до нуля, что, по сути, является эквивалентом смерти мозга.
В группе беременных с хронической артериальной гипертензией ЦПД, ИГС и ИЦК статистически значимо не отличались от тех же показателей в группе с тяжелой ПЭ. В этой группе в целом определялись повышение периферического сопротивления, умеренный церебральный вазоспазм и однонаправленное снижение сосудистой реактивности в вертебробазилярной и каротидной системах, что кардинально отличается от физиологической перестройки мозгового кровотока во время беременности.
Кратко резюмируя результаты проведенного исследования, необходимо выделить следующее.
1. При физиологической беременности развивается умеренная дилатация мозговых сосудов; при этом сдвиги показателей кровотока в экстра- и интракраниальных сегментах артерий каротидной и вертебробазилярной систем разнонаправлены (механизм компенсации). В вертебробазилярной системе сохраняются показатели кровотока, сходные с таковыми у небеременных.
2. Развитие ПЭ характеризуется одновременно церебральной вазодилатацией одних участков мозговых сосудов и вазоконстрикцией других, которые асинхронны в каротидной и вертебробазилярной системах, что завершается формированием особого типа кровотока – сочетанием вазоконстрикции крупных артерий и паралитического расширения более мелких – артериол.
3. Резерв церебральной ауторегуляции при физиологической беременности возрастает преимущественно за счет повышения способности мозговых сосудов к вазодилатации. При развитии и прогрессировании ПЭ имеет место снижение резерва ауторегуляции, особенно выраженное в сосудах вертебробазилярного бассейна.
4. У беременных с хронической артериальной гипертензией показатели церебрального кровотока свидетельствуют о наличии стойкого ангиоспазма во всех артериях основания мозга с относительным снижением резерва церебральной ауторегуляции.
5. По мере развития и прогрессирования ПЭ нарастают нарушения венозного оттока из полости черепа, достигая критически высоких значений при эклампсии.
6. Приступ эклампсии приводит к усугублению нарушений церебрального кровотока, что при тяжелом течении сопровождается критическим повышением ВЧД на фоне сочетанного отека головного мозга, возможным формированием терминально низкого мозгового кровотока, свидетельствующего, по сути, о клинической смерти мозга.
Обсуждение
Система кровоснабжения головного мозга состоит из сосудов вертебробазилярного и каротидного бассейнов с многочисленными анастомозами. Полученные нами данные о динамике параметров церебральной перфузии при неосложненной беременности свидетельствуют об относительном снижении интенсивности кровотока в каротидной системе и его небольшом увеличении в вертебробазилярном бассейне. Возможно, снижение ЛСК в артериях каротидной системы связано с изменением гормонального фона, свойственного беременности. В свою очередь, увеличение ЛСК в ПА во многом обусловлено различием в нейрогенной регуляции кровотока вертебробазилярного и каротидного бассейнов: различное соотношение симпатических и парасимпатических влияний на стенки артерий «заднего бассейна», иной рецепторный аппарат ПА.
Вызывают немало вопросов впервые выявленные нами разнонаправленные изменения сосудистого тонуса в экстра- и интракраниальных сегментах артерий вертебробазилярной и каротидной систем. Как у здоровых беременных, так и при развитии ПЭ, в экстракраниальных сегментах ПА регистрируется значимое снижение сосудистого тонуса, в интракраниальных – повышение (в отличие от внутренних сонных артерий, где тонус в обоих сегментах меняется синхронно). Такой дисбаланс гемодинамических показателей при тяжелой ПЭ и эклампсии свидетельствует о снижении компенсаторных возможностей регуляции кровотока в сосудах вертебробазилярной системы.
При своевременном родоразрешении беременных с ПЭ/эклампсией и отсутствии тяжелых осложнений показатели кровотока у этих пациенток восстанавливались в течение 2–3 дней послеродового периода. В случае прогрессивного ухудшения состояния женщин, перенесших тяжелую ПЭ и эклампсию, как правило, регистрировался неэффективный кровоток в ВСА и ПА со снижением диастолического, а затем и систолического компонента.
Полученные результаты исследования могут объясняться развитием вазоконстрикции в крупных артериях и дилатации в более мелких на фоне общего нарушения их реактивности. Динамика параметров церебрального кровотока при развитии и прогрессировании ПЭ определяется нарастанием нарушений всех скоростных и резистивных характеристик мозгового кровотока, чередующимися процессами вазоконстрикции и вазодилатации крупных и мелких стволов церебральных артерий, снижением резерва церебральной ауторегуляции.
Нарушения церебрального кровотока при ПЭ сопровождаются и ухудшением венозного оттока, о чем свидетельствует увеличение ЛСК в венозных стволах, достигающее критических показателей при эклампсии. В условиях церебральной гиперперфузии отсутствие возможности быстрой перестройки кровотока в венозной системе приводит к дисбалансу между АД и ВЧД, что еще больше повышает ЦПД и создает условия для развития вазогенного отека мозга. Судорожный приступ эклампсии характеризуется резким, «скачкообразным» ростом ЦПД, ИГС и ИЦК, являясь пусковым механизмом целого каскада патологических процессов, в конечном итоге приводящих к повреждению (порой необратимому) мозгового вещества.
Важным клиническим симптомом ПЭ является артериальная гипертензия. Однако понятно, что величина АД отнюдь не всегда отражает тяжесть патофизиологических изменений. В пользу данного факта свидетельствуют результаты исследования церебрального кровотока у беременных с хронической артериальной гипертензией. В этой группе пациенток регистрировались признаки церебрального ангиоспазма с относительным снижением резерва церебральной ауторегуляции, сходные с индексами реактивности сосудов, обнаруженными при ПЭ. Интенсивность церебрального кровотока в группе с хронической артериальной гипертензией (в отсутствие ПЭ), хоть и была значительно выше таковой у здоровых беременных, однако не достигала тех же показателей у беременных с ПЭ.
Таким образом, кардинальные отличия изменений тонуса артериальной стенки мозговых сосудов при хронической артериальной гипертензии и при ПЭ заключаются в вазоконстрикции в первом случае и вазодилатации – во втором. При эклампсии регистрируется эффект чередования обоих этих процессов одновременно, но в разных сегментах одних и тех же артерий (так называемый «сосисочный спазм»).
Кроме того, у беременных с хронической артериальной гипертензией, в отличие от пациенток с ПЭ, выявляется все же менее выраженное снижение гемодинамического резерва в сосудах вертебробазилярной системы, а также меньший разрыв в показателях реактивности вертебробазилярной и каротидной систем. Такие особенности мозгового кровотока при хронической артериальной гипертензии свидетельствуют о сохранности компенсаторных сосудистых реакций на более физиологическом уровне, что позволяет поддерживать церебральную перфузию в условиях быстрого или резкого подъема АД.
ЦПД, ИГС и ИЦК у беременных с хронической артериальной гипертензией сходны с таковыми у женщин с ПЭ, однако отсутствуют тяжелые повреждения головного мозга, характерные для последней. Вероятно, важное значение в данной ситуации имеет временной фактор – длительное существование хронической артериальной гипертензии (еще до беременности) приводит к постепенной и более устойчивой адаптации мозгового кровотока. Кроме того, характерное для ПЭ развитие системного эндотелиоза обусловливает принципиально иные показатели реактивности и тонуса мозговых сосудов, особенно в ответ на резкое или высокое АД [22, 23].
С нашей точки зрения, первичным звеном патогенеза при ПЭ является повреждение эндотелия мозговых сосудов преимущественно мелкого и среднего калибра, потеря его фенотипических свойств, что влечет за собой увеличение проницаемости ГЭБ, развитие вазогенного отека, ишемическое повреждение мозга и цитотоксического отека.
Необходимы дальнейшие исследования в отношении дифференцированного подхода к назначению тех или иных препаратов (с преобладающим вазоконстрикторным или вазодилатирующим эффектом), поддержания адекватного ЦПД, сохранения компенсаторных механизмов. Рандомизированное исследование Sonneveld M.J. et al. показало, что при применении нимодипина у пациенток с ПЭ чаще отмечалось развитие эклампсии по сравнению с монотерапией сульфатом магния [14]. Эти результаты могут быть объяснены с позиции разнонаправленного влияния этих препаратов на церебральную гемодинамику.
Влияние антагонистов кальция на церебральную перфузию не всегда однозначно. Самые ранние исследования показали, что эти препараты усиливают кровоток в здоровых участках мозга, вызывая при этом «синдром обкрадывания» ишемических очагов [24]. Однако недавнее достаточно крупное исследование Zhang J. et al. не подтвердило негативного влияния этих препаратов при ишемическом инсульте, не отмечено увеличения частоты неблагоприятных исходов и смерти (за исключением применения достаточно высоких доз нифедипина, что явно ухудшало исходы) [25].
Считается, что основной механизм гибели клеток центральной нервной системы при ишемии, включая нейроны, глию и эндотелиальные клетки сосудов, представляет собой онкоз (онкотическая смерть клеток) [26].
При тяжелой ишемии мозга истощение АТФ приводит к повреждению ионного насоса и нарушению ионного гомеостаза. Дисбаланс между входом внутрь клеток ионов Na+ и Cl- и выходом ионов K+ создает трансмембранный осмотический градиент с последующим движением воды в клетки, что приводит к набуханию клеток и онкозу. В то же время массивный приток кальция в клетки является общим механизмом их гибели через активацию протеаз, фосфолипаз и разрушение митохондрий. Истощение АТФ также приводит к высвобождению из нейронов и астроцитов глутамата, который, наряду с деполяризацией мембраны нейронов, активирует NMDA-рецепторы, что приводит к резкому увеличению в нейронах кальция и натрия [27]. Возникло предположение, что терапия антагонистами кальция может иметь определенный нейропротекторный эффект, блокируя приток кальция в клетки. Действительно, некоторые исследования показали, что антагонисты кальция снижают смертность и инвалидность, к примеру, при субарахноидальном кровоизлиянии [28], улучшая перфузию мозговой ткани в области ишемической полутени (зоны вторичной ишемии).
Блокирование неконтролируемых ионных потоков представляет собой новую стратегию в нейропротекции при ишемических поражениях головного мозга.
Возможно, более строгая и четко контролируемая антигипертензивная терапия, направленная на снижение ЦПД, могла бы привести к снижению частоты церебральных осложнений у этих женщин, однако в этом направлении необходимы дальнейшие исследования.
Заключение
При развитии ПЭ формируются сосудистый церебральный спазм одних участков и паралитическая дилатация других мозговых артерий, приводящие к неравномерной перфузии головного мозга. Усиленный приток крови в полости черепа способствует нарушению венозного оттока; эти явления в совокупности вызывают повышение ВЧД и отек головного мозга.
Результаты нашего исследования свидетельствуют о том, что появление неврологических симптомов у пациентов с ПЭ связано с патологическим изменением гемодинамики в бассейне вертебробазилярной системы. Таким образом, транскраниальная допплерометрия может быть крайне полезна для оценки перфузии головного мозга у беременных с ПЭ. Необходимы дальнейшие исследования для определения оптимальных пороговых значений показателей кровотока в сосудах вертебробазилярной системы для прогнозирования неврологических симптомов, связанных с дисфункцией церебральной ауторегуляции.



